Chinese Journal of Applied Chemistry ›› 2024, Vol. 41 ›› Issue (12): 1804-1812.DOI: 10.19894/j.issn.1000-0518.240164
• Chemistry Teaching and Experiment Innovation • Previous Articles Next Articles
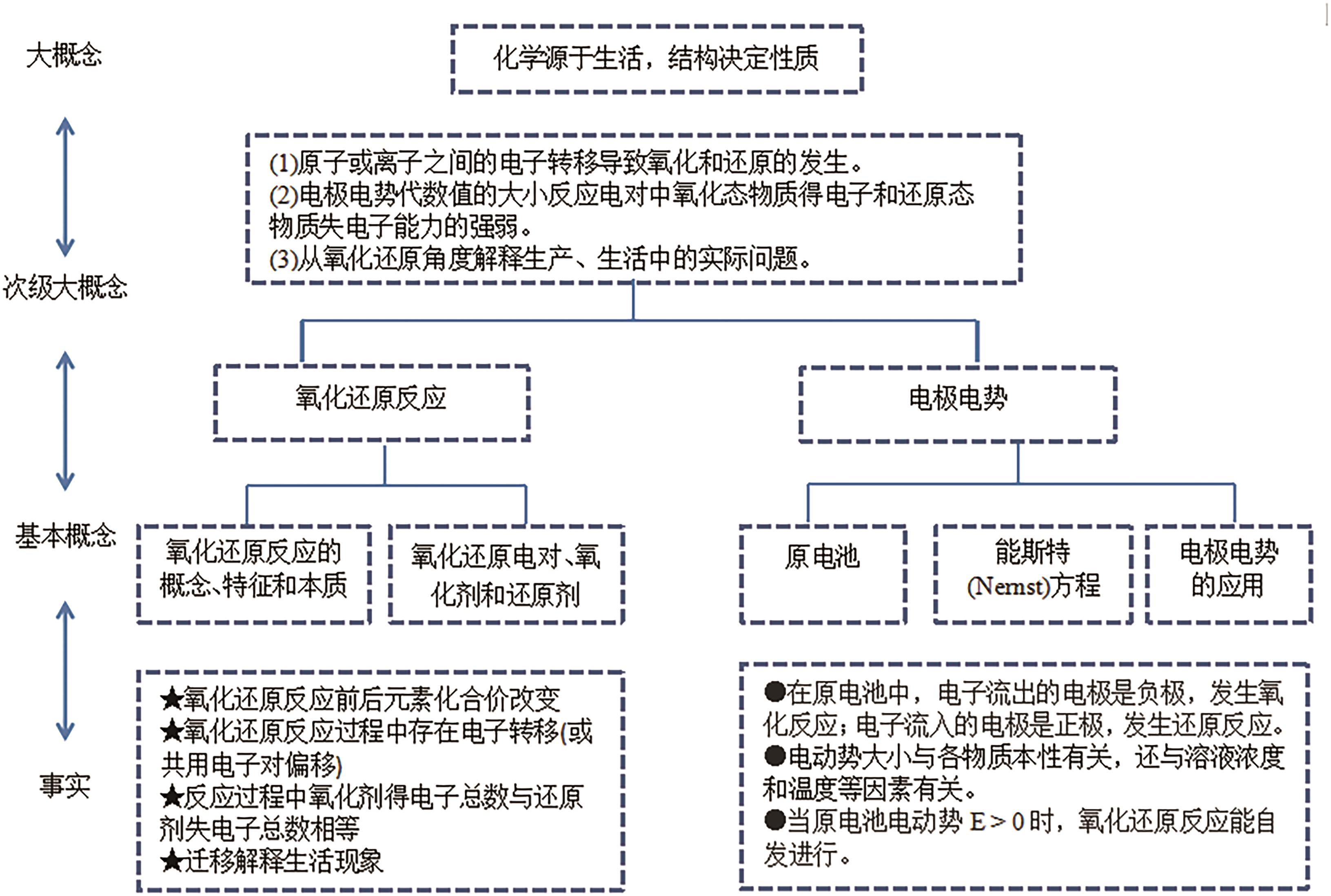
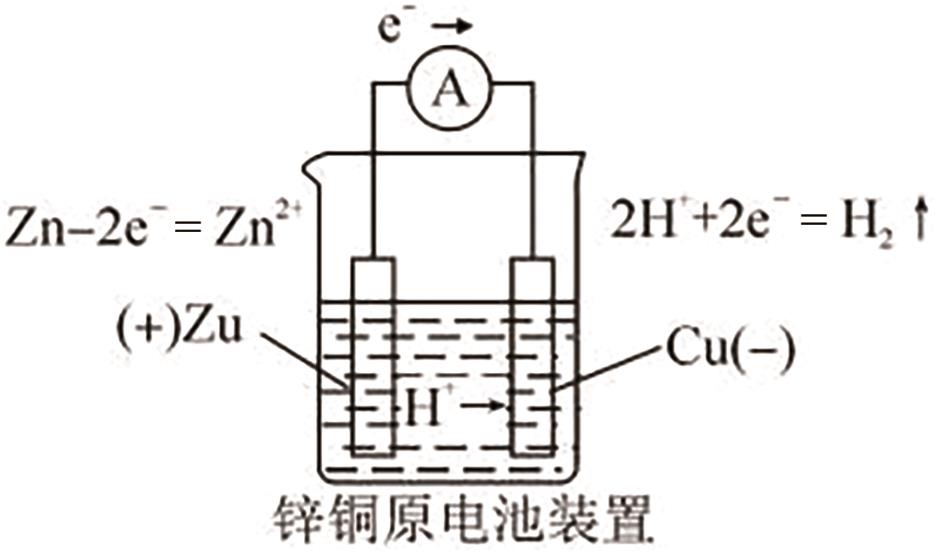
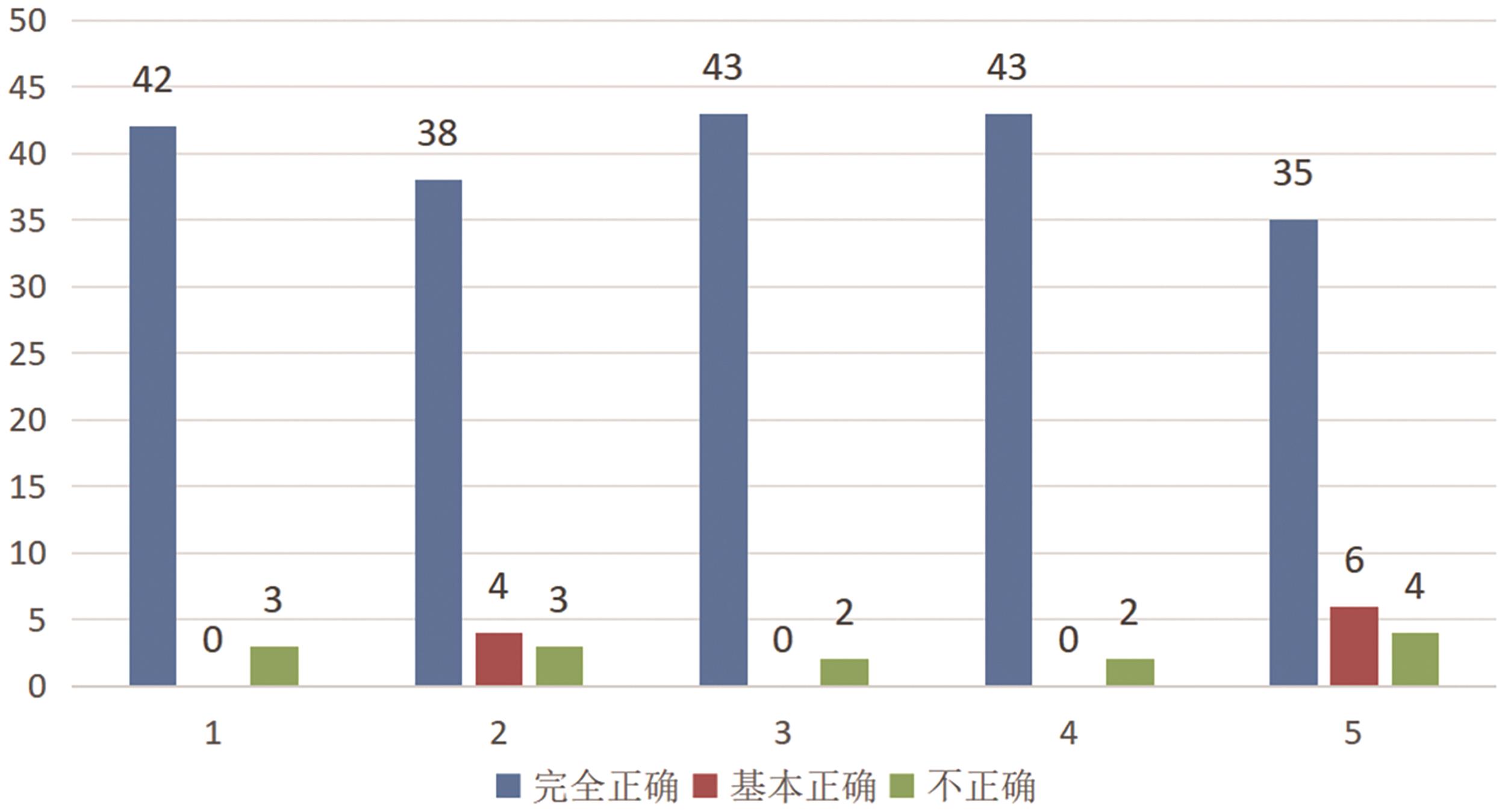
Structured Teaching Practice in Real-Life Contexts Guided by Major Concepts of Disciplines
- 1.School of Finance and Trade,Zhengzhou Shengda University,Zhengzhou 451191,China
2.College of Environment and Life Science,Weinan Normal University,Weinan 714099,China