邻硝基苯- β-D-吡喃半乳糖苷(ONPG)法和双糖酶法是常用的乳糖酶活力测定方法,本文对这两种方法的线性范围、检出限、精密度、准确度和稳定性进行了比较。 结果显示,ONPG法在线性范围、检出限、精密度以及稳定性方面均优于双糖酶法,但此种方法的重复性较差,需要进一步的优化。 对比这两种方法,可为乳糖酶活力测定方法的合理选取提供参考。
Both o-nitrophenyl β-D-galactopyranoside(ONPG) method and disaccharase method are commonly used for the determination of lactase activity. This paper compared the linear range, detection limit, precision, accuracy and stability of these two methods. It is found that ONPG method is better than disaccharase method in linear range, detection limit, precision and stability, but this method has poor repeatability and needs further optimization.
乳糖酶是一种与腹泻相关的重要肠道功能酶,乳糖酶活性测定方法对乳糖酶缺乏症的诊断及乳糖酶制剂的活性测定非常重要。 目前,乳糖酶活性定量检测方法主要有:双糖酶法、邻硝基苯- β-D-吡喃半乳糖苷(ONPG)试验法、稳定同位素法、高效液相色谱法及粪便还原糖测定法[1]。 双糖酶法[2]、ONPG试验法[3]因其试剂组成简单、成本低、操作简便等特点而在实验室中得到广泛的应用。 ONPG法的原理为ONPG在乳糖酶的作用下生成邻硝基酚(ONP),ONP在碱性的条件下呈现黄色,可利用紫外-可见分光光度法(UV-Vis)在波长420 nm处检测。 双糖酶法是临床采取小肠粘膜样本进行双糖酶活性测定的检测方法,亦称小肠粘膜活检法,此种方法测乳糖酶活力的原理为乳糖在乳糖酶的作用下分解为等量的葡萄糖和半乳糖,葡萄糖在葡萄糖氧化酶作用下释放出H2O2,后者在过氧化氢酶作用下使无色的邻联茴香胺氧化显红色,可在420 nm处利用UV-Vis检测。 本文对两种常用乳糖酶测定方法的线性范围、检出限、精密度、重复性以及稳定性进行比较,旨在为乳糖酶活性测定方法提供一定的参考。
图1A和1B分别是ONPG法和双糖酶法测定乳糖酶活性的吸光值(即OD420)标准曲线。 通过空白溶液的吸光值(见辅助材料表S1和表S2)和标准曲线计算得ONPG法和双糖酶法的检出限( S/N=3)分别为156和170 U/g。 双糖酶法在低浓度时成线性关系而高浓度偏离线性的原因可能有以下两点:首先,双糖酶法中所用显色剂主要是由葡萄糖氧化酶、过氧化物酶等组成,大部分酶均存在饱和点,即在一定的条件下,当所有的酶与底物结合生成中间产物后,即使再增加底物浓度,中间产物浓度也不会增加,酶促反应速度也不增加[4],这可能就是双糖酶法标准曲线测定中吸光值不会随葡萄糖含量的增加而无限增加的原因。 其次,葡萄糖在葡萄糖氧化酶的作用下生成葡萄糖酸和过氧化氢,当体系中H2O2的含量增加时,部分过氧化氢被过氧化物酶分解,这可能导致吸光值随着葡萄糖含量增加反而有所下降。
 | 图1 ONPG法(A)和双糖酶法(B)的线性范围与直线回归方程Fig.1 Linear range of ONPG(A) and disaccharase(B) methods and linear regression equations |
按两种方法平行配制6份样品,每份样品在相同的条件下测定10次,结果见辅助材料表S3与表S4。 ONPG法6个平行样品酶活10次测量的RSD分别为0.32%、0.23%、0.23%、0.16%、0.12%和0.33%,平均RSD为0.23%;而双糖酶法6个平行样品酶活10次测量的RSD分别为0.94%、1.13%、1.36%、1.22%、1.08%和0.68%,平均RSD为1.07%。 ONPG法6个样品的10次测量平均值的RSD为7.71%,而双糖酶法为3.87%。 由此可以发现ONPG法的精密度较好,而重复性较差,可能原因与ONPG底物溶液不稳定有关[1],久置可见许多絮状物,而ONPG底物溶液一般需放置一周后才能使用,这可能是导致ONPG重复性差的原因。 双糖酶法的重复性较好,但是精密度较差,可能与反应后整个溶液体系的稳定性有关。 邻苯二茴香胺在95%乙醇中溶解度并不大,能明显地看到棕褐色细小的悬浮物存在。 这一点从加入曲拉通X-100中可以得到佐证。 曲拉通X-100为非离子表面活性剂,在UV-Vis中可用于增加溶液的稳定性以及灵敏度[5]。 另外葡萄糖被葡萄糖氧化酶氧化生成的葡萄糖酸微溶于乙醇等有机溶剂[6],而Tris-glucose oxidase(TGO)显色剂中邻苯二茴香胺、曲拉通X-100洗涤液均为95%的乙醇溶液配制,这在一定的程度上解释了双糖酶法精密度差的原因。
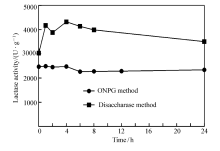
考虑到ONPG法的重复性较差,故在相同的条件下按两种方法各配制3份样品,将3份样品混合放置不同时间,分别测定两种方法的吸光值,数据见图2。 从图2可以看出,ONPG法所配制的样品随着放置时间的延长波动较小,反映用此种方法所得到的反应体系液较为稳定。 而用双糖酶法所配制的样品随放置时间的延长波动较大,提示用此种方法测定乳糖酶活力时应尽早测定,这样得到的结果较为可靠。
上述研究表明,ONPG法在线性范围、检出限、精密度以及稳定性方面均优于双糖酶法,是实验室乳糖酶活力测定的首选方法。 但由于ONPG底物溶液的不稳定性,导致平行样品之间吸光值偏差较大,需要进一步进行方法优化,例如,可将底物溶液进行离心后再统一进行测定。
实验部分
722型紫外-可见光分光光度计(UV-Vis,上海创萌生物科技有限公司)。 ONP为分析纯试剂;ONPG、葡萄糖氧化酶、过氧化物酶和二茴香胺均为生物试剂,乳糖酶为食品级,以上试剂均为市售;三羟甲基氨基甲烷(Tris,生物试剂美国Amresco公司),蒸馏水自制。
参照文献[3],在洁净的试管中加入1 mL 5 mg/mL样品酶液,平行制作3份,37 ℃预热后加入1 mL 20 mmol/L ONPG底物溶液,置于37 ℃的恒温水浴锅中反应10 min。 随后加入3 mL 0.5 mol/L的Na2CO3溶液终止反应,于420 nm处测定吸光值。空白对照中样品酶活事先经过灭活,其它步骤与上述一致。
参照文献[2],在洁净的试管中加入0.1 mL 5 mg/mL样品酶液,预热后加入0.1 mL 0.056 mol/L乳糖底物溶液,平行制作3份,于37 ℃的恒温水浴锅中反应60 min,随后用蒸馏水补足至1 mL,立即置于100 ℃的沸水中煮沸2 min,终止反应。 待试管冷却至室温后,各管加入6 mL TGO显色剂于37℃显色60 min,于420 nm处测定各管的吸光值。 空白对照中样品酶活事先经过煮沸灭活,其它步骤与上述一致。
ONPG法所测得的酶活单位为(U/g),而双糖酶法所测得的酶活单位为(U/mL),两种方法的单位不一致,需要将单位换算为一致方可进行比较。 转换公式如式(1)所示:
式中,U1(U/g);U2(U/mL); V为样品酶液总体积(mL); m表示样品酶液总体积中所含乳糖酶的质量(g)。
辅助材料(Supporting Information)[检出限、精密度以及重复性的原始数据]可以免费从本刊网站(
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|