将2,3-环氧丙基三甲基氯化铵(CTA)与壳聚糖反应,制备了水溶性壳聚糖季铵盐(HTCC),然后,以HTCC与氯乙酰氯反应得到氯乙酰壳聚糖季铵盐(CAHTCC),最后,以吡啶取代CAHTCC中的活泼氯,得到水溶性壳聚糖双季铵盐(PAHTCC)。 通过红外光谱和13C核磁共振光谱等技术手段对产物结构进行了表征,同时测试了原料壳聚糖及其衍生物清除羟自由基、超氧阴离子以及DPPH的活性。 结果表明,PAHTCC的活性较原料壳聚糖及壳聚糖单季铵盐HTCC均有明显提高,在实验浓度1.6 g/L时,其对羟自由基、超氧阴离子及DPPH的清除率分别达到68.5%、74.3%和80.8%。 聚阳离子性大幅增强,进而抗氧化活性提高。
Reveived 2014-06-12; Revised 2014-08-19; Accepted 2014-10-30
Water soluble chitosan quaternary ammonium salt derivative(HTCC) was prepared via reaction of chitosan and 2,3-epoxy propyl trimethyl ammonium chloride(CAT) firstly. Secondly, CAHTCC was obtained by reaction of chloroacetyl chloride and HTCC. Finally, double quaternary ammonium salt derivative of chitosan(PAHTCC) was synthesized by reaction of pyridine and CAHTCC. The structure of HTCC, CAHTCC and PAHTCC were characterized by FT-IR and13C NMR. The HO·, ·
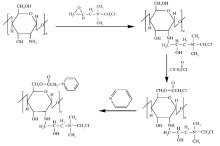
壳聚糖(Chitosan)是一种天然多糖, 因其具有良好的生物相容性、生物无毒性以及生物可降解性、抗菌活性和抗氧化性等, 被广泛应用于食品、医药以及化工等领域。 壳聚糖易溶于酸性溶液, 据报道, 这种酸性溶液具有一定的保湿、抑菌作用, 原因是形成了聚阳离子[1], 但壳聚糖在中性或碱性水溶液中溶解性差[2]。 壳聚糖的分子结构中含有C2— NH2和C6— OH, 可对其进行化学改性。 为了改善壳聚糖的水溶性, 并提高分子的聚阳离子性能, 在壳聚糖分子中引入季铵盐结构成为壳聚糖衍生物研究的热点领域之一[3]。 本文以壳聚糖为原料, 将2, 3-环氧丙基三甲基氯化铵引入到壳聚糖, 主要为C2-氨基与其反应, 然后对产物剩余活性较高的C6— OH进行氯乙酰化反应, 最后
以吡啶取代氯乙酰基中的氯, 得到了壳聚糖双季铵盐衍生物(PAHTCC)。 其主要反应历程如Scheme 1所示。
壳聚糖(食品级, 粉末状, 来自虾壳, 脱乙酰度97%, 平均相对分子质量2.0× 105), 2, 3-环氧丙基三甲基氯化铵(化学纯), 还原型辅酶I烟酰胺腺嘌呤二核苷酸(NADH)、硝基四氮唑蓝(NBT)、吩嗪硫酸甲酯(PMS)、DPPH均为Sigma公司产品, 番红花为生物染色素, 其它均为分析纯试剂。
Nexus型 FT-IR红外光谱仪(美国尼高力公司), KBr压片法测定。 AVANCE IIITM 500型Bruker 500 M核磁共振光谱仪(瑞士布鲁克拜厄斯宾有限公司), D2O溶液中测定。 Vario MICRO cube型元素分析仪(德国Elmentar公司)。 722型分光光度计(上海精密科学仪器有限公司)。
1.2.1 HTCC的制备 称取壳聚糖(CTS)4.83 g, 加入异丙醇15 mL与蒸馏水45 mL, 在85 ℃水浴中与2, 3-环氧丙基三甲基氯化铵(ETA)(0.06 mol)磁力搅拌下反应一定时间(5 h), 反应完毕, 加入冰丙酮使产物从溶液中沉淀, 静置, 抽滤。 用丙酮乙醇的混合溶液(体积比4∶ 1)洗涤, 得到壳聚糖季铵盐(HTCC)。 产物在红外电热干燥箱内60 ℃下干燥6 h后备用。
1.2.2 CAHTCC的制备 称取一定质量(1 g左右)的壳聚糖季铵盐(HTCC), 加入20 mL的1-甲基-2-吡咯烷酮, 室温下搅拌, 待壳聚糖季铵盐溶解后加入2 mL的氯乙酰氯, 常温下搅拌反应24 h后, 加入过量乙醚, 使产物从溶液中析出, 静置, 抽滤。 乙醚洗涤, 得到氯乙酰化壳聚糖季铵盐(CAHTCC)。 产物在红外电热干燥箱内60 ℃下干燥6 h后备用。
1.2.3 PAHTCC的制备 称取一定质量(1 g左右)的氯乙酰化壳聚糖季铵盐(CAHTCC), 加入20 mL二甲基亚砜, 在60 ℃水浴中与1 mL吡啶搅拌反应一定时间(24 h), 将反应液倾入过量丙酮中, 产物从溶液中析出, 静置, 抽滤。 丙酮洗涤, 干燥, 得到双季铵化壳聚糖(PAHTCC)。
1.3.1 清除羟自由基(· OH)活性测定 用比色法来测量· OH的含量。参考文献[4]方法, 实验体系反应总体积为4.5 mL, 其中含磷酸钠盐缓冲液(pH=7.4)150 mmol/L, 磷酸缓冲液1 mL, 2 mmol/L EDTA-Fe 0.5 mL, 3%过氧化氢1 mL, 360 mg/L的番红花1 mL, 样品溶液1.0 mL, 以上分别加入试管中混匀, 置于37 ℃水浴锅中使其反应30 min后, 在520 nm处测定样品的吸光度, 空白组以1 mL蒸馏水替代供试样品, 对照组以1.0 mL蒸馏水和1 mL磷酸缓冲液替代过氧化氢和样品。 清除率为:
E/%=
式中, A样品、A空白和A对照分别为加入样品后的吸光度、空白组的吸光度和对照组的吸光度。
1.3.2 清除超氧阴离子自由基(·
F/%=
式中, A和A1分别为空白和加入样品后的吸光度值, 参比值A0=0。
1.3.3 清除DPPH自由基活性测定 采用DPPH法检测壳聚糖及其衍生物清除DPPH自由基的能力, 从而进一步验证样品的抗氧化能力[6](注:由于壳聚糖原料在上述3种自由基清除测试方法中所述pH值条件下不溶, 采用的方法为, 壳聚糖原料液在超声波条件下分散, 采用跟其它样品完全一样的操作后, 离心, 取上清液测试相应波长下的吸光度)。
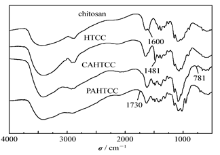
图1比较了壳聚糖及其衍生物HTCC、CAHTCC和PAHTCC的红外光谱。 894和1154 cm-1处为壳聚糖的多糖骨架吸收峰, 氨基的吸收峰在1600 cm-1[7]处。 图中, 以此为原料得到的HTCC的红外光谱图中, 1600 cm-1处氨基的吸收峰消失, 新出现了1481 cm-1处— N+(CH3)3的较强弯曲振动吸收峰[8]。 氯乙酰化以后, 在CAHTCC 的红外谱图中, 新出现了1730 cm-1处的谱峰, 归属为羰基的特征峰[9]。 同时, 在781 cm-1处新出现的峰归属为C— Cl键的特征吸收峰。 证明氯乙酰化反应发生。 比较而言, 壳聚糖结构中, C2— NH2的活性最强, C6— OH, C3— OH活性相对较低, 其中C3— OH又由于空间位阻比较大, 因此, C6— OH化学活性大于
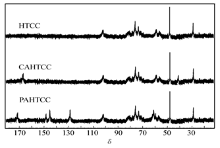
为进一步确定产物结构, 对产物进行了13C NMR 光谱测定, 由图2可见, 除了壳聚糖的骨架峰, 壳聚糖衍生物HTCC、CAHTCC及PAHTCC的谱图中均在δ 47.2处出现了一强峰, 归属为— N+(CH3)3的碳峰, CAHTCC与HTCC谱图比较多出了δ 166.9处 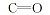
根据元素分析得出产品取代度结果如表1所示。
| 表 1 HTCC、CAHTCC和PAHTCC的产率及取代度 Table 1 The yield and substitution degree of HTCC, CAHTCC and PAHTCC |
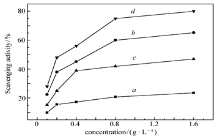
图3、图4、图5分别为壳聚糖、HTCC、CAHTCC、PAHTCC对· OH、·
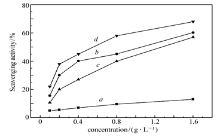 | 图 3 壳聚糖(a)、HTCC(b)、CAHTCC(c)和PAHTCC(d)对羟自由基的清除率Fig.3 HO( scavenging activity of chitosan(a), HTCC(b), CAHTCC(c) and PAHTCC(d) |
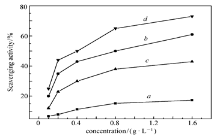 | 图4 壳聚糖(a)、HTCC(b)、CAHTCC(c)和PAHTCC(d)对超氧阴离子自由基的清除率Fig.4 · |
本文采用活性基团拼合原理合成了系列壳聚糖衍生物, 并探讨了壳聚糖衍生物的取代基团以及分子结构对抗氧化活性的影响。 主要结论如下:壳聚糖衍生物的抗氧化活性相对大小顺序为PAHTCC> HTCC> CAHTCC> 壳聚糖。 HTCC抗氧化活性明显高于壳聚糖。 原因是在壳聚糖分子中接入了季铵盐结构, 分子的聚阳离子性增加。 CAHTCC活性低于HTCC, 原因是经氯乙酰氯的酰化修饰对HTCC本身正电荷没有增强作用, 反而使其分子中活泼羟基和氨基数目减少。 据文献[7, 14]报道, 天然多糖的抗氧化活性与其分子中羟基和氨基的数目有关。 PAHTCC抗氧化活性最强, 原因是在其分子结构中形成了双季铵盐结构, 分子中聚阳离子性增强, 抗氧化活性提高。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|