通过Sonogashira偶联等反应,合成了三嵌段化合物9,10-双-(对-(甲氧基二缩三乙二醇基)苯基乙炔基)蒽,通过1H NMR和基质辅助激光解吸电离时间飞行质谱(MALDI-TOF-MS)对其结构进行了表征。利用差示扫描量热仪(DSC)、偏光显微镜(POM)及小角X射线散射仪(SAXS)等技术手段对其本体自组装行为进行了研究,结果表明,化合物在固态相自组装成近晶A相(SmA相)。光谱分析表明,该化合物继承了二取代蒽类发光材料具有高荧光量子产率( Φf)的特点,是一种性能良好的光致发光材料。
9,10-Bis((4-(2-(2-(2-methoxyethoxy)ethoxy)ethoxy)phenyl)ethynyl)anthracene(1) was synthesized by Sonogashira coupling. Its structure was characterized by1H NMR and MALDI-TOF mass spectroscopy. The self-assembling behavior of compound 1 was investigated by means of differential scanning calorimetry(DSC), thermal polarized optical microscopy(POM), and small-angle X-ray scattering(SAXS) at the bulk state. Compound 1 self-assembled into smectic A phase(SmA) in the solid state. Spectroscopic analysis suggested that compound 1 inherited the characteristic of high fluorescence quantum yield( Φf) of disubstituted anthracenes. The title compound 1 is a kind of photoluminescence materials with good performance.
近些年来, π 电子共扼体系有机化合物引起了人们广泛的兴趣。 这是因为除了在电子转移、电荷分离[1]以及分子自组装[2]的理论研究上有重要的意义外, 这类化合物还有可能作为新型光电功能材料, 其中以刚柔嵌段聚合物材料为主体的新型电子和光电子器件的设计、开发, 在化学和材料学研究领域逐渐显示出广泛的应用前景而倍受学术界和产业界注目[3, 4, 5, 6]。 作为发光层中的主体发光材料, 首先应具备良好的荧光效应。 在发光材料中, 蒽环作为π 电子中心被很多新颖的荧光化合物利用, 蒽的衍生物作为发光材料具有荧光量子产率(Φ f)高、较好的稳定性以及颜色范围宽等优点[7, 8, 9]。 由于蒽分子具有平面结构, 分子之间易聚集产生结晶, 这大大降低了蒽在有机发光器件中的实际应用价值[10]。 据文献报道, 在蒽分子的9, 10位引入有机基团, 减少蒽分子之间的聚集, 同时又有较好的光电性能, 则会大大提高蒽衍生物在有机发光器件中的实际应用价值[11]。
目前研究有关含蒽的刚柔嵌段分子聚集体结构的研究报道较少[11], 为了研究含蒽的ABA刚棒线团分子中甲氧基二缩三乙二醇基柔性链部分对分子自组装的影响, 本文以蒽作为分子的刚性中心, 在9, 10位通过炔键连接苯环, 苯环的对位再连接聚合度为3的聚环氧乙烷链, 合成了9, 10-双-(对-(甲氧基二缩三乙二醇基)苯基乙炔基)蒽(1)。 利用差示扫描量热仪(DSC)、偏光显微镜(POM)和小角X射线散射仪(SAXS)等技术手段对其本体聚集体结构进行了研究; 通过光谱分析, 计算了化合物在不同溶剂中的荧光量子产率。
柱层析硅胶(4874 μ m, 山东青岛海洋化工厂); 9, 10-二溴代蒽, 三乙二醇单甲醚, 对甲基苯磺酰氯(TsCl), 碘化亚铜, 四(三苯基膦)钯, 三甲基硅炔, 三乙胺均购自Aldrich公司; 碘代苯酚购自Alfa公司; 氢氧化钾, 碳酸钾购自阿拉丁试剂公司; 所用试剂均为分析纯, 使用前均经常规处理。
Bruker AM-300型核磁共振仪(德国Bruker公司); AXIMA-CFRTM型飞行质谱仪(日本Shimadzu公司); Perkin Elmer DSC-7型差示扫描量热仪(美国Perkin Elmer公司), 升、降温速度均为10 ℃/min, N2气流速20 mL/min; 配有Mettler FP82型热台的Nikon Optiphot 2-pol型偏光显微镜(日本Olympus公司); UV-1650PC型紫外-可见分光光度计(日本Shimadzu公司); F-4500型荧光分光光度计(日本日立公司); X射线散射数据在北京高能物理研究所同步辐射装置(BSRF)1W2A小角散射站和韩国浦项工大同步加速器的3C2 X-ray测试站测得; 在软件Material Studio 4.3中进行Corey-Pauling-Koltun(CPK)分子长度的模拟。
参比法测试荧光量子产率Φ f, 9, 10-双(苯基乙炔基)蒽作为标准物; 1 cm× 1 cm石英比色皿, 在相同的条件下测量样品溶液和标准物溶液的荧光光谱图。 设置各项荧光光谱测量参数如下:扫描范围200700 nm; 激发狭缝EX=3 nm, 发射狭缝EM=3 nm; 灵敏度:高; 响应时间:自动; 扫描速度:快速。
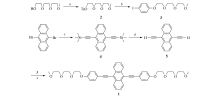
目标化合物1(9, 10-双-(对-(甲氧基二缩三乙二醇基)苯基乙炔基)蒽)的合成路线如Scheme 1所示。
1.3.1 化合物2(甲氧基二缩三乙二醇对甲苯磺酸酯)的合成 按照文献[12]方法制备。 于250 mL单口瓶中将三乙二醇单甲醚(5.00 g, 30.45 mmol)和TsCl(9.28 g, 48.72 mmol)用50 mL二氯甲烷溶解, 加入吡啶(15 mL, 152.50 mmol), 室温搅拌12 h, 加水(30 mL)继续搅拌2 h, 用12 mol/L稀盐酸中和至pH< 7, 所得溶液用二氯甲烷萃取, 无水MgSO4干燥。 抽滤, 浓缩后粗产物用柱色谱法进行纯化, 以乙酸乙酯作洗脱液, 得到黄色液体8.20 g, 产率88%。 1H NMR(300 MHz, CDCl3), δ :7.73(d, J=8.3 Hz, 2H, Ar), 7.33(d, J=8.3 Hz, 2H, Ar), 4.07(t, J=4.8 Hz, 2H, OCH2CH2OSO2), 3.423.85(m, 36H, CH3(OCH2CH2)2OCH2CH2OSO2), 3.28(s, 3H, OCH3), 2.38(s, 3H, CH3phenyl)。1.3.2 化合物3(对-碘-(甲氧基二缩三乙二醇基)苯)的合成 按照文献[12]方法制备。 将过量的碳酸钾, 碘代苯酚(0.48 g, 2.42 mmol)和化合物2(0.70 g, 2.20 mmol)溶于30 mL乙腈, 回流24 h。 抽滤, 滤液浓缩后水洗, 乙酸乙酯萃取, 无水MgSO4干燥, 抽滤, 浓缩后粗产物用柱色谱法进行纯化, 以乙酸乙酯作洗脱液, 得到浅黄色液体0.68 g, 产率85%。 1H NMR(300 MHz, CDCl3), δ :7.52(d, J=8.4 Hz, 2H, Ar), 6.68(d, J=8.4 Hz, 2H, Ar), 4.08(t, J=4.6 Hz, 2H, phenylOCH2CH2O), 3.84(t, J=4.6 Hz, 2H, phenylOCH2CH2O), 3.533.71(m, 8H, phenylOCH2CH2O(CH2CH2O)2CH3), 3.37(s, 3H, OCH3)。1.3.3 化合物4(9, 10-双-(三甲基硅炔基)蒽)和化合物5(9, 10-双-乙炔基蒽)的合成 按照文献[13]方法制备。 化合物4:1H NMR(300 MHz, CDCl3), δ :8.57(dd, J=6.6, 3.0 Hz, 4H, Ar), 7.59(dd, J=6.6, 3.3 Hz, 4H, Ar), 0.43(s, 18H, SiCH3)。化合物5:1H NMR(300 MHz, CDCl3), δ :8.61(dd, J=6.6, 3.0 Hz, 4H, Ar), 7.62(dd, J=6.6, 3.3 Hz, 4H, Ar), 4.07(s, 2H, 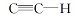
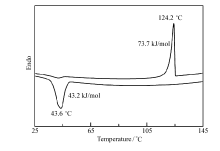
目标化合物1在本体状态的自组装行为通过DSC、POM和SAXS散射法进行了研究。 图2为利用DSC测得的加热和冷却时的热流变化曲线, 化合物1在加热到124.2 ℃时转变成各向同性的液体。 从各向同性的液体缓慢冷却, 通过偏光显微镜起初观察到逐渐增长的棒状织构, 随后形成焦点圆锥织构, 这是SmA相的典型织构(图3A)。 图3B为化合物1从各向同性液体冷却至80 ℃时测得的SAXS图, 小角区域展现4个尖峰, q值比为1∶ 2∶ 3∶ 4, 广角区域显示一个略宽的光环, 中心约在0.40 nm, 进一步验证了SmA相的存在。 由(001)衍射峰的q值可计算出层间距为4.2 nm, 接近于分子长度(Corey-Pauling-Koltun模拟分子长度4.5 nm), 说明形成了单层的层状结构, 图3C为自组装成SmA相示意图。
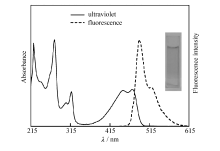 | 图4 化合物1在二氯甲烷中的归一化光谱图Fig.4 The normalized spectrogram of compound 1 in dichloromethane c=1× 10-6 mol/L, λ ex=473 nm |
化合物1的紫外-可见吸收光谱和荧光光谱图见图4。 其吸收光谱在215515 nm有5个吸收峰, 明显分成两个部分, 350515 nm是整个分子的吸收, 215350 nm是蒽部分的特征吸收, 表现出类似苯的3个典型谱带(E1、E2、B带), 可归属于芳环的π -π * 电子跃迁。 从图4可知, 化合物1的E1带吸收峰位于222 nm, E2带吸收峰位于274 nm, B带吸收峰位于317 nm。 — OR为助色团, 助色团取代芳环, 由于氧原子的n电子与芳环形成p-π 共轭体系, 与单独的蒽分子相比, E1、E2和B带均红移, 并且B带的强度增大, 失去其精细结构的特征。 化合物1在不同溶剂中的B带吸收情况见表1。 从表1结果可知, 在不同溶剂中最大吸收波长基本不变, 与分子的非极性特征有关。
| 表1 化合物1在不同溶剂中的B带吸收情况 Table 1 B band absorption of compound 1 in different solvents |
化合物1的最大发射波长为488 nm并伴有肩峰, 由于该发射波长在可见光区, 在稀溶液时, 肉眼可以观察到绿色荧光(见图4插图)。 自溶液中观察到的荧光, 通常称为斯托克斯荧光, 其特点是荧光波长比激发光波长更长, 荧光光谱较相应的吸收光谱红移, 这来自于电子的弛豫效应。 荧光量子产率Ф f是衡量化合物发光能力的一个重要参数, 采用参比法测量了化合物1的荧光量子产率, 实验中, 采用9, 10-双(苯基乙炔基)蒽为荧光标准物, 同样配制成c=1× 10-6 mol/L的环己烷溶液, 其荧光量子产率为0.87[14]。 各化合物在不同极性介质中的最大紫外吸收峰
| 表2 化合物1在不同溶剂中的光谱参数 Table 2 Spectrum parameters of compound 1 in different solvents |
化合物1中的甲氧基二缩三乙二醇基柔性链部分, 减少苯基乙炔基蒽刚棒部分的π -π 堆积作用, 使化合物1在本体状态自组装成SmA相; 由于是非极性化合物, 在不同极性的溶剂中最大吸收波长和最大发射波长基本不变; 该化合物有很强的荧光发射性质, 并且发射光波集中在绿色光区域, 这对发光器件的单色性很有利。 本研究合成的荧光化合物继承了二取代蒽类发光材料具有高荧光量子产率的特点, 是一种性能良好的光致发光材料, 可以作为荧光薄膜传感器的支撑骨架。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|