为改善当前环境水体中的磷污染现状,利用溶胶-滴定-真空冷冻干燥法制备了壳聚糖-铁(CS-Fe)复合凝胶球去除水中磷酸根。 对CS-Fe凝胶球的形貌结构进行了表征,研究了材料对磷酸根的吸附影响因素,并探索了反应机理。 结果表明,CS-Fe对磷酸根的吸附为自发、吸热、熵增过程;吸附过程符合拟一级动力学方程,吸附平衡时间为50 min;根据Langmuir模型计算最大吸附量为23.97 mg/g,脱附效率大于90%。 傅里叶红外光谱(FT-IR)、扫描电子显微镜-能量散射谱(SEM-EDS)、Zeta电势分析、X射线光电子能谱(XPS)等证明,CS-Fe形成利于磷酸根快速吸附的蜂窝状结构;吸附机理包含静电吸附和离子交换过程。 该吸附剂将金属化合物的吸附性能与壳聚糖大分子利于构建多孔材料的特点相结合,改善了吸附效果,球状材料更利于回收,避免二次污染,具有良好应用前景。
In order to improve the present situation of phosphorus pollution in environmental water, the chitosan iron (CS-Fe) composite gel beads were prepared by sol-titration-vacuum freeze drying method to remove phosphate from water. The morphology and structure of CS-Fe gel beads were characterized, and the factors affecting the adsorption of phosphate and the reaction mechanism were explored. The results show that the adsorption of phosphate by CS-Fe is a spontaneous, endothermic and entropy-increasing process, the adsorption process is in accordance with the pseudo first-order kinetic equation, the adsorption equilibrium time is 50 min, the maximum adsorption capacity calculated by Langmuir model is 23.97 mg/g, and the desorption efficiency is more than 90%. Fourier transform infrared (FT-IR), scanning electron microscopy-energy dispersive spectroscopy (SEM-EDS), Zeta potential analysis and X-ray photoelectron spectroscopy show that CS-Fe forms a honeycomb structure which is favorable for the rapid adsorption of phosphate, and the adsorption mechanism includes electrostatic adsorption and ion exchange. The adsorbent combines the adsorption properties of metal compounds with the characteristics of chitosan macromolecule, which is conducive to the construction of porous materials and improvement of the adsorption effect. Gel beads materials are more conducive to recovery, avoid secondary pollution, and have potential applications.
磷是动植物生长必须的营养元素,也被广泛应用于工农业生产及家庭生活[1]。 然而,过量排放的磷酸盐造成了环境水体严重的富营养化[2],甚至给水生生态系统造成灾难性后果[3],加强水环境中磷酸盐的去除刻不容缓。 目前,去除水体中磷酸盐的修复方法主要包括好氧颗粒污泥法[4]、离子交换法[5]、电渗析、反渗透法[6]、化学沉淀法[7]、吸附法[8]和催化还原法等[9]。 其中,吸附法具有去除效率高、经济成本低和工艺简单等优点,成为研究热点之一。
壳聚糖是一种天然多胺糖吸附剂,分子骨架中含有的羟基(—OH)及胺基(—NH2)等活性官能团能够和金属离子形成配合物,成为优良的天然高分子吸附剂[10,11],并具有生物相容性、生物降解性、价格低廉等优点。 但天然壳聚糖分子无法有效去除水体中的磷酸盐[12],先前的研究证明当金属离子失去外层电子表现为路易斯酸,可以有效去除磷酸根,因此多价金属离子改性壳聚糖复合材料是一种具有创新型制备思路、可以有效提高磷酸盐吸附效果的吸附剂[13]。2011年,Dai等[14]首次提出将吸附金属铜的壳聚糖小球废物利用进一步去除磷酸根,吸附效果优于树脂、沸石等吸附剂。 目前,利用金属改性增加壳聚糖吸附剂中的有效吸附活性位点并高效去除水体中的磷酸根离子已经成为国内外关于磷酸根吸附研究的热点之一。 例如,Cu(II)结合壳聚糖/Fe3O4纳米复合物[15],Zr(IV)负载的交联壳聚糖珠[16],纳米Fe3O4/ZrO2/壳聚糖复合材料[17],本研究通过优化三氯化铁投加量制备壳聚糖-铁复合凝胶球并用于吸附去除水中磷酸根,重点研究壳聚糖-铁复合凝胶球去除磷酸根的吸附影响因素并探索反应机理,为壳聚糖-铁复合吸附剂去除水体磷酸盐提供科学依据。
壳聚糖(脱乙酰度≥95.0%,相对分子质量7.0×106~8.0×106,上海阿拉丁生化科技股份有限公司);六水合三氯化铁(FeCl3·6H2O,分析纯,广州化学试剂厂);氢氧化钠(NaOH,分析纯,天津市大茂化学试剂厂);磷酸二氢钾(KH2PO4,分析纯,广州化学试剂厂)。
EYELA FDU-2100型冷冻干燥机(日本理化器械株式会社);UV-2450型紫外可见分光光度计(日本岛津公司);5110 ICP-OES型电感耦合等离子体发射光谱仪(美国AGILENT公司);THERMO ESCALAB 250XI型X射线光电子能谱仪(XPS,美国赛默飞世尔科技有限公司);QUANTA 400 FEG型扫描电子显微镜(SEM,美国FEI公司);Nicolet iS50 FT-IR型傅里叶变换红外光谱仪(FT-IR, 美国尼高力仪器公司)。
壳聚糖-铁(CS-Fe)复合凝胶球的制备过程如图1所示。
CS-Fe复合水溶胶前躯体的制备 将一定量的FeCl3·6H2O溶于100 mL超纯水后,再加入2 g壳聚糖粉末并搅拌3 h,得到分散均匀的壳聚糖-铁水溶胶前躯体。
CS-Fe凝胶球的制备 将上述水溶胶前躯体转移至50 mL滴定管中,然后逐滴滴加到NaOH溶液(1 mol/L,400 mL)中并不断搅拌,得到粒径均匀的CS-Fe凝胶球。 滴定结束后继续搅拌1 h并将凝胶球洗涤至中性,然后将湿凝胶球放入冷冻干燥机中,在-80 ℃下冷冻干燥24 h,得到干燥的CS-Fe凝胶球(直径2.0 mm)。
纯壳聚糖凝胶球(CS)的制备 将2 g壳聚糖粉末加入到100 mL稀盐酸(体积分数1%)溶液并搅拌3 h,得到分散均匀的壳聚糖水溶胶前躯体。 再逐滴滴加到NaOH溶液(1 mol/L,400 mL)中并不断搅拌,得到粒径均匀的CS凝胶球。 上述CS凝胶球经-80 ℃下冷冻干燥24 h,得到干燥的CS凝胶球(直径2.0 mm)。
将25.0 mg的CS-Fe干凝胶球投加到KH2PO4溶液中(初始质量浓度 ρ0为50 mg/L,体积为25.0 mL,初始pH=6.0),并在旋转混合器转速为7.3 r/min、溶液温度为(25±1) ℃条件下反应24 h,取上清液稀释一定倍数,用钼酸铵分光度法测定吸附后溶液中磷(P)的浓度。 pH值影响磷酸根吸附实验中,初始溶液pH值为3.0~11.0;吸附等温线实验中,磷酸根初始浓度为15~95 mg/L;吸附动力学实验中,磷酸根初始浓度分别为20、50及80 mg/L,溶液体积为25 mL;吸附热力学实验中吸附温度分别为25、35和45 ℃;脱附实验中每25.0 mg干凝胶球用25 mL NaOH(0.5 mol/L)脱附。 此外,CS-Fe凝胶球的吸附量 qe,可由式(1)计算得出:
式中, ρ0(mg/L)和 ρe(mg/L)分别为磷酸根的初始浓度和平衡浓度; m(g)为CS-Fe干燥后的质量, qe(mg/g)为吸附剂的平衡吸附容量, V(L)为吸附质体积。
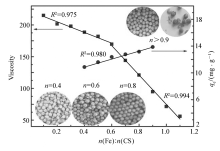
图2介绍了改变铁与壳聚糖初始物质的量比对溶胶粘度值和凝胶球对磷酸根吸附量的影响。 研究发现,当 n(Fe): n(CS)<0.6时,溶胶粘度随着铁与壳聚糖初始物质的量比增加而逐渐下降(粘度方程 y=-84.29 x+221.93; R2=0.975);当0.6< n(Fe): n(CS)<1.1时,溶胶粘度随着铁与壳聚糖初始物质的量比增加而迅速降低(粘度方程 y=-232 x+306.67; R2=0.994);当 n(Fe): n(CS)>1.2时,CS-Fe复合水溶胶有白色盐状物质出现,推测高含量铁降解了壳聚糖大分子并降低溶胶粘度。 其次,延长搅拌时间也会导致溶胶粘度持续降低,溶胶粘度过低不易成球,而溶胶粘度过高导致部分凝胶球生长形状不规则,当溶胶粘度为70~130 mPa·s时形成的凝胶球形状较为规整。 溶胶球冷冻干燥实验发现,当 n(Fe): n(CS)<0.9时,增加铁与壳聚糖初始摩尔比会导致凝胶球的颜色加深并形成表面光泽的凝胶球;当 n(Fe): n(CS)≥0.9时,凝胶球表面逐渐失去光泽甚至部分材料破裂(见图2插图)。 当0.4< n(Fe): n(CS)<0.9时,增加铁与壳聚糖初始物质的量比会显著增强CS-Fe凝胶球对磷酸根的吸附量。 因此,综合凝胶球机械性能和对磷酸根吸附效果,选择 n(Fe): n(CS)=0.8制备的CS-Fe凝胶球开展后续吸附实验。
图3A研究了溶液初始pH0对磷酸根吸附量的影响。 实验结果表明:CS-Fe凝胶球对磷酸根的吸附量随着pH0的升高逐渐降低,且吸附平衡后溶液pHe全部高于初始pH0,CS-Fe凝胶球对磷酸根的吸附量在pH0=3时最大,当pH0≥9时,吸附效果变差直至没有吸附。图3B显示了CS-Fe的Zeta电势,CS-Fe的等电点为3.61。 溶液初始pH0决定了磷酸根离子在溶液中的赋存形态分布,同时也会对材料表面的静电引力产生影响。 例如:当pH0=3时,CS-Fe凝胶球表面质子化程度高,与磷酸根的静电吸附作用较强,同时磷酸根以更容易与金属(氢)氧化物结合的H2PO4-形态存在[18],所以此时吸附效果最好;当4≤pH0≤8时,材料表面质子化作用减弱,逐渐呈现负电荷,但此时材料表面电荷处于不稳定状态,对周围大量存在的H2PO4-形态的磷酸根仍然存在吸附,吸附量在此范围内逐渐降低;当pH0≥9时,溶液中存在的OH-与磷酸根竞争吸附位点,同时CS-Fe表面携带稳定的负电荷,因此CS-Fe凝胶球逐渐失去吸附效果。 可见在吸附过程中,CS-Fe凝胶球表面静电引力起到重要作用。 酸性条件下材料质子化程度越高,越有利于对磷酸根的吸附。
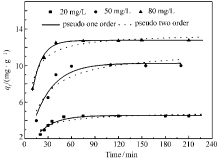
如图4所示,增加溶液初始浓度能够加快CS-Fe凝胶球对磷酸根吸附初始阶段的吸附速率,吸附速率在50 min后基本达到平衡。 根据Fick定律,增大初始溶液浓度会增加传质推动力,从而增加磷酸根与CS-Fe吸附位点间的碰撞机会并强化对磷酸根的吸附[19]。 其次,为了进一步阐明磷酸根与CS-Fe吸附机理,分别采用拟一级和拟二级吸附动力学模型对CS-Fe吸附磷酸根过程进行拟合[20],如式(2)和(3)所示。
式中, k1为拟一级速率常数(min-1); k2为拟二级速率常数(g/(mg·min)); qt为 t时间时的吸附容量(mg/g)。
由表1可知,拟一级动力学模型拟合的相关系数( R2)基本大于拟二级动力学模型。 因此,拟一级动力学模型能够更准确描述CS-Fe凝胶球对磷酸根吸附反应过程,表明该过程主要受物理吸附控制,吸附剂和吸附质之间通过分子间作用力产生吸附。
| 表1 CS-Fe凝胶球吸附磷酸根动力学参数 Table 1 Adsorption kinetics parameters of phosphate on CS-Fe gel beads |
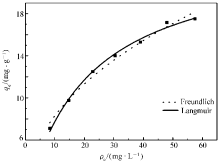
如图5所示,在0~60 mg/L的平衡浓度范围内,吸附量随着磷酸根初始浓度的增加而增大;平衡浓度为57.5 mg/L时,吸附量是17.5 mg/g。 分别利用Langmuir和Freundlich模型,
研究吸附剂和吸附质之间的相互作用[21]见式(4)和(5)。
式中, qe是平衡吸附量(mg/g); KL为Langmuir吸附平衡常数(L/mg); ρe是吸附平衡时H2PO4-质量浓度(mg/L); qm为吸附剂最大吸附量(mg/g); KF为Freundlich等温线常数(L/mg); n可以评价吸附亲和力, n越大亲和力越大。 用式(4)和(5)对实验数据进行非线性拟合得到 KL、 qm、 R2、 KF和 n,相关参数结果详见表2。
| 表2 CS-Fe凝胶球吸附磷酸根等温线参数 Table 2 Adsorption of isotherm parameters of phosphate on CS-Fe gel beads |
表2比较了磷酸根吸附方程拟合的主要参数。 结果表明,Langmuir吸附等温模型的相关系数( R2=0.994)高于Freundlich模型的相关系数( R2=0.983),Langmuir模型能更好地描述磷酸根吸附过程。 其次,CS-Fe凝胶球对磷酸根的吸附过程为单层吸附,利用Langmuir模型拟合得到CS-Fe凝胶球对磷酸根的最大吸附量为23.97 mg/g,优于大部分文献报道的吸附剂(详见表3)。
| 表3 不同吸附剂对磷酸根吸附容量的比较 Table 3 Comparison of adsorption capacity of different adsorbents for phosphate anions |
根据式(6)-(8),可以计算CS-Fe凝胶球吸附磷酸根的热力学参数。 如表4所示,在25~45 ℃温度范围内,磷酸根在CS-Fe凝胶球上的吸附量从9.75 mg/g增加到11.55 mg/g,升高反应温度会增强CS-Fe凝胶球对磷酸根的吸附量。 其次,在25~45 ℃温度范围内,吉布斯自由能变Δ G分别为-15.01、-15.78和-16.68 kJ/mol;CS-Fe凝胶球吸附过程的焓变Δ H为9.932 kJ/mol,熵变Δ S为83.61 J/(mol·K)。 Δ G<0表明,CS-Fe凝胶球对磷酸根的吸附在25~45 ℃范围内是自发过程;Δ H>0,表明磷酸根吸附过程是吸热的,Δ S>0,表明磷酸根吸附在CS-Fe凝胶球固液界面的混乱度是增强[29,30]。 因此,CS-Fe凝胶球对磷酸根的吸附是自发、熵增、吸热过程,温度升高有利于CS-Fe凝胶球对磷酸根吸附反应。
式中, Kc为不同温度下的吸附平衡常数(L/mol); qe为平衡吸附量(mg/g); ρe为吸附平衡时H2PO4-质量浓度(mg/L);Δ G为吉布斯自由能变(J/(mol·K));Δ H为焓变(kJ/mol);Δ S为熵变(kJ/mol); R为气体常数,8.314 J/(mol·K); T为绝对温度(K)。 Δ H和Δ S通过Δ G对 T作图的截距和斜率推出,计算结果见表4。
| 表4 CS-Fe凝胶球吸附磷酸根的热力学参数 Table 4 Thermodynamic parameters of phosphate anions adsorption on CS-Fe gel beads |
2.5.1 傅里叶红外光谱(FT-IR)
如图6所示,3432 cm-1属于CS上N—H和O—H的叠加伸缩运动,1611和1326 cm-1分别属于N—H变形振动和酰胺Ⅲ谱带,1095和1032 cm-1分别属于C3—OH、C6—OH的伸缩振动[31,32]。 负载Fe(III)的壳聚糖凝胶球(CS-Fe)在C6—OH处谱带变弱消失且C3—OH伸缩振动峰从1095 cm-1偏移到1082 cm-1,其次,N—H变形振动从1611 cm-1向低波长移动到1594 cm-1且发生分峰,酰胺Ⅲ处谱带变弱直至消失。 这是因为Fe(III)负载进CS后,Fe(III)会与CS骨架上的—OH、—NH3结合形成金属配合物,从而导致了—OH、—NH3的光谱变化。凝胶球吸附磷酸根后(CS-Fe-P)的傅里叶红外光谱也有类似改变。 除—OH和—NH3谱带发生位移外,CS-Fe-P和CS-Fe在750 cm-1以下谱带也发生了较大变化,推测与金属-氧键(Fe—O)有关[33]。 此外,由于CS中N—H和O—H与Fe(III)的作用,导致N—H和O—H叠加伸缩运动在CS—Fe和CS—Fe—P中分别移动到了3350和3292 cm-1。
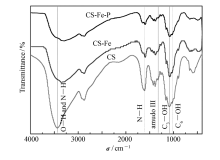 | 图6 CS和CS-Fe凝胶球吸附磷酸根前后红外光谱图Fig.6 FT-IR spectra of CS and CS-Fe gel beads before and after adsorption of phosphate anions |
2.5.2 X射线光电子能谱(XPS)
图7A描述了CS、CS-Fe和CS-Fe-P凝胶球的XPS全谱图数据。 由图7A可知,吸附后的CS-Fe-P凝胶球在132.77 eV出现了P的特征峰。 这表明,CS-Fe凝胶球有效吸附磷酸根。 其次,吸附磷酸根后的Fe2 p3/2和Fe2 p1/2峰的结合能分别向高波长移动0.32和0.25 eV(图7B),推测是铁和磷酸根之间的静电作用导致[18]。图7C介绍了O1 s窄谱峰谱图。 其中,529.50、531.16和532.53 eV可分别归于氧键合到金属(M—O)、羟基键合到金属(M—OH)和键合水(H2O)[18,34]。 由于—OH和Fe3+发生配位导致CS-Fe和CS-Fe-P凝胶球比纯CS凝胶球出现了M—O和M—OH两个新峰;吸附磷酸根后,M—OH峰的面积比从17.89%降低到14.09%,且特征峰向低波长移动0.16 eV,而M—O的峰面积比从12.5%升高到15.68%且特征峰向高波长移动0.2 5 eV。
这表明,CS-Fe吸附剂中铁元素参与了磷酸盐的吸附过程。图7D介绍了N1 s窄谱峰。 其中,399.0、400.28和401.38 eV分别属于—NH2、—NH—和—NH3-[18,35]。 实验结果发现,由于—NH2和Fe3+发生配位导致了CS-Fe和CS-Fe-P凝胶球的N特征峰向低波长移动,且—NH2和—NH3+在吸附后的材料中分别降低了6.5%和1.33%。 溶液质子化过程导致—NH2组分降低生成—NH3-组分并参与对磷酸根的静电吸附过程。
2.5.3 扫描电子显微镜-能量散射谱(SEM-EDS)
图8表征了CS、CS-Fe和CS-Fe-P的SEM图。 研究发现,纯壳聚糖凝胶球表面结构较为紧密,而CS-Fe凝胶球在相同放大倍数下内部呈现了规则的蜂窝状结构(孔径为3.5~6.1 μm)。 这是因为冷冻干燥过程将湿凝胶球残留的水升华,从而保持蜂窝状结构原形,凝胶球孔道结构有利于吸附过程的传质反应[36]。 其次,图8D-8F证明,CS-Fe凝胶球材料成功将磷酸根吸附负载到CS-Fe孔道中。
 | 图8 CS(A,D)、CS-Fe(B,E)和CS-Fe-P(C,F)凝胶球扫描电子显微镜图(A-C)和EDS数据(D-F)Fig.8 Scanning electron microscopy images(A-C) and EDS data(D-F) for CS(A,D), CS-Fe(B,E) and CS-Fe-P(C,F) |
2.5.4 循环再利用性能
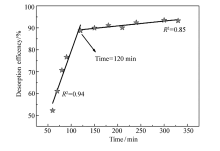
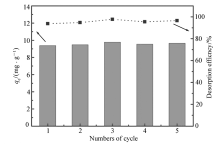
图9研究了利用NaOH溶液对吸附磷酸根后的CS-Fe凝胶球进行脱附。 研究发现,脱附率随着脱附时间延长而显著增加,120 min后脱附率达到90%且脱附过程逐渐变慢,最大脱附率可达到93%(脱附方程 y=0.595 x+19.91和 y=0.022 x+86.46)。 其次,5次循环利用后吸附量均未发生明显下降,脱附率也稳定维持在93%左右(详见图10),吸附后材料增重144%,5次脱附循环利用后材料损失1.3%。 这表明,CS-Fe凝胶球材料结构稳定,具有良好的循环再利用性能。
2.5.5 吸附机理
利用FeCl3溶液溶解壳聚糖过中,Fe3+与壳聚糖骨架上的—NH2和—OH结合形成配合物(图11)。 在酸性溶液中,材料表面质子化后与磷酸根通过静电作用发生吸附作用;在强碱性介质中,磷酸根离子与—NH3+基团间的静电相互作用减弱,而OH-和磷酸根竞争活性位点。 所以,CS-Fe在低pH下吸附效果较好,而碱性溶液有利于实现磷酸根的脱附。 其次,吸附和脱附反应迅速达到平衡且循环再利用性能良好,这也表明物理吸附是吸附质和吸附剂之间的主要作用方式。 此外,Fe—OH键也可以通过离子交换反应吸附磷酸根并释放OH-。 XPS中O1 s窄谱分峰发现,CS-Fe凝胶球吸附磷酸根后M—OH比例变小而M—O比例变大。这表明,磷酸根能够通过离子交换过程取代—OH与Fe(Ⅲ)结合,导致吸附后溶液pH升高。
采用溶胶-滴定成球-冷冻干燥法制备了毫米粒径壳聚糖-铁(CS-Fe)复合凝胶球并用于对磷酸根的吸附实验。吸附过程中,磷酸根在50 min达到吸附平衡;吸附反应为自发、吸热、熵增过程;利用NaOH溶液(0.5 mol/L)对吸附磷酸根后的CS-Fe开展脱附研究,脱附平衡时间约为120 min,脱附效率大于90%,CS-Fe复合凝胶球具有良好的循环再利用性能。CS-Fe对磷酸根的吸附过程主要为单层物理吸附,等温吸附过程符合Langmuir模型,CS-Fe对磷酸根的最大吸附量为23.97 mg/g。 SEM-EDS谱图表明,CS-Fe复合凝胶球材料呈现蜂窝状结构并促进了磷酸根的快速吸附;CS-Fe凝胶球对磷酸根的吸附过程以静电吸附为主、离子交换为辅。
目前为止许多金属以及金属矿物类吸附剂已用于去除水体中磷酸根的研究,然而粉末以及颗粒形式的吸附剂在循环利用过程中易流失、不易回收、造成二次污染,亦或转化为其他吸附性能差的晶体给吸附带来困难。 本次研究将壳聚糖作为金属载体,利用真空冷冻干燥法构建纳米孔限域吸附位点,提高了金属型吸附剂的最大饱和吸附容量。 毫米粒径壳聚糖-铁(CS-Fe)复合凝胶球的制备,不仅解决了粉末状金属型吸附剂以往的缺点,该材料还具有良好的循环利用性能,为金属修饰类除磷吸附剂的探索提供科学依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|