癌症的光子疗法是一种选择性治疗新技术,近几年得到迅猛的发展,该疗法拥有创伤小、选择性好且毒性低、无耐药性等优点。 我们采用水热合成法制备了一种新型的层状钴铁双氢氧化物纳米片(Co-Fe-LDH),利用其具有较大比表面积、稳定高、生物相容性好等的特点,负载光敏剂IR783(LDH-IR783),在近红外激光的刺激下实现癌症的光热光动力协同光治疗。 对所合成的Co-Fe-LDH进行了组成、形貌、光学性质、活性氧(ROS)生成、热量释放等表征,并在细胞及活体水平进行抗癌测试。 实验结果表明,所制备的纳米复合物具有稳定的结构、高IR783负载率以及良好的分散性,并且,在近红外光源照射下表现出优异的光热/光动力效应,能够快速产生大量的活性氧,迅速地释放热量,产生显著的光毒性,能够有效地诱导HeLa细胞的凋亡。 体内抗癌实验表明,所制备的纳米复合物有效地抑制了实体肿瘤的生长,并且未对正常组织产生明显的损伤,毒副作用较低。 这些初步结果将为光热/光动力协同纳米粒子的设计和应用提供新的思路。
Photon therapy is a new selective cancer treatment technology which has been developed rapidly in recent years. It has the advantages of small trauma, good selectivity, low toxicity and no drug resistance. In this paper, we used hydrothermal synthesis method to prepare a new kind of layered Co-Fe double hydroxide nanosheet (Co-Fe-LDH) which has the characteristics of large specific surface area, high stability and good biocompatibility and is used to load photosensitizer IR783 (LDH-IR783) to realize the photothermal/photodynamic cooperative phototherapy of cancer under the stimulation of near-infrared laser. We characterized the composition, morphology, optical property, reactive oxygen species (ROS) generation and heat release of LDH-IR783 and tested its anticancer activity at the cellular and in vivo levels. The results indicate that the nanocomposite has a stable structure, high IR783 loading efficiency and good dispersibility, exhibits excellent photothermal/photodynamic effects under near-infrared light irradiation through producing considerable ROS and releasing heat rapidly to induce severe phototoxicity to cancer cells. Both in vitro and in vivo experiments display that the nanocomposite can effectively induce apoptosis of HeLa cells and significantly inhibit the growth of solid tumors without obvious side effects and damage to normal tissue. The preliminary results will provide new ideas for the design and application of photo-thermal/photodynamic synergistic drugs.
尽管当今对癌症的研究取得了重大进展,但是癌症的诊断与治疗仍然面临重大的挑战[1,2,3]。 光治疗作为一种有前途的治疗方法,近年来得到广泛的研究。 这种通过光引发的细胞毒性对癌细胞进行有效选择性杀伤的治疗方式[4,5]与传统的肿瘤治疗(手术切除、化疗及放射治疗)相比具有创伤性小、简单精准、术后可控等优点[6,7,8]。 光治疗主要分为光热治疗(photothermal therapy,PTT)与光动力治疗(photodynamic therapy,PDT)。 光热治疗是指利用光敏剂将光能转化为热能,诱导肿瘤组织局部高温杀死癌细胞;光动力治疗指在光刺激下,诱导肿瘤内产生有毒性的活性氧(ROS)来诱导癌细胞的凋亡与坏死[6,9,10,11]。 然而单独的光热治疗或者光动力治疗存在光热转换效率低及活性氧产量不足等问题,因此光热/光动力联合治疗产生的协同效应能够克服单一疗法的不足,具有更高的应用潜力[12,13,14,15,16]。
层状双氢氧化物(layered double hydroxides,LDHs)是一种由二价或三价的金属阳离子与羟基共价结合,以八面体形式伸展带正电荷的二维无机片层纳米材料,层间阴离子用于平衡主片层上的电荷[17,18,19,20,21]。 LDHs可以方便地掺杂各种金属离子,制备集多功能于一体的纳米材料[22,23]。 主片层间高的电荷密度及阴离子交换能力使其成为生物大分子、阴离子抗癌药物及其它生物相容性好的染料的高效运输工具。 本文设计并合成了一种新型的层状钴铁双氢氧化物纳米片(Co-Fe-LDHs)作为纳米载体,负载一种七甲基菁染料IR783,进行近红外光刺激诱导光热/光动力联合治疗。 实验结果表明LDH-IR783纳米复合物在体外具有高效的光热转换能力并且能够产生大量的活性氧;能够有效地诱导HeLa细胞的凋亡,光刺激后对HeLa细胞的抑制率达到了70%。 在体内治疗中,明显地抑制了实体肿瘤的生长并且未产生任何组织器官毒性,具有良好的生物相容性。 因此,本工作开辟了利用LDHs基纳米材料作为生物医学应用的多功能纳米平台介导光热/光动力联合治疗癌症的新途径。
六水合硝酸钴(分析纯)与九水合硝酸铁(分析纯)购自广东西陇化工股份有限公司;IR783(98%)购自北京百灵威科技有限公司;1,3-二异苯基苯并呋喃(DPBF,97%)、荧光素二乙酸酯(FDA,97%)和碘化吡啶(PI,95%)购自美国Sigma公司;2',7'-二氯-二氢-荧光素二乙酸酯(H2DCFH,97%)和刃天青(90%)购自碧云天生物有限公司;DMEM高糖培养基和胎牛血清(FBS)购自美国HyClone公司;青霉素和链霉素购自中国上海华北制药有限公司。 聚乙烯吡咯烷酮(PVP,99%)购自国药集团化学试剂有限公司;碳酸钠(分析纯)购自天津科密欧化学试剂有限公司;无水乙醇(分析纯)购自北京化工厂;磷酸盐缓冲液(PBS)粉剂购自北京鼎国生物技术有限公司;雌性昆明种鼠购自吉林大学动物实验中心。
H-600型透射电子显微镜(TEM,日本Hitachi公司);EM-30AX Plus型扫描电子显微镜(SEM,韩国COXEM公司);EDX-720型能量色散X射线光谱仪(EDX,德国SPECS公司);SYNERGY-H1型酶标仪(美国Biotek公司);LAMBDA 35型紫外分光光度计(UV-Vis,美国Perkin-Elmer公司);ZS90型动态光散射仪(DLS,英国Malvern公司);MDL-Ⅲ-808型激光灯(长春新产业光电技术有限公司);E-100型数字电子显微镜(日本Nikon公司);LSM880型激光扫描共聚焦显微镜。
采用水热共沉淀的方法来合成LDH纳米片。 将0.6 mol/L Co(NO3)2·6H2O与0.3 mol/L Fe(NO3)3·9H2O溶解在去离子水中。 同样地取0.96 mol/L NaOH与0.4 mol/L Na2CO3加入到去离子水中快速搅拌使其充分溶解,取等体积的两种液体加入到烧杯中高速搅拌30 min后取60 mL的混合溶液转移到100 mL聚四氟乙烯内衬的不锈钢高压反应釜里并置于鼓风干燥箱中80 ℃下加热24 h。 自然冷却至室温离心收集产物,用去离子水和无水乙醇洗涤3次后置于60 ℃真空干燥箱中干燥得到产物。
取100 mg Co-Fe-LDH加入到50 mL的PVP水溶液中,搅拌5 min使其充分溶解。 然后在冰浴条件下超声处理30 min,用去离子水和无水乙醇在离心条件下反复清洗收集产物并再分散于去离子水中。 取200 μL浓度为10 mg/mL的IR783溶液加入到5 mL再分散的LDH悬液中,在避光的条件下搅拌24 h后离心收集得到LDH-IR783纳米复合物。
在石英比色皿中加入1 mL的LDH-IR783分散液,在避光的条件下进行近红外光(2 W/cm2,808 nm)辐照处理,每隔10 s用温度计测量一次溶液的温度,监测时间为5 min。
对于细胞外体外1O2的检测,使用了一种商业化的荧光探针DPBF,通过紫外-可见光谱法检测410 nm处的吸收强度。首先将DPBF (20×10-3 mol/L)加入到PBS-乙醇的混合溶液中,然后加入50 μL LDH-IR783,在避光条件下进行近红外(2 W/cm2,808 nm)辐照处理,用紫外分光光度仪每1 min记录一次410 nm处DPBF的吸光度。
采用HeLa细胞进行体外实验。 细胞置于体积分数5%CO2恒温培养箱中在37 ℃的温度下培养,采用体积分数为10%胎牛血清和体积分数为1%抗生素(青霉素-链霉素,10000 U/mL)的DMEM培养基培养。 当细胞的覆盖率达到85%~95%时,用0.25%的胰蛋白酶将HeLa细胞消化,然后传代培养。
用刃天青法(AlamarBlue)检测细胞毒性。 将传代后的HeLa细胞(每孔1×104个细胞)在5%CO2恒温培养箱37 ℃的温度条件下培养24 h后,向孔板中加入不同浓度的LDH-IR783继续培养12 h。 去除旧的培养基用PBS清洗3次,然后加入含刃天青溶液(0.5 mg/mL)的新鲜培养基培育2 h。 用分光光度计酶标仪检测每个孔的荧光强度值(FLU),激发波长为530 nm,发射波为590 nm。 细胞存活率采用式(1)计算:
式中, AOD,test为实验组的荧光强度, AOD,control为空白组的荧光强度。
采用活性荧光氧探针H2DCFH,检测细胞内活性氧的含量。 将传代后的HeLa细胞在体积分数5%CO2恒温培养箱37 ℃的温度条件下培养24 h后,向孔板中分别加入LDH与LDH-IR783,控制组不加任何药物,共孵育8 h后加入H2DCFH(0.1×10-6 mol/L,20 μL)继续培养15 min后所有组进行近红外激光(2 W/cm2,808 nm)刺激5 min。 每个孔用PBS清洗3次,用激光共聚焦显微镜(CLSM)观察,采集以488 nm为激发波长510~560 nm为发射波长区域内的荧光图像。
HeLa细胞(每孔5×103个细胞)接种96孔板,在体积分数5%CO2恒温培养箱37 ℃的温度条件下培养24 h。 分别用不同浓度的LDH和LDH-IR783处理细胞,控制组不加任何药物。 将孔板暴露于近红外激光(2 W/cm2,808 nm)下5 min,用刃天青(Alamar Blue)法测试HeLa细胞的细胞活性,用活/死细胞共染色(FDA/PI)法进行染色,并且在CLSM上观察细胞状态。
体内研究按照吉林大学实验动物中心和吉林大学中日联合医院提供的方案进行。 选用雌性昆明种小鼠(6周龄,体重20~25 g)建立异种移植宫颈癌细胞(U14)模型。 当肿瘤体积生长到100 mm3时,将小鼠随机分为2组(生理盐水组和LDH-IR783组),小鼠通过尾部静脉注射药物,每隔1天注射1次,控制组注射生理盐水。 静脉注射12 h后,将小鼠麻醉使肿瘤部位暴露在近红外激光(2 W/cm2,808 nm)下经行辐照处理5 min,整个治疗周期为15 d。 整个治疗周期结束后,将所有组别的小鼠全部处死,解剖并取出心、肝、脾、肺、肾器官和肿瘤组织固定在体积分数4%中性缓冲福尔马林中,制成常规的石蜡切片冷冻保存。 将组织器官切成10 μm厚的切片进行苏木精-伊红(H&E)组织染色,观察分析器官组织的染色结果。
采用水热合成的方法在较温和的条件下制备了Co-Fe-LDH纳米片。 由图1A-1C可以看到,SEM、TEM、高分辨TEM(HRTEM)图像显示出所制备的LDH-IR783具有典型的六边形片层结构。 LDH和LDH-IR783的DLS测试结果(图2A)可以看出,LDH与LDH-IR783纳米片的直径相似,大约为135 nm,多分散性指数(PDI)分别为0.091和0.098,表明合成的纳米复合物尺寸稳定且具有良好的分散性。 值得一提的是SEM元素映射图像(图1D)清楚地显示了C、O、Fe、Co和S元素的分布,表明了Co-Fe-LDH纳米片的成功合成以及IR783分子的负载。 IR783通过 π-π堆积和静电结合在高比表面积的LDH上,Zeta电势由17.7 mV变为-21.2 mV(图2B)。 通过XPS定性分析了纳米复合物的组成,如图2D所示,在711.9和780.6结合能处存在符合Fe2 p3和Co2 p3的特征能级峰。 用UV-Vis表征了游离的IR783、 LDH和LDH-IR783的特征峰,在形成LDH-IR783纳米复合物后IR783的特征峰仍然存在,证明了IR783分子在LDH上的成功负载。 LDH-IR783纳米复合物在600~900 nm宽的吸收带有利于体内诱导高效的光热效应。
 | 图1 LDH-IR783的扫描电子显微镜(A)、透射电子显微镜(B)、高分辨透射电子显微镜(C)和扫描电子显微镜元素映射图像(D)Fig.1 SEM(A), TEM(B), HRTEM(C) and SEM elemental mapping(D) images of LDH-IR783 |
为了证明LDH-IR783纳米复合物诱导的PTT效应,用近红外激光(2 W/cm2,808 nm)辐照来验证在体外的光热效应。 由图3A可以看出在一定的范围内,IR783的质量浓度与吸光度呈线性关系。 利用电子温度计对实时的温度进行了检测。 如图3B所示,在5 min光刺激后PBS组与单独的LDH组表现出低的温度上升量,分别为1.7 ℃与4.8 ℃,与之形成对比的是,LDH-IR783组在5 min内的温度上升值高达25.4℃,最高温达到48.8 ℃,高于光热治疗所需要的42 ℃,表明LDH-IR783纳米复合物在近红外光的辐照下有效地将光能转化为热能,诱导了局部的高温,在短时间内具有较高的光热效应。 此外还研究了不同浓度的LDH-IR783的光热效应,如图3C所示,当浓度从20 μg/mL提高到50 μg/mL时,最高温度由30.8 ℃提高到50.9 ℃,温度的上升值具有浓度依赖性。
为验证LDH-IR783介导的光动力(PDT)效应,使用DPBF作为单线态氧探针,通过在410 nm处DBPF吸收峰的逐渐减少来反映1O2的生成量。 由图3D和3E可以看出,在近红外光(2 W/cm2,808 nm)刺激6 min期间,LDH-IR783组DPBF在410 nm的紫外吸收峰随时间推移明显降低,表明大量1O2的生成。 相反LDH纳米片本身并未表现出DPBF吸收峰的明显下降,说明在光刺激下LDH自身不会产生1O2。
用刃天青法对体外光治疗效果经行了评估。 首先检测了LDH-IR783纳米复合物的细胞毒性,如图4A所示,随着LDH-IR783浓度的升高,纳米复合物未产生明显的细胞毒性,即使浓度达到50 μg/mL,细胞存活率依然维持在90%左右,说明LDH-IR783纳米复合物具有良好的生物相容性。
鉴于LDH-IR783纳米复合物在体外大量的1O2生成量,进一步研究了LDH-IR783在HeLa细胞内的1O2生成效率。 选用了一种细胞内的活性氧荧光探针DCFH-DA,在进入细胞内DCFH-DA去酯化进而被活性氧氧化为高荧光物质DCF,通过荧光信号的强度来证明细胞内1O2的生成量。 如图4B所示,在激光照射条件下LDH-IR783组表现出强的荧光信号,说明IR783分子被激活在细胞内产生大量的1O2。 相比之下控制组与LDH组处理的HeLa细胞几乎不产生任何荧光信号,结果与检测细胞外光动力效应实验结果一致。
随后进行了光毒性的测试,由图4C可以看出控制组、单独光照组与单独LDH-IR783组几乎不产生光毒性。 当用近红外光(2 W/cm2,808 nm)辐照LDH-IR783共孵育的HeLa细胞时,表现出了具有浓度依赖性的光毒性。 当LDH-IR783的浓度为10 μg/mL时,细胞的死亡率为20%;当浓度提高到50 μg/mL时,细胞的死亡率达到70%。 FDA/PI活/死细胞染色也证明了这一结果。 如图4D所示,控制组与单独的LDH组视野里HeLa细胞基本为存活状态(绿色荧光),而LDH-IR783孵育的HeLa细胞出现了明显的细胞死亡(红色荧光)。 这也说明在近红外刺激下,LDH-IR783纳米复合物能够触发光热/光动力联合治疗,在体外有效地诱导癌细胞的死亡。
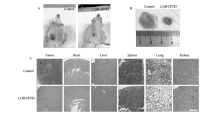
考虑到LDH-IR783纳米复合物在体外光治疗取得了显著的成效,接下来进行了活体实验。 建立的异种移植肿瘤模型选用的是后肢皮下注射小鼠宫颈细胞系U14的雌性昆明鼠。 当肿瘤体积达到100 mm3时,将小鼠随机分为控制组与LDH-IR783组。 实验组小鼠通过尾部静脉注射LDH-IR783(200 μL,50 μg/mL),每隔1天注射1次,静脉注射12 h后将小鼠麻醉用近红外激光(2 W/cm2,808 nm)照射肿瘤区域5 min,控制组小鼠不做任何处理,整个治疗周期为15 d。 由于PTT/PDT的协同作用,LDH-IR783治疗组在15 d后显示出明显的抑瘤效果,如图5A和5B所示,控制组肿瘤体积约为1800 mm3质量约1.684 g,而治疗组肿瘤仅为体积270 mm3,质量为0.381 g。
这个结果与体外光毒性实验结果一致,进一步证明了近红外刺激触发光热/光动力协同效应在短时间内取得显著的效果。 值得注意的是,在整个治疗过程中无论实验组还是治疗组的小鼠体重均未发生明显的下降,说明所设计的纳米复合物在体内无明显的生物毒性。
进一步用组织学检查评估了LDH-IR83介导的光热/光动力联合治疗的效果。 从苏木精-伊红(H&E)染色图像(图5C)可以看出,LDH-IR783组癌细胞的凋亡,细胞核的萎缩更为为明显,说明联合治疗对肿瘤组织有明显的损伤作用,而控制组肿瘤组织基本不表现出任何损伤。 此外还进行了器官的H&E染色,没有显示出任何潜在的损伤、炎症或任何器官组织的坏死,从而证实了所设计的纳米粒子良好的生物相容性,不会对组织器官产生急性的损伤及毒副作用。 实验结果表明,LDH-IR783纳米复合物增强了体内的治疗效果,无明显的全身组织毒性,是一种合适的通过近红外刺激触发光热/光动力联合治疗的纳米药物。
成功地构建了一种二维片层载体LDH负载光敏剂IR783的纳米平台LDH-IR783,并且证实了纳米复合物具有良好的分散性与稳定性,在近红外激光刺激下能够触发光热/光动力联合治疗。 在体外能够在短时间内产生局部的温度升高并且活化IR783分子释放大量的1O2。 这种光触发的光热/光动力联合治疗有效地诱导了HeLa细胞的凋亡以及抑制体内肿瘤的生长。 并且纳米复合物在体内几乎无任何的毒性,对组织器官不会产生急性损伤。 LDH基纳米复合物用于癌症协同光治疗的策略为抗癌纳米医学材料的设计开辟新的道路,为临床治疗提供了更安全的途径,具有很大的临床应用前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|