在生理条件下,利用紫外-可见光谱和荧光光谱分别研究氨基硫脲芳基铱抗癌物与牛血清蛋白的相互作用。 确定作用机制,讨论结合力类型,并研究共存离子对结合常数的影响。 实验结果表明,间甲氧基苯甲醛4-苯基-3-氨基硫脲芳基铱(TSC-Ir-6)配合物对牛血清白蛋白(BSA)的内源性荧光有猝灭作用,其猝灭类型为静态猝灭;通过计算二者相互作用时的热力学参数,其结果表明TSC-Ir-6与BSA的结合是一个自发过程(Δ G<0),且体系Δ H<0,Δ S<0,其相互作用力类型为氢键和范德华力,结合位点约为1。 共存离子的存在使TSC-Ir-6与BSA之间的结合常数明显增大,结合力更强,提高了其在血浆中的滞留时间,可能得到更好的治疗效果。
In this paper, the interaction between thiourea aryl iridium and bovine serum albumin (BSA) was studied by ultraviolet-visible spectroscopy (UV-Vis) and fluorescence spectroscopy under physiological conditions. The mechanism of action was determined, the type of binding force was discussed, and the activation energy of the reaction of thiourea aryl iridium anticancer compound with bovine serum albumin was calculated. The experimental results show that m-methoxybenzaldehyde 4-phenyl-3-thiourea aryl iridium (TSC-Ir-6) complex has a quenching effect on endogenous fluorescence of bovine serum albumin, and the quenching type is static quenching. Through the fixed Stern-Volmer equations and apparent binding constant, the thermodynamic parameters calculated by the formula, it is concluded that the combination of TSC-Ir-6 and BSA is a spontaneous process (Δ G<0), and the interaction forces are hydrogen bonding and van der Waals force. The number of binding sites is about one. With the presence of coexisting ions, the binding constant between TSC-Ir-6 and BSA is significantly increased, the binding force is stronger, and the retention time of TSC-Ir-6 in plasma is improved, which may lead to a better therapeutic effect.
在抗肿瘤药物中,芳基钌(Ⅱ)、铑(Ⅲ)及铱(Ⅲ)配合物是当前的研究热点,它们不但有着良好的抗肿瘤活性而且在毒副作用以及耐药性等方面也有着优异的表现[1]。 本文所用的氨基硫脲芳基铱配合物(间甲氧基苯甲醛4-苯基-3-氨基硫脲芳基铱配合物:TSC-Ir-6,如Scheme 1所示),是由苏炜教授课题组研制出来具有抗癌活性的一类物质[2],其与癌症相关生物大分子的相互作用机制尚不明确,亟待开展从作用模式、结合点位、空间构型等多角度进行全面而深入的研究[3]。 蛋白质作为生物大分子,在生物的生命活动中起着极其重要的作用。任何药物进入生物体均需要蛋白质的运输,因此研究氨基硫脲芳基铱抗癌物与牛血清白蛋白(BSA)的相互作用机制具有现实意义。
血清白蛋白是血浆中含量最丰富的蛋白质,能结合多种内外源物质,是药物发挥药效的重要载体和靶分子。 药物进入血液后会不同程度地结合血清白蛋白,这直接影响药物在体内的吸收、代谢、药效发挥、药理和毒理等[4]。
目前,直接测定药物在体内与蛋白质的结合情况是比较困难的。 因此,药物与蛋白质结合的测定往往均在体外模拟体内生理环境下进行。 BSA现已成为研究药物与蛋白质相互作用最为常用的模式蛋白之一[5]。
光谱法由于分析速度快、灵敏度高、选择性强及操作简便等优点是小分子物质与蛋白质相互作用研究的主要方法。 其中,荧光光谱法提供的荧光参数测定可以得到结合常数、结合位点数、结合位置、作用力类型以及蛋白质分子在相互作用中结构的变化等许多关于蛋白质与小分子作用的信息,从而阐明蛋白质结构与功能的关系[6]。 而紫外-可见光谱法(UV-Vis)则根据光谱的前后变化获取蛋白质的结构信息[7]。 通过不同的分析方法,可以获得更多的有效信息,对新型抗癌物的研发和筛选提供有价值的参考意见。
RF-5301pc型荧光分光光度计(FL,日本岛津公司);SDC-6型节能型智能恒温槽(宁波新芝生物科技股份有限公司);TU-1901型紫外分光光度计(UV-Vis,北京普析通用仪器有限责任公司);Millipore-Q型超纯水净化仪(美国 Millipore 公司)。
TSC-Ir-6根据文献[2]报道合成,纯度100%;BSA购自Sigma 公司,纯度>99%;磷酸盐缓冲液(PBS,pH=7.4)购自上海华壹生物科技有限公司,分析纯试剂;氯化钾、氯化钠、氯化钙、氯化镁,氯化锌、氯化铝、氯化铁、氯化铬和无水乙醇购自广东西陇化工股份有限公司,均为分析纯试剂。
抗癌物Ir-TSC-6用分析纯无水乙醇溶解其晶体,其浓度为1×10-3 mol/L;BSA用PBS(0.1 mol/L,pH=7.4)缓冲溶液溶解。
稳态荧光光谱法 记录298、304和310 K时的荧光光谱;激发与发射狭缝分别为3.0和5.0 nm;激发波长为280 nm,扫描范围280~480 nm;时间2 s;BSA浓度为2×10-6 mol/L;抗癌物TSC-Ir-6浓度为1×10-3 mol/L。
紫外-可见吸收光谱法 抗癌物TSC-Ir-6与BSA(2×10-6 mol/L)物质的量比为1:1;参比池放空白缓冲溶液,样品池放实验样品。
蛋白质的内源荧光主要来自于色氨酸(Trp)和络氨酸(Tyr)残基,蛋白质与药物发生作用时,可根据两残基对微环境的变化敏感而使荧光强度发生变化[8]。 因此常作为内源荧光探针来研究溶液状态下蛋白质的构象变化信息。 荧光猝灭主要包含由碰撞引起的动态猝灭和与Trp残形成基态配合物的静态猝灭[9,10]。
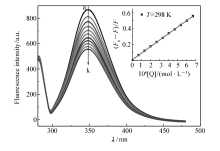
298 K下测定TSC-Ir-6配合物与BSA相互作用,结果如图1所示。 280 nm激发下BSA的发射波长为350 nm,BSA在350 nm附近显示出强烈的荧光发射峰。 固定BSA的量,随着抗癌物TSC-Ir-6浓度的增加,BSA的荧光强度不断下降,其结果表明,抗癌物TSC-Ir-6可以猝灭BSA的内源荧光,二者存在浓度线性关系,然而,在整个过程中发射峰位置和荧光光谱的形状几乎无变化,可见TSC-Ir-6与BSA发生了相互作用,且未明显改变BSA的色氨酸残基微环境极性。
荧光猝灭机制分为静态猝灭和动态猝灭,可以通过不同温度下的荧光实验加以区分。 静态猝灭的猝灭常数随温度的升高而降低,动态猝灭则相反。 因此,分别绘制了温度为298、304和310 K时不同物质浓度与荧光强度关系图。 抗癌物TSC-Ir-6与BSA的荧光猝灭,一般都采用Stern-Volmer方程来描述,如式(1)所示:
式中, F0表示不存在猝灭剂时荧光物质的荧光度(a.u.); F表示随着猝灭剂的加入,荧光物质的荧光度(a.u.);[Q]为猝灭剂的浓度(在实验中指的是TSC-Ir-6的浓度,mol/L); KSV 为静态猝灭常数(L/mol)。
图2为不同温度下的Stern-Volmer关系图,TSC-Ir-6与BSA的Stern-Volmer方程拟合结果具有良好的线性关系,不同温度下的Stern-Volmer猝灭常数 KSV列于表1中。 随着温度的升高,Stern-Volmer猝灭曲线的斜率逐渐降低,表1中 KSV值随温度上升而减小。 这表明BSA-TSC-Ir-6体系的荧光猝灭机制是静态猝灭。
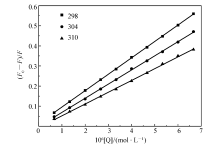 | 图2 抗癌物TSC-Ir-6与BSA荧光猝灭Stern-Volmer关系图Fig.2 Relationship between TSC-Ir-6 and BSA fluorescence quenching stern-volmer |
| 表1 抗癌物TSC-Ir-6与BSA的 KSV和 Kq值 Table 1 KSV and Kq values of anticancer agent TSC-Ir-6 and BSA |
众所周知,动态猝灭只影响荧光基团的发射光谱而对其吸收光谱几乎无影响[4],因此可以通过UV-Vis来进一步鉴定荧光猝灭机制。 由图3可知,在实验误差范围内,图3曲线a和d在近紫外波段(200~350 nm)已发生明显改变。 说明 BSA 与抗癌物Ir-TSC-6之间形成了复杂配合物,其相互作用主要是静态猝灭机制。
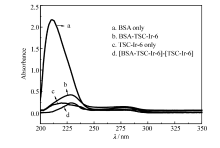 | 图3 抗癌物TSC-Ir-6与BSA紫外-可见吸收光谱图Fig.3 UV-visible absorption spectra of anti-cancer compound TSC-Ir-6 and BSA |
对于静态猝灭而言,可以根据修正的 Stern-Volmer 方程对数据进行处理[5],如式(2)所示。
式中, F0为无猝灭剂时荧光物质的荧光强度(a.u.);Δ F为猝灭剂存在时荧光强度的差值(a.u.); fa为荧光基团与猝灭剂接近的部分;[Q]为抗癌物浓度(mol/L); Ka 为结合常数,以 F0/Δ F对1/[Q]作图,如图2-4所示,相关结合常数( Ka)列于表2中。 由表2可以看出, Ka 随着温度的升高而减小,这与静态猝灭机制相符。 同时结合常数在1.0×104~1.0×106 L/mol,可见TSC-Ir-6与BSA之间形成的复合物较稳定,这说明TSC-Ir-6能在血清蛋白中存储和运输[6],同时也是TSC-Ir-6具有药理活性的佐证。
 | 图4 抗癌物TSC-Ir-6在不同温度时猝灭 BSA的修正Stern-Volmer关系图Fig.4 Modified Stern-Volmer diagram of TSC-Ir-6 anticancer agent quenching BSA at different temperature |
| 表2 抗肿瘤配合物TSC-Ir-6与BSA 的修正Stern-Volmer猝灭常数 Ka与反应热力学参数 Table 2 Modified stern volmer quenching constant Ka and thermodynamic parameters of antitumor complex TSC-Ir-6 and BSA |
药物小分子与生物大分子之间发生相互作用主要是通过静电引力、氢键、范德华力和疏水作用力进行的[11]。 根据其相互作用的热力学参数计算,可以大致确定抗肿瘤配合物TSC-Ir-6与 BSA 之间的主要作用力类型。 当温度变化范围不大时,反应焓变可以视作常数[12]。 范特霍夫方程如式(3)和(4)所示:
式(3)和(4)中, Ka为结合常数;Δ H为焓变(kJ/mol);Δ S为熵变(J/(mol·K));Δ G为吉布斯自由能变(kJ/mol); R为理想气体常数(J/(mol·K)); T为热力学温度(K)。
以1n K对1/ T作图,线性相关系数为0.99,如图5所示。
'>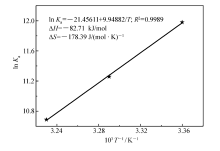 | 图5 抗癌物TSC-Ir-6与BSA相互作用的范特霍夫方程图Fig.5 Van't Hoff equation diagram of the interaction between the anticancer compound TSC-Ir-6 and BSA |
根据式(3)和(4)作图并计算TSC-Ir-6与 BSA 之间作用的热力学参数,结果列于表2中。 实验数据显示:Δ G<0说明抗癌物TSC-Ir-6与BSA的结合是一个自发过程,同时Δ H<0且Δ S<0,说明氢键和范德华力在相互作用中发挥主要作用。
对于静态猝灭,当小分子与生物大分子有独立且相同的结合位点时,则处于平衡态的游离的小分子与结合的小分子数可通过双对数方程计算,如式(5)所示:
式中, Kb为表观结合常数; n为TSC-Ir-6体系结合位点数。 以 log ( F0- F) /F对log [Q]作图,如图6所示,相关数据列于表3。 Kb值随温度的上升而减小,且 n值约为1,表明每个BSA分子可以结合一个TSC-Ir-6分子。 随着温度升高, Kb和 n值逐渐增大。 说明BSA与该配合物之间能形成很强的作用力,并以氢键和范德华力作用于该位点。
 | 图6 抗癌物TSC-Ir-6与BSA相互作用的表观结合常数关系图Fig.6 The relationship between the apparent binding constants of the anticancer TSC-Ir-6 and BSA |
| 表3 抗癌物TSC-Ir-6与BSA表观结合常数 Table 3 The apparent binding constant of anticancer TSC-Ir-6 and BSA |
金属离子的存在会影响配合物和蛋白质的结合[7],所以进一步探讨了298 K下普通金属离子对BSA-TSC-Ir-6 体系的表观结合常数的影响,其中共存离子的浓度与BSA的浓度相同均为2×10-6 mol/L。
如表4和图7所示,当有普通金属离子(K+、Na+、Ca2+、Mg2+、Al3+、Fe3+、Zn2+和Cr2+)存在时,抗癌物TSC-Ir-6 与BSA之间的结合常数明显增大,出现这种现象的原因可能是由于金属离子在抗癌物TSC-Ir-6 与 BSA 之间起“离子架桥作用”[8],形成配合物后使其疏水性增强,易于与蛋白结合,进而使结合常数增加,导致配合物与BSA的结合力更强。 根据药代动力学原理,在一定程度上,血清白蛋白与药物结合常数的增加将会对血浆中药物的浓度起到一定的缓冲作用,使药物作用的持续时间延长[7]。 配合物分子与 BSA 结合力的增加在一定程度上能够缓冲其在血液中的浓度,提高配合物在血浆中的滞留时间,因而可能得到更加理想的治疗效果[13]。
| 表4 不同共存离子存在下,抗癌物TSC-Ir-6与BSA的表观结合常数 Table 4 The apparent binding constant of anticancer TSC-Ir-6 and BSA in the presence of different coexisting ions |
本文在近生理条件下,利用荧光光谱法和紫外-可见吸收光谱法系统研究了抗癌物TSC-Ir-6与BSA的相互作用。 实验结果表明:BSA内源荧光与抗癌物 TSC-Ir-6浓度之间呈良好的线性关系,说明TSC-Ir-6与BSA发生了相互作用;根据相关公式计算了其猝灭常数,结合常数,表观结合常数,其猝灭方式为静态猝灭;其相关热力学参数证明TSC-Ir-6与BSA结合是一个自发过程(Δ G<0),而且体系Δ H<0,Δ S<0,二者的相互作用结合方式主要是通过氢键和范德华力结合,结合位点约为1;常见离子的存在使抗癌物TSC-Ir-6与BSA的结合力增强,提高了其在血浆中的滞留时间,可能得到更佳的治疗效果。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|