共同通讯联系人:张国宝,研究员; Tel:0371-65511781; Fax:0371-65727239; E-mail:xiehuwangzi@163.com; 研究方向:有机合成
N-氰乙基- N-羟乙基苯胺是一种具有广泛用途的染料中间体,针对传统合成方法中的缺陷,以1-丁基-3-甲基咪唑硫酸氢盐([BMIM]HSO4)为催化剂,丙烯腈和 N-羟乙基苯胺为原料,建立了 N-氰乙基- N-羟乙基苯胺的绿色合成新工艺。 系统考察了离子液体种类、离子液体用量、底物比例等因素的影响规律,结果表明,[BMIM]HSO4用量为0.8 mmol, n( N-羟乙基苯胺): n(丙烯腈)=1:1.2,反应温度为90 ℃,反应时间为12 h 时, N-氰乙基- N-羟乙基苯胺产率最高(89%),离子液体循环使用5次后,催化活性基本保持不变。
Co-corresponding author:ZHANG Guobao, professor; Tel:0371-65511781; Fax:0371-65727239; E-mail:xiehuwangzi@163.com; Research interests:organic synthesis
N-Cyanoethyl- N-hydroxyethylaniline is an important dye intermediate with a wide range of applications. A green and efficient protocol for the synthesis of N-cyanoethyl- N-hydroxyethylaniline by reaction of acrylonitrile and N-hydroxyethyl aniline with 1-butyl-3-methylimidazolium hydrosulphates ionic liquid ([Bmim]HSO4) as the catalyst has been developed, eliminating the inert-gas welding and complex operation of traditional methods. The effect of ionic liquid, the amount of ionic liquid, the ratio of substrates, temperature and time were investigated. The optimum reaction conditions were obtained as follow:[BMIM]HSO4 0.8 mmol, n( N-hydroxyethyl aniline): n(acrylonitrile)=1:1.2, reaction time of 12 h, reaction temperature of 90 ℃. The acdic ionic liquid could be easily separated and reused for at least 5 times without significantly decrease in catalytic activity.
含氰基分散染料具有色光鲜艳、分子消光系数大、各项牢度好和应用性能优良等优点,是应用最广泛的染料品种之一[1,2,3,4,5,6]。 而 N-氰乙基- N-羟乙基苯胺是合成含氰基分散染料的重要中间体,主要用于分散红S-FL、分散大红3GFL、分散黄棕2RFL等含氰基分散染料的合成[7,8,9,10,11,12]。 传统的合成方法是以 N-氰乙基苯胺和环氧乙烷为原料发生羟乙基化反应来制备 N-氰乙基- N-羟乙基苯胺,目前的合成工艺主要有3种:1)不使用催化剂在CO保护下,高温高压下发生羟乙基化反应合成 N-氰乙基- N-羟乙基苯胺,但是在这个过程中,由于反应在高温高压下进行,环氧乙烷很容易异构成醛,而醛又会与原料 N-氰乙基苯胺及产物进行反应,生成结构复杂的副产物,从而降低 N-氰乙基- N-羟乙基苯胺的产率及纯度[13,14,15];2)以醋酸、二价酸的碱金属盐或三价酸的碱金属二氢盐(如NaH2PO4)为催化剂,在70~80 ℃,一定压力下发生羟乙基化反应合成 N-氰乙基- N-羟乙基苯胺[16];3)以氯化锌或者冰醋酸作催化剂,30~80 ℃常压下发生羟乙基化反应合成 N-氰乙基- N-羟乙基苯胺[17,18]。 后两种工艺虽然在一定程度上避免了高温高压反应带来的不足,但是由于仍使用易燃易爆的环氧乙烷为原料,生产过程中存在一定的危险性并且污染环境;此外,反应所使用的金属催化剂难以循环使用且对环境不友好。 因此,急需对 N-氰乙基- N-羟乙基苯胺的制备工艺进行改进,满足工业生产需求。
离子液体由于不挥发、热稳定性好和可循环使用等优点已经被广泛地应用于化学化工等领域[19,20,21,22,23,24,25]。 例如,酸性胍盐离子液体被成功地应用于合成二苯并[d,f][1,3]二噁烷[26],咪唑离子液体能够催化纤维素水解[27,28],酸性离子液体可以催化苯并[a]咔唑合成[29],我们的研究发现离子液体能够催化选择性烷基化反应[30]、酚类化合物的选择性反应[31]等一系列新现象。 为了解决目前 N-氰乙基- N-羟乙基苯胺合成中存在的问题,满足工业生产需求,本文将离子液体作为催化剂和反应媒介,通过丙烯腈和 N-羟乙基苯胺的反应来合成 N-氰乙基- N-羟乙基苯胺,系统考察了离子液体种类、离子液体用量、底物比例、温度、时间等因素的影响规律,并获得最佳反应条件。
N, N-二甲基乙酰胺和 N-甲基咪唑购自中国医药集团上海化学试剂有限公司; [BMIM]Cl、 N-甲基吡咯烷、三乙胺、硫酸、磷酸、丙烯腈和氯代正丁烷购自阿拉丁试剂有限公司; N-羟乙基苯胺购自Alfa-sigma(天津)化学有限公司;以上试剂纯度均为化学纯。
6700 FTIR型傅里叶变换红外光谱仪(FT-IR,美国Nicolet 公司);Bruker AVANCE DMX 500型核磁共振波谱仪(NMR,德国Bruker公司)。
以[BMIM]HSO4为例, 将 N-甲基咪唑和氯代正丁烷以物质的量比1:1加入三口瓶, 加入甲苯作为溶剂, 在N2气保护下, 加热回流9 h。 反应完毕后, 用乙腈和乙酸乙酯混合溶液进行重结晶, 80 ℃旋蒸并真空干燥过夜, 得到1-丁基-3-甲基咪唑氯盐。 将所得到的1-丁基-3-甲基咪唑氯盐加入到烧瓶中, 以二氯甲烷为溶剂, 冰浴条件下滴加等化学计量的硫酸。 滴加完毕后, 混合物回流反应48 h, 所产生的HCl通入到尾气接受瓶中。 反应完毕后, 旋蒸出去溶剂, 80 ℃真空干燥过夜即得到[BMIM]HSO4。1H NMR(400 MHz, CDCl3), δ:0.88(t, 3H), 1.23(t, 2H), 1.75(t, 2H), 3.84(s, 3H), 4.15(t, 2H), 7.69(s, 1H), 7.75(s, 1H), 9.12(s, 1H);13C NMR(100 MHz, CDCl3), δ:13.3, 19.2, 31.9, 36.0, 49.3, 122.4, 123.8, 136.3。
[BMIM]BF4:1H NMR(400 MHz, CDCl3), δ:0.87(t, 3H), 1.22(t, 2H), 1.74(t, 2H), 3.82(s, 3H), 4.13(t, 2H), 7.68(d, 2H), 9.05(s, 1H);13C NMR(100 MHz, CDCl3), δ:13.3, 19.2, 31.8, 36.0, 49.7, 122.4, 123.8, 135.7。
[BMIM]PF6:1H NMR(400 MHz, CDCl3), δ:0.85(t, 3H), 1.21(t, 2H), 1.71(t, 2H), 3.79(s, 3H), 4.10(t, 2H), 7.67(d, 2H), 9.03(s, 1H);13C NMR(100 MHz, CDCl3), δ:13.6, 19.0, 31.7, 35.8, 49.5, 122.3, 123.5, 135.5。
[OMIM]BF4:1H NMR(400 MHz, CDCl3), δ:0.80(t, 3H), 1.19(m, 10H), 1.72(m, 2H), 3.79(s, 3H), 4.09(t, 2H), 7.67(d, 2H), 9.02(s, 1H);13C NMR(100 MHz, CDCl3), δ:13.5, 21.6, 25.4, 27.6, 27.8, 30.3, 30.5, 36.1, 49.8, 122.5, 123.6, 135.9。
[NHCH]H2PO4:1H NMR(400 MHz, CDCl3), δ:1.47(m, 4H), 1.63(m, 2H), 2.26(t, 2H), 3.03(m, 2H), 7.41(s, 1H);13C NMR(100 MHz, CDCl3), δ:23.5, 29.8, 30.7, 36.9, 42.6, 179.8。
[DMFH]H2PO4:1H NMR(400 MHz, CDCl3), δ:2.70(s, 3H), 2.86(s, 3H), 7.92(s, 1H);13C NMR(100 MHz, CDCl3), δ:31.5, 36.6, 162.9。
[NMPH]H2PO4:1H NMR(400 MHz, CDCl3), δ:2.87(m, 2H), 2.15(t, 2H), 3.66(s, 3H), 3.27(t, 2H);13C NMR(100 MHz, CDCl3), δ:17.6, 29.6, 30.5, 49.4, 175.1。
[NMPH]HSO4:1H NMR(400 MHz, CDCl3), δ:1.88(t, 2H), 2.16(t, 2H), 2.67(s, 3H), 3.29(t, 2H);13C NMR(100 MHz, CDCl3), δ:17.6, 29.5, 30.7, 49.3, 175.1。
[HMIM]HSO4:1H NMR(400 MHz, CDCl3), δ:3.85(s, 3H), 7.60(s, 1H), 7.65(s, 1H), 8.98(s, 1H);13C NMR(100 MHz, CDCl3), δ:36.1, 122.3, 123.7, 136.4。
[HMIM]H2PO4:1H NMR(400 MHz, CDCl3), δ:3.72(s, 3H), 7.24(s, 2H), 8.46(s, 1H);13C NMR(100 MHz, CDCl3), δ:35.8, 121.6, 122.8, 136.1。
在装有冷凝管、温度计以及油浴加热条件下的烧瓶中,按一定物质的量配比加入丙烯腈、 N-羟乙基苯胺和离子液体,搅拌升温反应。 反应结束后冷却至室温,经减压蒸馏除去未反应的低沸点原料;萃取,合并萃取液并旋干,得到 N-氰乙基- N-羟乙基苯胺。
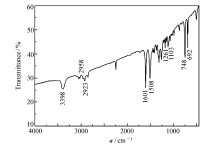
通过FT-IR表征了产物的结构,如图1所示。 3398 cm-1处的吸收峰为O—H的伸缩振动峰,2958和2923 cm-1处出现了亚甲基的伸缩振动峰,1103 cm-1出现了为—C=O的伸缩振动峰,1261 cm-1处的吸收峰为C—N的伸缩振动峰,1508、1601、748和 692 cm-1处的吸收峰为苯环的伸缩振动峰。
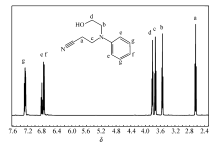
图2为 N-氰乙基- N-羟乙基苯胺的核磁谱图。 可见,为与氰基相连的亚甲基出现在2.64处,与氮相连的两个亚甲基出现在3.54 和3.73处,3.81处的三重峰为 N-氰乙基- N-羟乙基苯胺分子中与羟基相连的亚甲基,6.75~6.83和7.25~7.29的多重峰为 N-氰乙基- N-羟乙基苯胺分子中单取代苯环。 结合红外光谱的分析结果,目标化合物被成功合成出来。
2.2.1 离子液体种类的影响
首先,[BMIM]Cl、[BMIM]BF4、[OMIM]BF4和[BMIM]PF6这4种离子液体被用来催化丙烯腈和 N-羟乙基苯胺的反应,结果如表1所示。 可见,这4种离子液体并不具有催化丙烯腈和 N-羟乙基苯胺反应的活性(表1,Entries 1-4)。 为了促进反应的进行,改用4种酰胺类酸性离子液体来催化该反应。 酰胺类酸性离子液体虽然可以催化丙烯腈和 N-羟乙基苯胺的反应并得到 N-氰乙基- N-羟乙基苯胺,但是最高的产率只有26%(Entries 5-8)。
| 表1 离子液体对产物产率的影响 Table 1 The effect of different ionic liquids on the yield of the product |
为了得到更高的产率,3种酸性咪唑离子液体[BMIM]HSO4、[HMIM]HSO4、[HMIM]H2PO4用来催化丙烯腈和 N-羟乙基苯胺的反应 (表1,Entries 9-11)。 可见,在这3种酸性咪唑离子液体中,[BMIM]HSO4的催化效果最好(表1,Entry 11),产率为66%,且优于同等条件下使用浓硫酸作为催化剂的结果(表1,Entry 12)。 因此,选择酸性离子液体[BMIM]HSO4用于接下来的反应优化。
2.2.2 离子液体用量的影响
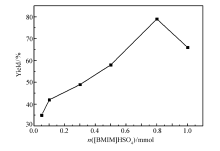
图3为[BMIM]HSO4用量对产率的影响。 考察了0.5 mmol丙烯腈、0.5 mmol N-羟乙基苯胺分别在0.05、0.1、0.5、0.8和1 mmol [BMIM]HSO4催化下90 ℃反应12 h的情况。 可见,当离子液体用量从1 mmol减少到为0.8 mmol时,反应的产率从66%增加到79%;继续减少离子液体的量,反应的产率将会逐渐降低,当使用0.05 mmol离子液体的时候,生成的 N-氰乙基- N-羟乙基苯胺的产率只有35%。 以上结果表明,离子液体用量为0.8 mmol时催化效果最好。
2.2.3 底物物质的量比的影响
考察了 n( N-羟乙基苯胺): n(丙烯腈)对合成 N-氰乙基- N-羟乙基苯胺反应的影响。 在相同条件下:0.8 mmol酸性离子液体[BMIM]HSO4做催化剂, N-羟乙基苯胺和丙烯腈在90 ℃反应12 h的情况。 当 n( N-羟乙基苯胺): n(丙烯腈)分别为1:1、1:1.2、1:1.5和1:2 时,产物的产率分别为79%、89%、89%和89%。 可见,随着丙烯腈浓度的增加, N-氰乙基- N-羟乙基苯胺的产率逐渐提高,当 n( N-羟乙基苯胺): n(丙烯腈)=1:1.2时,反应的产率达到89%。 继续增加丙烯腈的量,反应的产率不再提高。
2.2.4 反应温度的影响
考察了不同温度对于合成 N-氰乙基- N-羟乙基苯胺反应的影响。 在相同的条件下:0.6 mmol丙烯腈、0.5 mmol N-羟乙基苯胺在酸性离子液体[BMIM]HSO4催化下反应12 h的情况。 在80、90、100和120 ℃时,产物的产率分别为72%、89%、70%和48%。 可见,反应在90 ℃条件下可以得到最好的结果,所得到 N-氰乙基- N-羟乙基苯胺的产率达到最高(89%)。 反应温度的升高将会导致 N-氰乙基- N-羟乙基苯胺产率的下降,当升高温度至120 ℃, N-氰乙基- N-羟乙基苯胺的产率降低为48%。 其原因可能是由于原料丙烯腈的沸点较低,当温度升高时,反应体系中的丙烯腈更容易挥发从而导致产率降低。 降低反应温度同样会导致产率降低,反应在80 ℃进行时,所得到 N-氰乙基- N-羟乙基苯胺的产率只有72%,这可能是由于低温条件下分子间的相互作用减慢引起反应不完全造成的。
2.2.5 反应时间的影响
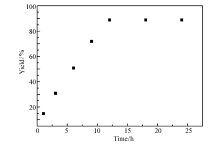
图4为反应时间的影响,考察了0.6 mmol丙烯腈、0.5 mmol N-羟乙基苯胺在0.8 mmol酸性离子液体[BMIM]HSO4作用下90 ℃反应1、3、6、9、12、18和24 h的情况。 时间对于反应有着显著影响。 反应1 h, N-氰乙基- N-羟乙基苯胺的产率只有15%;随着反应时间的增加, N-氰乙基- N-羟乙基苯胺的产率逐渐增大;反应至12 h, N-氰乙基- N-羟乙基苯胺的产率达到89%;继续延长反应时间对 N-氰乙基- N-羟乙基苯胺的产率影响不大。
2.2.6 催化剂的循环使用
考察了酸性离子液体[BMIM]HSO4的循环使用性能。 每次反应完成后,酸性离子液体[BMIM]HSO4经乙酸乙酯洗涤、减压蒸馏、干燥后可直接用于催化下一次反应。 在同样的反应条件下,重复5次后,产物的产率分别为89%、89%、89%、88%和88%。 可见,酸性离子液体[BMIM]HSO4经过重复5次后依然保持稳定的催化活性。
本文通过酸性离子液体催化丙烯腈和 N-羟乙基苯胺的取代反应,实现了 N-氰乙基- N-羟乙基苯胺的高效合成。 反应中使用性能稳定、催化效率高、可循环使用的酸性离子液体作为催化剂,解决了传统合成方法中存在的操作复杂、环境污染等问题,为 N-氰乙基- N-羟乙基苯胺的合成探索了一条高效、温和、环境友好的新途径。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|