经过实验验证引入水有利于芳香醛、丙二腈和邻苯二甲酰肼三组分的反应进行,催化量的有机碱三乙胺(Et3N)或无机碱磷酸氢二钾(K2HPO4·3H2O)可以在常规条件下促进该反应。本文以39%~97%的产率合成一系列1 H-吡唑[1,2-b]酞嗪-5,10-二酮衍生物。 两种催化剂均溶于水,因此,反应结束后催化剂的分离与产物提纯简便易行。 此方法具有反应条件温和、绿色环保、操作简单、后处理方便等特点。
Catalytic amount of organic base triethylamine (Et3N) or inorganic base dipotassium hydrogen phosphate (K2HPO4·3H2O) is proved to effectively promote the three components reaction of aromatic aldehyde, malononitrile and phthalhydrazide under conventional heating conditions. As expected, introduction of water is favorable to the reaction. A series of 1 H-pyrazole [1,2-b]pyridazine-5,10-diones derivatives was synthesized in the yield of 39%~97%. Both catalysts are soluble in water, and introduction of water also facilitate the separation of the catalyst after reaction. This approach also has advantages of mild reaction conditions, green environmental protection, simple operation and convenient post-treatment.
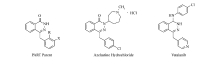
酞嗪又称2,3-二氮杂萘,是一种重要的含氮杂环化合物。 酞嗪单元是许多具有生物活性的有机化合物的重要结构基础[1,2,3,4,5,6],在药物、农用化学品和功能材料领域受到越来越多的关注[7,8,9,10]。 如图1所示,DNA修复酶(PART)母体是一种细胞抑制剂,能够抑制肿瘤细胞DNA修复;盐酸氮卓斯汀具有抗组胺、抗炎症的特性,可以治疗季节性过敏性鼻炎;瓦他拉尼具有抗肿瘤的活性。 此外,酞嗪类化合物在发光材料和荧光探针方面也显示出良好的性能[11]。 因此,其合成方法的研究引起有机化学研究者们的广泛兴趣。 1 H-吡唑[1,2-b]酞嗪-5,10-二酮是重要的酞嗪衍生物,目前发展了多种催化体系合成该类化合物,如[Simp]3PW12O40[12]、Fe3O4@SiO2-NPs[13]、Ni-NPs[14]、Sllica-SO3H[15]、对甲苯磺酸(PTSA)[16]、[Bmim]OH[17]、[SiPMIM]OH@MNPs[18]、ZrO2-NPs[19]和nano-PbO[20]等。 然而,使用碱性催化剂的报道较少,并且现有的碱催化方法存在较大的改进和优化空间。 例如,NaOH或NaHCO3可以促进反应进行,但需要使用与底物等量的碱,且产率较低[21,22];三乙胺作催化剂,在常规加热、搅拌条件下几乎不发生反应,需要使用超声波辅助反应进行[23]。 因此,寻找更加简单方便的合成方法、廉价绿色的碱性催化剂合成酞嗪衍生物引起我们实验室的研究兴趣。
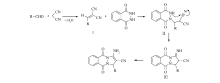
近年来,水作为有机反应介质表现出独特的优势。 水介质中有机物的疏水效应可大幅度提高有机反应速率,此外,大多数有机反应在完成之后产物会析出或分层,可极大地简化后处理过程[24,25]。 我们实验室在利用水促进反应合成4 H-吡喃、多氢喹啉、香豆素-3-羧酸类衍生物等方面取得了一些经验[26,27,28,29]。 三乙胺和磷酸氢二钾是化学品市场上最常见的试剂,它们在工业、农业和医药工业等方面应用广泛。 三乙胺和磷酸氢二钾均易溶于水[30],如果使用它们作为水相反应中的催化剂可以简化反应结束后提纯和分离催化剂的问题。 更重要的是,根据文献[31]和我们实验室经验,水辅助作用下这两种催化剂能更好地发挥催化性能。 本文在前期工作的基础上,选择乙醇和水的混合溶液作为环境友好的绿色反应介质,以碱性的三乙胺或磷酸氢二钾为催化剂实现不同取代的苯甲醛、丙二腈和邻苯二甲酰肼的三组分一锅法反应,合成酞嗪衍生物,合成路线见Scheme 1。
乙醇、苯甲醛购自天津科密欧化学试剂有限公司;三乙胺购自天津大茂化学试剂厂;1,8-二氮杂二环十一烯-7-烯(DBU)、 N, N-二异丙基乙胺(DIPEA)、丙二腈和异丁醇购自上海阿拉丁试剂有限公司;邻苯二甲酰肼购自上海萨恩化学技术有限公司;2-氯苯甲醛、3-氯苯甲醛、4-氯苯甲醛、2-溴苯甲醛、3-溴苯甲醛、4-溴苯甲醛、2-甲基苯甲醛、3-甲基苯甲醛和4-甲基苯甲醛购自天津阿法埃沙化学有限公司;2-硝基苯甲醛、3-硝基苯甲醛、2-甲氧基苯甲醛和3-甲氧基苯甲醛购自上海阿拉丁试剂有限公司。 以上试剂纯度均为分析纯。
Bruker TENSOR 27型傅里叶变换红外光谱仪(FT-IR,德国Bruker公司);Bruker Avance 500 MHz型核磁共振仪(NMR,德国Bruker公司);X-5型数字熔点仪(温度未经校正)(北京泰克仪器有限公司)。
Et3N催化合成1 H-吡唑[1,2-b]酞嗪-5,10-二酮衍生物 将Et3N(0.10 mmol)、醛(0.50 mmol)、丙二腈(0.50 mmol)、邻苯二甲酰肼(0.50 mmol)、0.70 mL乙醇和0.30 mL水置于10 mL的反应瓶中,100 ℃,搅拌10 min。 反应结束后再加入1 mL乙醇,在100 ℃ 下继续快速搅拌去除杂质。 充分冷却后抽滤,产物不需要再进行额外的提纯操作就可以得到纯净的化合物。
K2HPO4· 3H2O催化合成1 H-吡唑[1, 2-b]酞嗪-5, 10-二酮衍生物 K2HPO4· 3H2O(0.004 mmol)、醛(0.50 mmol)、丙二腈(0.50 mmol)、邻苯二甲酰肼(0.50 mmol)、0.25 mL乙醇和0.25 mL水置于10 mL的反应管中, 90 ℃, 搅拌2 h。 反应结束后加入1.5 mL乙醇, 在90 ℃ 下继续快速搅拌10 min以除去杂质。 充分冷却后抽滤, 产物不需要再进行额外的提纯操作就可以得到纯净的化合物。
3-氨基-1-苯基-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4a) 黄色固体; IR(KBr), σ/cm-1:3359, 2194, 1654, 1380, 1276, 1149, 698, 582;1H NMR(500 MHz, DMSO- d6), δ:8.28~8.26(m, 1H), 8.11~8.07(m, 3H), 7.98~7.96(m, 2H), 7.45(d, J=16.1 Hz, 2H), 7.39~7.31(m, 3H), 6.14(s, 1H);13C NMR(125 MHz, DMSO- d6), δ:156.6, 153.6, 150.6, 138.4, 134.6, 133.7, 128.7, 128.6, 128.5, 128.2, 127.2, 126.7, 126.6, 115.9, 63.0, 61.5。
3-氨基-1-(2-氯)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4b) 黄色固体; IR(KBr), σ/cm-1:3375, 3236, 2210, 1670, 1570, 1381, 1277, 1142, 1047, 758, 692;1H NMR (500 MHz, DMSO- d6), δ:8.32~8.25(m, 1H), 8.19~8.05(m, 3H), 8.03~7.94(m, 2H), 7.60 (dd, J=7.3, 2.1 Hz, 1H), 7.50~7.43(m, 1H), 7.40~7.28(m, 2H), 6.47(s, 1H);13C NMR (125 MHz, DMSO- d6), δ:157.2, 154.0, 151.7, 135.8, 135.2, 134.4, 131.8, 130.4, 130.2, 129.3, 128.9, 128.3, 127.8, 127.2, 116.1, 61.1, 60.3。
3-氨基-1-(3-氯)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4c) 黄色固体; IR(KBr), σ/cm-1:3364, 3262, 2199, 1657, 1570, 1381, 1281, 1142, 1028, 789, 692;1H NMR (500 MHz, DMSO- d6), δ:8.31~8.21(m, 1H), 8.13~8.06(m, 1H), 8.01~7.93(m, 1H), 7.63(d, J=2.0 Hz, 1H), 7.47~7.43(m, 1H), 7.43~7.37(m, 1H), 6.15(s, 1H);13C NMR (125 MHz, DMSO- d6), δ:157.2, 154.3, 151.3, 141.5, 135.1, 134.2, 133.8, 130.9, 129.5, 129.1, 128.8, 127.7, 127.2, 127.1, 116.4, 62.9, 61.4。
3-氨基-1-(4-氯)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4d) 黄色固体; IR(KBr), σ/cm-1:3373, 3263, 2197, 1665, 1570, 1377, 1277, 1136, 835, 698;1H NMR (500 MHz, DMSO- d6), δ:8.29~8.21(m, 1H), 8.17~8.03(m, 3H), 8.01~7.89(m, 2H), 7.58~7.48(m, 2H), 7.46~7.40(m, 2H), 6.16(s, 1H);13C NMR (125 MHz, DMSO- d6), δ:157.1, 154.2, 151.2, 137.9, 135.1, 134.2, 133.4, 129.3, 129.0, 127.7, 127.2, 116.4, 62.8, 61.5。
3-氨基-1-(2-溴)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4e) 黄色固体; IR(KBr), σ/cm-1:3370, 3238, 2205, 1666, 1570, 1381, 1277, 1026, 759, 698;1H NMR (500 MHz, DMSO- d6), δ:8.33~8.23(m, 1H), 8.17~8.06(m, 3H), 8.03~7.94(m, 2H), 7.64 (dd, J=8.0, 0.9 Hz, 1H), 7.57(d, J=7.0 Hz, 1H), 7.37(t, J=7.4 Hz, 1H), 7.28(td, J=7.7, 1.6 Hz, 1H), 6.45(s, 1H);13C NMR (125 MHz, DMSO- d6), δ:157.1, 154.1, 151.7, 135.2, 134.3, 133.9, 130.7, 129.3, 128.9, 127.8, 127.2, 121.6, 116.1, 63.1, 60.5。
3-氨基-1-(3-溴)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4f) 黄色固体; IR(KBr), σ/cm-1:3370, 3260, 2191, 1655, 1570, 1383, 1279, 1031, 692, 563;1H NMR (500 MHz, DMSO- d6), δ:8.29~8.22(m, 1H), 8.14~8.06(m, 3H), 8.00~7.93(m, 2H), 7.76(t, J=1.7 Hz, 1H), 7.56~7.45(m, 2H), 7.34(t, J=7.8 Hz, 1H), 6.14(s, 1H);13C NMR (125 MHz, DMSO- d6), δ:157.2, 154.2, 151.3, 141.7, 135.1, 134.2, 131.7, 131.2, 130.0, 129.5, 129.0, 127.7, 127.2, 126.5, 122.3, 115.4, 62.8, 61.4。
3-氨基-1-(4-溴)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4g) 黄色固体; IR(KBr), σ/cm-1:3373, 3262, 2201, 1668, 1568, 1377, 1275, 1018, 829, 696, 549;1H NMR (500 MHz, DMSO- d6), δ:8.31~8.21(m, 1H), 8.15~8.05(m, 3H), 7.99~7.91(m, 2H), 7.60~7.51(m, 2H), 7.49~7.41(m, 2H), 6.14(s, 1H);13C NMR (125 MHz, DMSO- d6), δ:157.1, 154.2, 151.2, 138.4, 135.1, 134.2, 131, 9, 129.7, 129.3, 129, 0, 127.8, 127.2, 121.9, 116.4, 62.9, 61.4。
3-氨基-1-(2-硝基)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4h) 黄色固体; IR(KBr), σ/cm-1:3379, 3173, 2210, 1666, 1493, 1377, 1277, 1076;1H NMR (500 MHz, DMSO- d6), δ:11.51(s, 2H), 8.29~8.26(m, 1H), 8.18(s, 1H), 8.09~8.03(m, 3H), 8.00~7.95(m, 1H), 7.90~7.83(m, 3H), 7.73~7.59(m, 1H), 6.63(s, 1H);13C NMR (125 MHz, DMSO- d6), δ:157.1, 154.3, 152.1, 148.8, 135.2, 134.8, 134.4, 133.0, 130.1, 129.4, 129.3, 128.8, 127.8, 127.2, 125.6, 124.8, 116.1, 60.2, 58.7。
3-氨基-1-(3-硝基)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4i) 黄色固体; IR(KBr), σ/cm-1:3362, 3248, 2195, 1670, 1537, 1379, 1285, 1136, 694, 567;1H NMR (500 MHz, DMSO- d6), δ:8.43(t, J=2.0 Hz, 1H), 8.30~8.24(m, 1H), 8.22~8.14(m, 3H), 8.12~8.05(m, 1H), 8.04~7.91(m, 3H), 7.69(t, J=8.0 Hz, 1H), 6.35(s, 1H);13C NMR (125 MHz, DMSO- d6), δ:157.3, 154.4, 151.6, 148.5, 141.3, 135.1, 134.3, 130.6, 129.5, 129.0, 127.7, 127.2, 123.8, 122.4, 116.3, 62.6, 60.8。
3-氨基-1-(2-甲基)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4j) 黄色固体; IR(KBr), σ/cm-1:3371, 2194, 1670, 1573, 1423, 1272, 1149, 1095, 759, 694;1H NMR(500 MHz, DMSO- d6), δ:8.27(s, 1H), 8.09(s, 3H), 7.97(s, 2H), 7.34~7.17(m, 4H), 6.34(s, 1H), 2.47(s, 3H);13C NMR(125 MHz, DMSO- d6), δ:156.6, 153.5, 150.6, 136.4, 135.2, 134.7, 133.7, 130.4, 128.7, 128.5, 127.9, 127.3, 126.6, 126.5, 126.4, 115.9, 61.1, 60.0, 18.5。
3-氨基-1-(3-甲基)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4k) 黄色固体; IR(KBr), σ/cm-1:3361, 3259, 2194, 1658, 1570;1H NMR(500 MHz, DMSO- d6), δ:8.27~8.25(m, 1H), 8.10~8.07(m, 3H), 7.97~7.95(m, 2H), 7.27~7.24(m, 3H), 7.14(d, J=5.9 Hz, 1H), 6.08(s, 1H), 2.30(s, 3H);13C NMR(125 MHz, DMSO- d6), δ:156.6, 153.6, 150.5, 138.4, 137.8, 134.6, 133.6, 128.9, 128.7, 128.6, 128.3, 127.2, 127.1, 126.6, 124.0, 116.0, 63.0, 61.6, 20.9。
3-氨基-1-(4-甲基)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4l) 黄色固体; IR(KBr), σ/cm-1:3359, 2194, 1658, 1380, 1276, 1149, 694, 574;1H NMR(500 MHz, DMSO- d6), δ:8.24(s, 1H), 8.07(s, 3H), 7.94(s, 2H), 7.35(d, J=7.6 Hz, 2H), 7.17(d, J=7.5 Hz, 2H), 6.10(s, 1H), 2.30(s, 3H);13C NMR(125 MHz, DMSO- d6), δ:156.5, 153.5, 150.5, 137.6, 135.3, 134.6, 133.6, 129.0, 128.7, 128.6, 127.2, 126.8, 126.6, 116.0, 62.8, 61.5, 20.7。
3-氨基-1-(2-甲氧基)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4m) 黄色固体; IR(KBr), σ/cm-1:3385, 3256, 2201, 1660, 1564, 1381, 1280, 756, 696;1H NMR (500 MHz, DMSO- d6), δ:8.34~8.23(m, 1H), 8.14~8.06(m, 1H), 8.04~7.93(m, 4H), 7.30(t, J=8.1 Hz, 2H), 7.05(d, J=8.1 Hz, 1H), 6.92(t, J=7.4 Hz, 1H), 6.35(s, 1H), 3.75(s, 3H);13C NMR (125 MHz, DMSO- d6), δ:157.1, 157.0, 153.7, 151.5, 135.2, 134.2, 129.9, 129.2, 129.1, 127.8, 127.2, 126.4, 121.2, 116.4, 112.2, 61.2, 59.5, 56.3。
3-氨基-1-(3-甲氧基)-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4n) 黄色固体; IR(KBr), σ/cm-1:3360, 3261, 3063, 2193, 1670, 1568, 1255, 696, 572;1H NMR (500 MHz, DMSO- d6), δ:8.29~8.24(m, 1H), 8.13~8.08(m, 1H), 8.06(s, 2H), 8.00~7.94(m, 2H), 7.28(t, J=7.9 Hz, 1H), 7.01(t, J=5.1 Hz, 2H), 6.92~6.87(m, 1H), 6.10(s, 1H), 3.75(s, 3H);13C NMR (125 MHz, DMSO- d6), δ:159.9, 157.2, 154.2, 151.1, 140.6, 135.1, 134.2, 130.1, 129.3, 129.1, 127.8, 127.2, 119.2, 116.5, 113.9, 113.2, 63.4, 61.9, 55.6。
3-氨基-1-异丙基-5, 10-二氢-5, 10-二氧-1 H-吡唑[1, 2-b]酞嗪-2-腈(4o) 黄色固体; IR(KBr), σ/cm-1:3369, 2189, 1658, 1379, 1275, 1141, 696, 569;1H NMR(500 MHz, DMSO- d6), δ:8.24~8.20(m, 2H), 8.02~7.95(m, 4H), 5.24~5.23(d, J=2.8 Hz, 2H), 2.70~2.64(m, 1H), 1.07~1.05(d, J=7.2 Hz, 3H), 0.80~0.79(d, J=6.8 Hz, 3H);13C NMR(125 MHz, DMSO- d6), δ:161.7, 159.3, 157.6, 140.0, 139.0, 134.0, 133.6, 132.5, 132.0, 122.3, 70.0, 60.0, 35.0, 23.2, 20.3。
2.1.1 反应条件优化
2010年,Nabid等[23]报道以Et3N为催化剂,微波辅助丙二腈、邻苯二甲酰肼和苯甲醛之间的反应,50 ℃下反应60 min得到酞嗪类化合物,在常规搅拌条件下,只检测到微量目标产物。 根据我们对实验的设想,水可以辅助三乙胺促进反应进行。 因此,选择丙二腈、邻苯二甲酰肼和苯甲醛之间的反应作为模型,探究水存在下对三乙胺催化该反应的影响(表1)。 与文献[23]相比,在相同的反应温度和时间下向体系中加入少量水,常规搅拌即可获得高达92%产率(表1,Entry 1)。 证实了水能够协助反应进行的设想,简化了操作方法。
| 表1 化合物4a合成条件的优化 Table 1 Optimization of the reaction conditions for the synthesis of compound 4a |
为了能够进一步缩短反应时间,在100 ℃条件下继续优化反应条件。 3种有机碱相比,三乙胺的催化效果最好,加入DBU和DIPEA的反应产率降低很多(表1,Entries 2-4)。 接下来考察水和乙醇的用量对结果的影响(表1,Entries 5-7),溶剂最佳用量为1 mL,EtOH和H2O 的体积比为0.7:0.3时产物产率达到最高,增加或减少水的用量产物产率均有所降低。 在此条件下反应时间可以缩短到10 min,产率仍为93%(表1,Entry 10)。 最后考察催化剂的用量和原料间物料比对该反应的影响(表1,Entries 11-15),改变催化剂用量和苯甲醛、丙二腈及邻苯二甲酰肼的物料比产率没有提升。 综上所述,该反应最佳条件为:以0.7 mL乙醇和0.3 mL水的混合液为溶剂、摩尔分数为20%的Et3N为催化剂,苯甲醛、丙二腈和邻苯二甲酰肼的物质的量之比为1:1:1,100 ℃下常规搅拌10 min。
2.1.2 反应对底物的普适性
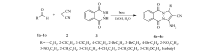
在确定的最佳反应条件下,系统地考察了不同取代的芳香醛和异丁醛与丙二腈、邻苯二甲酰肼之间的反应,扩大该方法的应用范围,结果列于表2中。 根据结果可以看出,该方法的底物适用范围较广,大多数含有不同取代基的苯甲醛均能顺利地反应,并且产率与苯甲醛相比没有较大的变化。 总体来说空间效应和电子效应对该反应的产率影响不大,不论是包含供电子基团还是吸电子基团的底物均能以较好的产率得到产物。 邻位取代的芳香醛大多数情况与取代基处于间位的底物产率相当,略高于对位取代。 苯环上连有强吸电子基团硝基时情况比较特殊,邻位和对位底物的反应副反应较多,甚至产物难以提纯(表2,Entries 8-9)。 当硝基处于间位时,反应未受到影响。 分析原因,邻对位取代的苯甲醛,受硝基影响较大,底物过于活泼导致副反应较多,所以产率急剧降低。 当醛为异丁醛时,产物产率也能达到76%,表明该方法也适用于脂肪醛(表2,Entriey 15)。
| 表2 化合物4的底物拓展 Table 2 Scope of substrates for the synthesis of compound 4 |
2.2.1 反应条件对反应的影响
前一部分实验确定了水对该反应有促进作用,根据我们对实验的设想,继续选择丙二腈、邻苯二甲酰肼和苯甲醛之间的反应作为模型探究磷酸盐对该反应的催化效果,结果列于表2中。 结合本实验室前期工作经验,首先考察3种磷酸的钾盐对该反应的催化效果(Entries 1-3)。 加入磷酸氢二钾的反应产率(87%)好,磷酸二氢钾产率(54%)最差。 说明在乙醇和水的反应体系中碱性催化剂要优于弱酸性催化剂,但磷酸钾的碱性较强,反应效果不好。 为验证这一结论,继续考察了Na2CO3、K2CO3和NaHCO3对该反应的催化效果。 从表3中可以看出,K2CO3催化效果最差(产率60%),NaHCO3催化效果最好(产率83%)。 进一步说明弱碱性体系有利于反应的进行,因此,选择K2HPO4·3H2O作为此反应的催化剂。 在此基础上探究溶剂的用量和体积比对反应结果的影响,相同条件下扩大溶剂的量至1 mL,产率反而降低(表3,Entry 7),当溶剂量为0.5 mL时,改变EtOH和H2O的体积比,二者用量为1:1时产率最高为90%(表3,Entries 8-12)。 另外,催化剂的量可以降低到8%(摩尔分数),产率可提高到95%(表3,Entry 14),继续降低催化剂用量产物产率开始降低。 在此反应条件下分别尝试了以CH3OH或PEG-400与水的混合溶液为溶剂,均未得到更加理想的效果(表3,Entries 16-17)。 进一步研究表明改变苯甲醛、丙二腈和邻苯二甲酰肼的物料比产率未提升。 最后探究了温度、时间对该反应的影响。 在90 ℃下,反应2 h,得到了97%的目标产物的产率(表3,Entry 18)。 综上所述,反应的最佳条件是:以0.25 mL乙醇和0.25 mL水的混合液为溶剂、物质的量分数为8%的K2HPO4·3H2O为催化剂,苯甲醛、丙二腈和邻苯二甲酰肼的物质的量比为1:1:1,90 ℃反应2 h。
| 表3 化合物4a合成条件的优化 Table 3 Optimization of the reaction conditions for the synthesis of compound 4a |
2.2.2 反应对底物的普适性
为探究此方案的一般性以及有效性,考察了不同取代的苯甲醛和异丁醛与丙二腈和邻苯二甲酰肼的反应。 由于含有不同取代基的苯甲醛受到电子和空间效应的影响,其反应活性发生变化,其它条件不变,延长反应时间至2.5 h。 由表4可知,不同取代的苯甲醛均以中等至优异的产率得到相应的酞嗪衍生物。 但该部分的底物扩展的结果不如三乙胺催化体系效果好,大部分取代的芳香醛与丙二腈、邻苯二甲酰肼反应,产物产率低于苯甲醛。 在该反应体系中空间效应和电子效应对反应的影响明显。 从空间效应看,大部分邻位取代的芳香醛其产物产率高于间位和对位取代的底物。 从电子效应看,芳环上连有弱的吸电子基团的产率高于连有供电子基团的产率。 连有硝基的情况同样比较特殊,邻位取代的苯甲醛的产率较低(表4,Entry 8),但间位的产率良好(表4,Entry 9),分析原因与三乙胺的反应体系相同,当苯环的邻位上连有强吸电子基团时,诱导效应和共轭效应导致醛羰基的活性过强,从而增加了副反应的进行,使主反应产率降低。
| 表4 化合物4的底物拓展 Table 4 Scope of substrates for the synthesis of compound 4 |
图2描述了合成1 H-吡唑[1,2-b]酞嗪-5,10-二酮可能的机理。在碱作用下,醛和丙二腈发生Knoevenagel缩合反应生成中间体Ⅰ,随后与邻苯二甲酰肼发生Michael加成生成中间体Ⅱ,最终通过环化和互变异构得到相应的目标产物。 根据文献报道和本实验室前期经验[37,38],水具有较高的介电常数,水的加入能够促进活性亚甲基化合物产生亲核物种,有利于其与醛之间的反应。 另外,水的加入也有利于碱的溶解,更好地形成均相反应体系。
选取催化量的有机碱三乙胺(摩尔分数20%)或无机碱磷酸氢二钾(摩尔分数8%)促进醛、丙二腈和邻苯二甲酰肼的三组分反应,高效、高产率合成一系列1 H-吡唑[1,2-b]酞嗪-5,10-二酮衍生物。 两种催化剂均溶于水,因此,水的引入即能促进反应进行,又便于反应结束后催化剂的分离。 后处理时不需要再进行额外的提纯操作,经过简单的抽滤和淋洗就可以得到纯净的目标化合物。 该体系无需使用有害的有机溶剂,复杂和昂贵的催化剂,实验操作和分离程序简便,具有广阔的应用前景。
辅助材料(Supporting Information)[化合物4a-4o的核磁谱图]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|