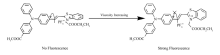
以三苯胺和苯并噻唑盐为原料,设计合成了一种具有红光发射特性的D- π-A型荧光粘度探针 N-乙酸乙酯基-2-(4-甲酸甲酯基三苯胺-4'-乙烯基)苯并噻唑六氟磷酸盐(L),运用现代分析测试手段进行了系统地表征。 研究结果表明,探针L的最大发射波长为630 nm,能有效地降低生物背景,提高生物成像的信噪比。 该探针对粘度有很好的荧光响应,其荧光强度比值( I/I0)的对数与粘度的对数呈现很好的线性关系( R2=0.9934)。 此外,探针L对极性的敏感性小,且荧光信号不受生物分子的干扰。 生物学研究结果表明,探针L具有低的细胞毒性,可应用于细胞内微环境粘度的荧光成像。
A red-emitting D- π-A type fluorescence probe ( E)-3-(2-ethoxy-2-oxoethyl)-2-(4-((4-(methoxycarbonyl)phenyl)(phenyl)amino)styryl)benzo[d]thiazol-3-ium hexafluorophosphate salt(L) based on triphenylamine and benzothiazole salts for detecting viscosity was designed and synthesized, which was fully characterized by modern analytical testing methods. The systematic investigations indicated that probe L displayed a strong fluorescence emission at about 630 nm in viscous media, which could minimize the background noises effectively and improve the signal-to-noise( S/N) ratio of biological imaging. Probe L exhibited great sensitivity to viscosity. Moreover, probe L showed a good linear relationship ( R2=0.9934) between the fluorescence intensity response (log ( I/I0)) and viscosity (log η). Besides, probe L exhibited a good selectivity and could serve as a fluorescent probe for sensing viscosity without being interfered by polarity and other analytes. Furthermore, biological experimental indicated that probe L possesses low cytotoxicity, which can be applied to the fluorescence imaging of intracellular microenvironment viscosity.
细胞内粘度是物质交换,化学信号传递和生物分子间相互作用的重要影响因素[1,2]。 细胞内粘度异常可作为某些疾病诊断的参考指标,如细胞恶性肿瘤、阿尔兹海默病、动脉粥样硬化等[3,4,5,6],因此监测细胞水平的粘度变化对维持正常生命活动至关重要。 传统的测量粘度方法,如旋转粘度计、毛细管粘度计等,只对宏观体积的粘度测量有效,而无法精准检测微粘度的变化[7]。 荧光探针因其灵敏度高、响应速度快、使用方便等优点,在细胞内微环境粘度变化检测方面具有广泛的应用[3,4,8]。 例如,2019年,林伟英课题组[9]报道了一种红色荧光探针用于检测细胞和小鼠体内的粘度。 同年,李林课题组[10]设计合成了几种近红外荧光探针用于检测细胞内的粘度。
分子转子作为一类具有扭曲的分子内电荷转移效应(TICT)的特殊荧光材料,一般具有可旋转的D- π-A共轭结构[10],在低粘度介质中,分子内旋转导致激发能松弛,从而显著削弱荧光发射,而在高粘度条件下,自由旋转被粘着的环境抑制,分子主要以辐射方式释放能量,荧光显著增强[11,12,13,14]。 但目前大部分荧光粘度探针的激发波长短 (<500 nm),存在蓝绿区的细胞自发荧光干扰,且穿透深度有限,不利于生物成像[11,15,16]。 具有红光发射性能的荧光探针由于其拥有长的波长,可以消除细胞内蓝绿区自发荧光的影响,从而降低背景噪音,提高信噪比。 因此,设计一种新型的具有红光发射性能的荧光粘度探针具有潜在的应用价值。
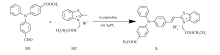
本文以三苯胺为电子给体,以噻唑盐为电子受体,通过Knoevenagel缩合反应设计合成了一种具有红光发射性能的D- π-A型荧光粘度探针L(Scheme 1)。 引入酯基可提高分子的溶解性。 系统研究了探针L的荧光强度随粘度的变化,结果表明随着粘度的增加,探针L的荧光强度显著增强,大约增加65倍,并将其应用于细胞成像。
Bruker Avance 400型核磁共振仪(NMR,美国布鲁克公司); Nicolet FT-IR-is5型傅里叶变换红外光谱仪(FT-IR,日本岛津有限公司);Finnigan LCQ型质谱仪(MS,美国赛默飞公司);UV-1700型紫外分光光度计(UV-Vis,日本岛津有限公司);HITACHI F-4600型荧光分光度计(日本日立公司),测试条件:激发波长为510 nm,狭缝宽度均为10.0 nm,电压为500 V;Infinite 200 pro型酶标仪(瑞士Tecan公司);TCS SP 8型共聚焦显微成像系统(德国徕卡公司)。
罗丹明B(99%)、三苯胺(98%)、2-甲基苯并噻唑(98%)、溴乙酸乙酯(98%)和其它合成所用原料及试剂均购自阿拉丁试剂有限公司,试剂纯度均为分析纯,人非小细胞肺癌细胞株(A549)来源于皖南医学院药学院中心实验室。 实验用水为去离子水。
称取4-醛基-4'-甲酸甲酯三苯胺(M1)[17]0.66 g(2.0 mmol)和溴代 N-乙酸乙酯基-2-甲基苯并噻唑盐(M2)[18]0.63 g(2.0 mmol)置于100 mL圆底烧瓶中, 加入30 mL无水乙醇溶解, 5滴哌啶作为催化剂, 回流12 h。 然后加入AgPF6 0.50 g(2.0 mmol)继续反应4 h。 待反应完全后, 趁热抽滤, 旋干溶剂, 粗产品经硅胶柱层析提纯, 洗脱液为二氯甲烷/甲醇(体积比100:1), 得红黑色固体1.39 g, 产率50%。1H NMR(DMSO- d6, 400 MHz), δ:8.44(d, J = 7.8 Hz, 1H), 8.27(d, J = 15.2 Hz, 1H), 8.17(d, J = 8.4 Hz, 1H), 7.95(m, 4H), 7.83(m, 3H), 7.47(t, J = 7.8 Hz, 2H), 7.32(m, 1H), 7.21(d, J = 7.5 Hz, 2H), 7.14(m, 4H), 6.01(s, 2H), 4.24(q, J = 7.1 Hz, 2H), 3.84(s, 3H), 1.25(t, J = 7.1 Hz, 3H);13C NMR(DMSO- d6, 100 MHz), δ:173.3, 165.6, 145.1, 140.9, 132.1, 130.9, 130.2, 128.3, 128.1, 126.7, 126.2, 124.4, 124.1, 122.9, 122.0, 116.1, 110.6, 62.5, 51.9, 13.9; IR(KBr), σ/cm-1:2978, 2923, 1746, 1574, 1508, 1489, 1331, 1274, 1176, 1025, 842, 754, 557, 506; ESI-MS:549.1845[M-PF6]+。
将可传代的A549接种于96孔板中,在37 ℃,5%CO2条件下培养,当细胞密度长至70%~80%左右时,在培养基中分别加入不同浓度的探针L(5~30 μmol/L),同时设置对照组和调零组。 孵育12 h后,每孔加入10 μL 3-(4,5-二甲基噻唑-2)2,5-二苯基四氮唑溴盐)(MTT)溶液(10 mg/mL),继续培养4 h。 移除培养基,每孔加入100 μL 二甲基亚砜(DMSO),恒温震荡15 min,用酶标仪测定490 nm处每个孔的吸光值。
将可传代的A549细胞接种于共聚焦小皿中,细胞密度长至60%~70%时,分别进行以下2个实验: 1)A549细胞与探针L(10 μmol/L)共孵育30 min;2)A549细胞与制霉菌素(10 μmol/L)共孵育1 h,然后加入探针L(10 μmol/L)孵育30 min。 孵育好的细胞用磷酸盐缓冲液(PBS)洗涤3次,用激光共聚焦显微镜观察细胞。
为了探究化合物L是否对溶剂极性有响应,选择了苯、四氢呋喃、乙酸乙酯、乙醇、乙腈和二甲基亚砜6种溶剂,研究探针L在不同极性的溶剂中UV-Vis吸收光谱和荧光发射光谱的变化。 如图1所示,探针L的最大吸收峰位于520 nm左右,可归属于分子内电荷转移跃迁。 该探针的主要荧光发射峰位于630 nm左右。 虽然探针L的吸收峰和发射峰在不同的溶剂中存在一定的位移,但探针L在各溶剂中的荧光强度均不高,量子产率均小于0.1。 表明溶剂极性的不同对探针L的影响不大,这对其作为分子转子检测环境粘度至关重要[19]。
为了探究粘度对探针L的光学响应,测试了探针在水和甘油混合溶剂中的荧光发射性质。
如图2A所示,在510 nm激发波长下,随着甘油体积分数的不断增加,溶液粘度由0%(水)增加到99%(99%甘油),荧光强度增加了65倍。 造成这种现象的原因可归结于:在低粘度的环境中,由于C—C单键的旋转,使得噻唑盐和苯环之间不能共平面,从而构成了扭曲的分子内电荷转移机制导致非辐射衰变,但在高粘度的环境中,C—C单键的旋转受到限制,增强了分子的平面性,从而导致探针L的荧光增强(图3)[20]。 同时发现,甘油体积分数小于80%时,荧光增强不明显,而超过此值后,荧光强度显著增强,且荧光光谱峰发生蓝移(从640 nm蓝移到630 nm),造成这一现象的可能原因是在高粘度的甘油中,分子的扭转受限会引起荧光增强,另一方面也会导致TICT态很难形成,从而使得发射峰蓝移[21]。 值得注意的是,该探针发射波长约为635 nm,属于红光发射,对人体组织的穿透性较强,可以起到更明显、更直接的生物效应。 此外,在粘度范围内,根据Föster-Hoffmann方程[17],探针L的荧光强度比( I/I0)的对数与溶液粘度( η)的对数有良好的线性拟合关系( R2=0.9934)(图2B),表明探针L可用于定量检测微环境中的粘度。
此外,还探究了探针L在不同溶剂中的荧光量子产率,由图2C可知,探针L在低粘度溶剂中量子产率均很低,均小于0.1,而在水和甘油的混合溶剂中,量子产率随粘度的增加显著增强,在99%甘油中,量子产率高达0.77,荧光量子产率的变化与光谱变化一致,以上实验数据充分说明,探针L对粘度的强烈敏感性,且可用来检测环境的粘度。
细胞内环境复杂,探针L在细胞内可能受到DNA,RNA等生物大分子的影响,故进行了探针L的荧光光谱选择性测试。 向探针L中分别加入DNA、RNA、BSA和各种氨基酸,观察探针L对它们的荧光响应,如图4所示。 在多种氨基酸、DNA和RNA存在下,探针L的荧光强度几乎没有变化,而在99%的甘油中,探针L的荧光强度明显增强,说明探针L能专一性响应粘度而不受其它生物分子的干扰,可以用于监测复杂环境下的粘度变化。
高的细胞存活率是进行生物应用的重要因素。 在进行生物细胞显影之前,利用MTT法测试了探针L的细胞毒性。 从图5中可知,当探针L与细胞作用12 h后,细胞的存活率达到85%以上,说明探针L具有较低的生物毒性,可应用于生物学研究。
 | 图5 不同浓度的探针L对A549细胞的毒性Fig.5 Cytotoxicity assays of probe L with different concentrations for A549 cells |
-从图6可知,仅用探针L孵育的A549细胞只表现出弱的荧光。 当用制霉菌素刺激细胞后再加入探针L孵育,可观察到明显的红色荧光,说明探针L可作为荧光粘度探针用于细胞成像。
以三苯胺和噻唑衍生物为母体,合成了一种具有D- π-A构型的荧光探针L。 系统研究了探针L对粘度的识别性质。 结果表明,随着粘度的增加,探针L的荧光强度显著增强,约65倍,其最大发射峰位于630 nm左右,而且探针L的荧光强度比值的对数与粘度的对数呈现很好的线性关系( R2=0.9934),可以定量地检测微环境中的粘度。 选择性实验证明了探针L能够专一性响应粘度而不受其它生物分子的影响。 生物实验结果表明探针L细胞毒性较小,且在制霉菌素处理过的A549细胞中发射出明亮的红色荧光。 本文为设计具有红光发射的荧光粘度探针提供了设计思路。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|