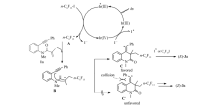
发展了一种可见光诱导的1,7-烯炔与全氟烷基卤串联原子转移自由基加成(ATRA)/环化合成含氟2,4-二氢异喹啉-2(1 H)-酮的反应。以多氟烷基碘或溴为自由基前体,面式-三( 2-苯基吡啶)合铱(摩尔分数1%)为光敏剂,在5 W蓝光发光二极管(LED)照射下,多种苯桥联1,7-烯炔顺利发生串联(ATRA)/环化反应,以中等到优秀(62%~84%)的产率合成了一系列多氟化异喹啉酮衍生物。 此合成方法反应条件温和、清洁、高效且底物适用范围广,为具有潜在药用价值的多氟化2,4-二氢异喹啉-2(1 H)-酮的合成提供新的途径。
Visible light-induced reaction of 1,7-enyne with perfluoroalkyl halide through a tandem atom transfer radical addition (ATRA)/cyclization sequence, synthesizing fluorinated 2,4-dihydroisoquinoline-2(1 H)-one was developed. With polyfluoroalkyl iodine or bromine as the free radical precursor, fac-Ir (ppy)3 (molar fraction 1%) as the photosensitizer, ATRA/cyclization reactions of various benzene-linked 1,7-enyne occurred successfully under 5 W blue light emitting diode (LED) irradiation. A series of polyfluorinated isoquinolone derivatives was synthesized in modorate to excellent yields (62%~84%). This highly efficient synthetic method is mild and clean, providing a new way for the synthesis of polyfluoride 2,4-dihydroisoquinoline-2(1 H)-ketone with potential medicinal value.
分子结构中氟原子的引入通常会改变其物理和生物学性质,并大大提高亲脂性、代谢稳定性和生物利用度。 因此,含氟化合物在医药、农药和材料等领域有着广泛应用[1]。 在有机分子中,特别是一些氮杂环结构中,引入氟代烷基的合成方法引起了许多化学家关注[2]。 此外,异喹啉酮是一种重要的高生理活性分子的构建骨架,广泛分布于天然产物、医药化合物及农药分子中[3,4]。 因此,将氟代烷基基引入该骨架中将极大地提高或改善其相关物化性能,具有重要的意义。 值得注意的是,目前相关科研人员主要聚焦于在分子中引入简单的三氟甲基、二氟甲基或单氟甲基方法的发展[5,6,7]。 相对而言,在分子骨架中引入全(多)氟烷基基团(CF2(CF2) nR, n≥1)的报道较少[8],且引入的多氟烷基基团的种类较为单一,而且多采用价格昂贵、制备复杂、反应副产物环境污染严重的含氟试剂,如Togni试剂、Umemoto试剂、CF3SO2Cl等。 因此,鉴于全(多)氟烷基卤(包括全氟烷基碘/溴/氯)价格相对低廉、商业渠道易得和种类较丰富等优点,该类含氟试剂是一类较为理想的多氟烷基自由基氟源(常见有 i/n-C3F7I, n-C4F9I, n-C6F13I, n-C8F17I, n-C10F21I,ICH2CF3,BrC6F13,BrCF2CO2Et,BrCF2H, CF2Br2,BrCF2R;ClCF2H,ClCF2CO2Et等)。
另一方面,不饱和烃与氟烷基卤试剂的原子转移自由基加成(ATRA)反应,文献报道大多是有关炔烃或烯烃的1,2-加成模式[10,11],而烯炔与氟烷基卤远程1,6-ATRA反应少有报道,且需要采用过渡金属催化(如Pd,Cu/Fe等)[12],还存在底物的适应范围不广,引入的含氟基团限于活泼的ICF2CO2Et等问题。 例如,2015年,Liang课题组[13]报道了钯催化1,6烯炔与碘二氟乙酸乙酯的环化反应,氟源只限于活泼的ICF2CO2Et。 2017年,Wang课题组[14]报道了铜/铁-协同催化1,6-烯炔与全氟烷烃的环化反应,但只适应于含末端炔基结构的1,6-烯炔。 最近,Tang研究组[15]报道了光致氧化还原催化1, n-烯炔与多氟烷基卤的ATRA(原子转移自由基加成)反应,但采用的氟源主要是全氟丁基卤试剂,且探索的重心是有关1,6-烯炔的加成反应。 基于以上研究背景以及我们对不饱和烃多氟烷基化反应的研究兴趣,在此报道一种可见光诱导的1,7-烯炔与全氟烷基卤串联ATRA/环化合成含氟2,4-二氢异喹啉-2(1 H)-酮的反应。 以多氟烷基碘或溴为自由基前体,面式-三( 2-苯基吡啶)合铱( fac-Ir(ppy)3)(摩尔分数1%)为光敏剂,在5 W蓝光光电二极管(LED)照射下,多种苯桥联1.7-烯炔顺利发生串联(ATRA)/环化反应。 此反应条件温和、清洁高效,且底物适用范围广,为具有潜在药用价值的多氟化2,4-二氢异喹啉-2(1 H)-酮的合成提供新的途径。
全氟碘/溴代烷基、芳香炔、草酰氯、邻碘苯胺、烷基胺试剂、2,2,6,6-四甲基哌啶-氮氧化物(TMEPO)和 fac-Ir( ppy)3等均购自安耐吉化学试剂公司,其它试剂除标明外均为分析纯。 实验中所需的原料 N-甲基- N-(2-(苯基乙炔基)苯基)甲基丙烯酰胺参照相关文献[16]方法合成得到。
AVANCE 400 MHz 型核磁共振波谱仪(NMR,瑞士 Bruker 公司) ;GC-MS-QP2010型质谱仪(MS,日本岛津公司);RE-52AA 型旋转蒸发仪( 上海亚荣生化仪器厂) ;XT5A 型显微熔点仪( 北京市科仪电光学仪器厂) 。
以产物3a的合成为例,在封管中一次加入81.1 mg(0.3 mmol) N-甲基- N-(2-(苯基乙炔基)苯基)甲基丙烯酰胺(1a),1.9 mg fac-Ir( ppy)3(摩尔分数1.0%),127.2 mg(0.6 mmol) K3PO4 ,267.5 mg(0.6 mmol)全氟己基碘,加入2 mL二氧六环作为溶剂,并使用N2气保护,在5 W蓝色发光二极管(LED)灯照射下,搅拌,反应24 h。 经TLC检验反应完全后,经柱层析分离,石油醚-乙酸乙酯(体积比8:1)梯度洗脱,得到目标产物3a,为一种黄色固体,产率为85%。
黄色固体3a 产率83%; mp 131.3~132.7 ℃;1H NMR(400 MHz, CDCl3), δ:7.87(d, J = 8.0 Hz, 1H), 7.46~7.41(m, 1H), 7.36~7.34(m, 4H), 7.28~7.25(m, 1H), 7.21(td, J = 7.6, 1.2 Hz, 1H), 7.07(d, J = 1.2 Hz, 1H), 3.44(s, 3H), 2.28~2.14(m, 1H), 1.85~1.84(m, 1H), 1.15(s, 3H);13C NMR(100 MHz, CDCl3), δ:169.9, 146.5, 139.3, 137.9, 132.2, 130.5, 130.0, 128.3, 128.2, 128.1, 127.8, 127.5, 123.1, 118.5~107.2(m), 114.3, 100.7, 48.4, 37.2(t, J = 19.2 Hz), 31.1, 21.8;19F NMR(376 MHz, CDCl3), δ:-80.7~-80.8(m, 3F), -107.8~-108.6(m, 1F), -114.1(d, JF-F = 267.0 Hz, 1F), -121.7(br, 2F), -122.9(br, 2F), -124.1(br, 2F), -126.1~-126.3(m, 2F); HRMS m/z (ESI)计算值C25H17F13INNaO+[M+Na]+ 744.0039, 实测值744.0036。
黄色油状物3b 产率84%;1H NMR(400 MHz, CDCl3), δ:7.86(d, J = 7.6 Hz, 1H), 7.39~7.37(m, 6H), 7.32~7.28(m, 3H), 7.22~7.15(m, 3H), 7.00(d, J = 8.0 Hz, 1H), 5.32(d, J = 16.0 Hz, 1H), 5.15(d, J = 16.4 Hz, 1H), 2.47~2.32(m, 2H), 2.11~1.98(m, 1H), 1.20(s, 3H);13C NMR(100 MHz, CDCl3), δ:170.0, 146.3, 139.4, 137.3, 136.6, 132.1, 131.3, 130.0, 128.9, 128.8, 128.4, 128.2, 128.2, 127.8, 127.5, 127.4, 126.8, 126.2, 123.3, 118.3~107.6(m), 115.3, 100.9, 48.6, 47.5, 37.2(t, J = 19.9 Hz), 21.8;19F NMR(376 MHz, CDCl3), δ:-80.7~-80.8(m, 3F), -107.8~-108.6(m, 1F), -114.2(d, JF-F = 267.0 Hz, 1F), -121.8(br, 2F), -122.9(br, 2F), -124.3(br, 2F), -126.1~-126.3(m, 2F); HRMS m/z (ESI)计算值C31H21F13INNaO [M+Na]+ 820.0352, 实测值820.0356。
黄色固体3c 产率75%; mp 142.2~143.9 ℃;1H NMR (400 MHz, CDCl3), δ:7.68(s, 1H), 7.37~7.34(m, 4H), 7.28~7.25(m, 1H), 7.23 (dd, J = 8.0, 1.2 Hz, 1H), 6.95(d, J = 8.4 Hz, 1H), 3.41(s, 3H), 2.41(s, 3H), 2.29~2.16(m, 1H), 1.98~1.84(m, 1H), 1.14(s, 3H);13C NMR(100 MHz, CDCl3), δ:169.8, 146.5, 139.6, 135.5, 132.7, 132.6, 130.3, 130.3, 128.3, 128.1, 128.1, 127.8, 127.5, 118.3~107.6(m), 114.2, 100.3, 48.4, 37.2, 31.0(t, J = 20.0 Hz), 21.8, 20.6;19F NMR (376 MHz, CDCl3), δ:-80.8~-80.9(m, 3F), -107.4~-108.3(m, 1F), -114.1(d, JF-F = 267.0 Hz, 1F), -121.8(br, 2F), -122.9(br, 2F), -124.3(br, 2F), -126.1~-126.2(m, 2F); HRMS m/z (ESI)计算值C26H19F13INNaO [M+Na]+758.0196, 实测值758.0192。
黄色固体3d 产率78%; mp 136.4~137.9 ℃;1H NMR(400 MHz, CDCl3), δ:7.87(s, 1H), 7.40(dd, J = 8.4, 2.4 Hz, 1H), 7.36~7.32(m, 4H), 7.29~7.27(m, 1H), 7.00(d, J = 8.8Hz, 1H), 3.42(s, 3H), 2.27~2.15(m, 1H), 2.01~1.88(m, 1H), 1.14(s, 3H);13C NMR(100 MHz, CDCl3), δ:169.7, 146.1, 138.2, 136.5, 132.0, 131.8, 129.7, 128.4, 128.4, 128.2, 128.1, 127.9, 127.4, 118.1~107.2(m), 115.6, 102.1, 48.3, 37.3(t, J = 19.9 Hz), 31.1, 21.9;19F NMR (376 MHz, CDCl3), δ:-80.8~-80.9(m, 3F), -107.4~-108.3(m, 1F), -114.2(d, JF-F = 267.0 Hz, 1F), -121.8(br, 2F), -122.9(br, 2F), -124.3(br, 2F), -126.1~-126.2(m, 2F); HRMS m/z (ESI)计算值C25H16ClF13INNaO [M+Na]+777.9650, 实测值777.9654。
黄褐色固体3e 产率65%; mp 121.4~122.6 ℃;1H NMR(400 MHz, CDCl3), δ:7.86(d, J = 7.8 Hz, 1H), 7.43(t, J = 8.4, 1.6, 1H), 7.33~7.25(m, 2H), 7.19(td, J = 7.6, 0.8 Hz, 1H), 7.06(d, J = 7.6 Hz, 1H), 6.88(ddd, J = 17.2, 8.4, 2.6 Hz, 2H), 3.85(s, 3H), 3.43(s, 3H), 2.20(dd, J = 36.8, 14.8 Hz, 1H), 1.98~1.85(m, 1H), 1.18(s, 3H);13C NMR(100 MHz, CDCl3), δ:170.1, 159.2, 139.4, 139.3, 137.9, 132.8, 130.3, 130.1, 129.8, 128.7, 122.8, 114.2, 113.9, 112.8, 102.5, 55.3, 49.6, 34.8(d, J = 18.3 Hz), 31.1, 22.5;19F NMR(376 MHz, CDCl3), δ:-76.3~-77.2(m, 6F), -188.3~-188.4(m, 1F); HRMS m/z (ESI)计算值C23H19F7INNaO2[M+Na]+624.0241, 实测值624.0240。
黄色固体3f 产率75%; mp 137.4~138.6 ℃;1H NMR (400 MHz, CDCl3), δ:7.87(d, J = 8.0 Hz, 1H), 7.46~7.41(m, 1H), 7.36~7.34(m, 4H), 7.28~7.25(m, 1H), 7.20 (td, J = 7.6, 1.2 Hz, 1H), 7.06(d, J = 1.2 Hz, 1H), 3.44(s, 3H), 2.28~2.14(m, 1H), 1.85~1.84(m, 1H), 1.14(s, 3H);13C NMR(100 MHz, CDCl3), δ:169.9, 146.6, 139.2, 137.7, 132.2, 130.5, 130.0, 128.3, 128.2, 128.1, 127.8, 127.5, 123.1, 114.3, 100.7, 48.4, 37.1(t, J = 19.8 Hz), 31.1, 21.9;19F NMR(376 MHz, CDCl3), δ:-76.3~-77.2(m, 6F), -188.3~-188.4(m, 1F); HRMS m/z (ESI)计算值C22H17F7INNaO [M+Na]+594.0135, 实测值594.0131。
黄色固体3g 产率74%; mp 140.4~141.4 ℃;1H NMR (400 MHz, CDCl3), δ:7.68(s, 1H), 7.36~7.33(m, 4H), 7.28~7.26(m, 1H), 7.24~7.22(m, 1H), 6.93(d, J = 8.4 Hz, 1H), 3.42(s, 3H), 2.41(s, 3H), 2.29~2.16(m, 1H), 1.97~1.84(m, 1H), 1.13(s, 3H);13C NMR(100 MHz, CDCl3), δ:169.8, 146.5, 139.6, 135.5, 132.6, 132.5, 130.4, 130.3, 128.2, 128.1, 128.0, 127.8, 127.5, 114.2, 100.3, 48.4, 37.1(t, J = 18.4 Hz), 31.0, 21.8, 20.7;19F NMR (376 MHz, CDCl3), δ:-76.3~-77.2(m, 6F), -188.3~-188.4(m, 1F); HRMS m/z (ESI)计算值C23H19F7INNaO [M+Na]+608.0292, 实测值608.0294。
黄色固体3h 产率77%; mp 150.7~151.9 ℃;1H NMR (400 MHz, CDCl3), δ:7.87(s, 1H), 7.40(dd, J = 8.4, 2.4 Hz, 1H), 7.36~7.32(m, 4H), 7.29~7.27(m, 1H), 7.00(d, J = 8.8Hz, 1H), 3.42(s, 3H), 2.27~2.15(m, 1H), 2.01~1.88(m, 1H), 1.14(s, 3H);13C NMR(100 MHz, CDCl3), δ:169.7, 146.1, 138.2, 136.5, 132.0, 131.8, 129.7, 128.4, 128.4, 128.2, 128.1, 127.9, 127.4, 118.1~107.2(m), 115.6, 102.1, 48.3, 37.3(t, J = 19.9 Hz), 31.1, 21.9;19F NMR (376 MHz, CDCl3), δ:-80.8~-80.9(m, 3F), -107.4~-108.3(m, 1F), -114.2(d, JF-F = 267.0 Hz, 1F), -121.8(br, 2F), -122.9(br, 2F), -124.3(br, 2F), -126.1~-126.2(m, 2F); HRMS m/z (ESI)计算值C25H16ClF13INNaO [M+Na]+777.9650, 实测值777.9654。
淡黄色固体3i 产率81%; mp 154.1~155.2℃;1H NMR(400 MHz, CDCl3), δ:7.87(s, 1H), 7.40(dd, J = 8.4, 2.4 Hz, 1H), 7.36~7.32(m, 4H), 7.29~7.26(m, 1H), 7.00(d, J = 8.8 Hz, 1H), 3.42(s, 3H), 2.21(dd, J = 36.0, 13.2Hz, 1H), 2.01~1.87(m, 1H), 1.14(s, 3H);13C NMR(100 MHz, CDCl3), δ:169.7, 146.1, 138.2, 136.6, 132.0, 131.8, 129.7, 128.4, 128.4, 128.2, 128.1, 127.9, 127.4, 118.1~107.2(m), 115.5, 102.1, 48.3, 37.3(t, J = 20.1 Hz), 31.1, 21.9;19F NMR(376 MHz, CDCl3), δ:-80.8(t, JF-F = 9.8 Hz, 3F), -107.9~-108.7(m, 1F), -113.8(d, JF-F = 266.6 Hz, 1F), -121.5(br, 2F), -122.0(br, 4F), -122.7(br, 2F), -124.1(br, 2F), -126.1(br, 2F); HRMS m/z (ESI)计算值C27H16ClF17INNaO [M+Na]+877.9586, 实测值877.9589。
淡黄色固体3j 产率82%; mp 158.9~159.4 ℃;1H NMR(400 MHz, CDCl3), δ:7.87(s, 1H), 7.40 (dd, J = 8.4, 2.4 Hz, 1H), 7.36~7.32(m, 4H), 7.29~7.26(m, 1H), 7.00(d, J = 8.8 Hz, 1H), 3.42(s, 3H), 2.21 (dd, J = 36.0, 13.2 Hz, 1H), 2.01~1.87(m, 1H), 1.14(s, 3H);13C NMR(100 MHz, CDCl3), δ:169.7, 146.1, 138.2, 136.6, 132.0, 131.8, 129.7, 128.4, 128.4, 128.2, 128.1, 127.9, 127.4, 118.2~107.1(m), 115.5, 102.1, 48.3, 37.3(t, J = 20.0 Hz), 31.1, 21.9;19F NMR(376 MHz, CDCl3), δ:-80.8(t, JF-F = 9.8 Hz, 3F), -107.5~-108.4(m, 1F), -114.2(d, JF-F = 267.4 Hz, 1F), -121.7(br, 10F), -122.7(br, 2F), -124.3(br, 2F), -126.1(br, 2F); HRMS m/z (ESI)计算值C29H16ClF21INNaO[M + Na]+977.9522, 实测值977.9526。
淡黄色固体3k 产率72%; mp 110.2~112.1 ℃;1H NMR (400 MHz, CDCl3), δ:7.68(s, 1H), 7.37~7.34(m, 4H), 7.28~7.25(m, 1H), 7.23 (dd, J = 8.0, 1.2 Hz, 1H), 6.95(d, J = 8.0 Hz, 1H), 3.41(s, 3H), 2.41(s, 3H), 2.29~2.16(m, 1H), 1.97~1.84(m, 1H), 1.14(s, 3H);13C NMR(100 MHz, CDCl3), δ:169.8, 146.5, 139.6, 135.5, 132.7, 132.54, 130.3, 130.3, 128.3, 128.1, 128.1, 127.8, 127.5, 117.4~91.6(m), 114.2, 100.3, 48.4, 37.2(t, J = 19.8 Hz), 31.0, 21.8, 20.6;19F NMR(376 MHz, CDCl3), δ:-80.8(t, J = 9.8 Hz, 3F), -107.5~-108.3(m, 1F), -114.1(d, JF-F = 266.8 Hz, 1F), -121.5(br, 2F), -122.0(br, 4F), -122.8(br, 2F), -124.2(br, 2F), -126.1(br, 2F); HRMS m/z (ESI)计算值C28H19F17INNaO [M+Na]+858.0132, 实测值858.0136。
淡黄色固体3l 产率74%; mp 133.6~134.7 ℃;1H NMR (400 MHz, CDCl3), δ:7.68(s, 1H), 7.37~7.33(m, 4H), 7.28~7.21(m, 1H), 7.23 (dd, J = 8.0, 1.2 Hz, 1H), 6.95(d, J = 8.4Hz, 1H), 3.41(s, 3H), 2.41(s, 3H), 2.29~2.16(m, 1H), 1.97~1.84(m, 1H), 1.14(s, 3H);13C NMR(100 MHz, CDCl3), δ:169.8, 146.5, 139.6, 135.5, 132.7, 132.6, 130.3, 128.3, 128.1, 128.1, 127.8, 127.5, 118.3~107.2(m), 114.2, 100.3, 48.4, 37.2(t, J = 19.5 Hz), 31.0, 21.8, 20.6;19F NMR (376 MHz, CDCl3), δ:-80.8(t, JF-F = 9.8 Hz, 3F), -107.5~ -108.3(m, 1F), -114.1(d, JF-F = 267.3 Hz, 1F), -121.7(br, 10F), -122.7(br, 2F), -124.2(br, 2F), -126.2(br, 2F); HRMS m/z (ESI)计算值C30H19F21INNaO[M+Na]+ 958.0068, 实测值958.0065。
淡黄色固体3m 产率66%; mp 131.8~133.0 ℃;1H NMR (400 MHz, CDCl3), δ:7.86(t, J = 2.2 Hz, 1H), 7.40 (dd, J = 8.8, 2.4 Hz, 1H), 7.36~7.32(m, 4H), 7.31~7.29(m, 1H), 7.00(d, J = 8.8 Hz, 1H), 3.42(s, 3H), 2.27~2.14(m, 1H), 2.01~1.87(m, 1H), 1.14(s, 3H);13C NMR(100 MHz, CDCl3), δ:167.0, 142.2, 138.0, 134.2, 131.9, 129.8, 128.9, 128.6, 128.5, 128.4, 128.0, 127.2, 123.1, 122.1, 120.7~103.1(m), 114.4, 48.3, 36.6(t, J = 20.4 Hz), 31.1, 21.8;19F NMR (376 MHz, CDCl3), δ:-80.7~-80.8(m, 3F), -107.8~-108.8(m, 1F), -114.2(d, JF-F = 267.0 Hz, 1F), -121.7(br, 2F), -122.9(br, 2F), -124.2(br, 2F), -126.1~-126.3(m, 2F); HRMS m/z (ESI)计算值C25H17BrF13NNaO [M+Na]+696.0179, 实测值696.0184。
淡黄色固体3n 产率62%; mp 138.7~139.9 ℃;1H NMR (400 MHz, CDCl3), δ:7.70(s, 1H), 7.40~ 7.36(m, 5H), 7.22 (dd, J = 8.4, 1.6 Hz, 1H), 6.97(d, J = 8.0 Hz, 1H), 3.41(s, 3H), 2.41(s, 3H), 2.30~ 2.17(m, 1H), 1.90(m, 1H), 1.12(s, 3H);13C NMR(100 MHz, CDCl3), δ:169.8, 142.3, 135.6, 134.5, 132.8, 132.2, 130.2, 128.9, 128.6, 128.5, 128.3, 127.9, 127.1, 121.8, 120.4~103.0(m), 114.3, 48.3, 36.7(t, J = 19.6 Hz), 31.1, 21.7, 20.7;19F NMR(376 MHz, CDCl3), δ:-80.7~-80.8(m, 3F), -107.8~-108.5(m, 1F), -114.0(d, JF-F = 267.0 Hz, 1F), -121.8(br, 2F), -122.9(br, 2F), -124.2(br, 2F), -126.1~-126.3(m, 2F); HRMS m/z (ESI)计算值C26H19BrF13NNaO [M+Na]+710.0335, 实测值710.0332。
淡黄色固体3o 产率71%; mp 147.2~149.0 ℃;1H NMR(400 MHz, CDCl3), δ:7.94(d, J = 8Hz, 1H), 7.49(d, J = 6.4Hz, 1H), 7.43~7.40(m, 1H), 7.38~7.36(m, 4H), 7.20(td, J = 7.6, 0.8Hz, 1H), 7.07(d, J = 8Hz, 1H), 4.21 (q, J = 7.2Hz, 2H), 3.41(s, 3H), 2.27~2.068(m, 2H), 1.27(t, J = 7.2 Hz, 3H), 1.06(s, 3H);13C NMR(100 MHz, CDCl3), δ:170.3, 163.5(t, J = 32.4 Hz), 142.4, 138.1, 134.8, 132.1, 129.6, 128.9, 128.6, 128.2, 127.9, 127.3, 123.0, 121.9, 115.6(t, J = 249.8 Hz), 114.3, 63.1, 48.5, 40.5(t, J = 22.1 Hz), 31.0, 21.6, 13.8;19F NMR(376 MHz, CDCl3), δ:-100.3(d, JF-F = 264.8 Hz, 1F), -103.7(d, JF-F = 264.6 Hz, 1F); HRMS m/z (ESI)计算值C23H22BrF2NNaO3[M+Na]+500.0644, 实测值500.0646。
淡黄色固体3p 产率65%; mp 188.4~189.2 ℃;1H NMR (400 MHz, CDCl3), δ:7.74(s, 1H), 7.47(d, J = 6.0 Hz, 1H), 7.39~7.32(m, 4H), 7.21(dd, J = 8.4, 1.6 Hz, 1H), 6.95(d, J = 8.4 Hz, 1H), 4.21(q, J = 7.2 Hz, 2H), 3.39(s, 3H), 2.42(s, 3H), 2.28~2.14(m, 1H), 2.13~2.04(m, 1H), 1.27(t, J = 7.2 Hz, 3H), 1.04(s, 3H);13C NMR(100 MHz, CDCl3), δ:170.2, 163.6(t, J = 35.6 Hz), 142.5, 135.7, 135.1, 132.5, 130.1, 128.9, 128.5, 128.2, 127.8, 127.1, 121.7, 115.6(t, J = 254.3 Hz), 114.2, 100.0, 63.0, 48.5, 40.5(t, J = 22.3 Hz), 31.0, 21.6, 20.9, 13.8;19F NMR(376 MHz, CDCl3), δ:-100.3(d, JF-F = 264.6 Hz, 1F), -103.7(d, JF-F = 264.4 Hz, 1F); HRMS m/z (ESI)计算值C24H24BrF2NnaO3[M+Na]+ 514.0800, 实测值514.0801。
最佳反应条件筛选以化合物1a与全氟己基碘(2a)的加成环化反应为模板反应来探索最佳反应条件。 在筛选各种反应参数后,最终表明化合物1a(0.3 mmol)与全氟己基碘2a(0.6 mmol), fac-Ir( ppy)3(摩尔分数1%),K3PO4(2倍化学计量),1,4-二氧六环作为溶剂,在室温条件下反应24 h,得到所需产物3a,产率85%。 控制实验发现几种典型的光催化剂,如Mes-Acr+ClO-4、Ru(bpy)3Cl2、[Ir(dtppy)(ppy)2]PF6、Eosin Y和PTH,其催化效果明显不如 fac-Ir( ppy)3(entries 1-6)。 此外,还考察了碱对反应的影响,结果表明,K3PO4的催化效果最佳(Entry 7)。 还考察了其它无机碱的催化效果,如K2CO3、KOAc、Na2CO3。 此外,还探究了有机碱如三乙胺,DABCO(1,4-二氮杂二环〔2.2.2〕辛烷)的促进作用实验表明,这些碱的使用效果均不如K3PO4(Entries 7-11)。 我们猜测,K3PO4在反应中可能促进全氟己基碘脱碘形成全氟己基自由基,从而有利用反应的进行(这将在机理部分进行讨论)。 溶剂筛选发现,在DMF、CH3CN、THF、甲苯等溶剂中、二氧六环为溶剂时反应效果最佳(Entries 12-15)。 其次,考察了另外两个控制实验(Entries 16-17),结果表明撤去光催化剂或者暗室反应条件下,此ATRA/环化反应几乎不能发生。
综上所述,最佳反应条件为: N-甲基- N-(2-(苯基乙炔基)苯基)丙烯酰胺1a(0.3 mmol)与全氟己基碘2a(0.6 mmol), fac-Ir( ppy)3(摩尔分数1%),K3PO4(2倍化学计量),1,4-二氧六环为溶剂,在N2保护条件下, 5 W LED 蓝光灯照射下,室温反应 24 h。
根据最佳反应条件,进一步探究了其反应底物的适用范围(Scheme 2)。 在优化条件下,在 N-原子或芳环上带有各种取代基的苯桥联1,7-烯炔具有良好的兼容性,合成一系列的2,4-二氢喹啉-2(1 H)-酮类化合物,且在远端同时引入 n-C6F13和碘原子两个官能基团(产物3a-3d)。 此外,发现在远端同时引入 n-C3F7(异)和碘原子时,反应效率将会下降(产物3e-3g)。 目前此串联ATRA/环合反应所合成产物4-二氢喹啉-2(1 H)-酮具有优秀的的E-构象选择性,其 E/Z立体选择性通常大于20:1。 接着,我们还对其它全氟烷基碘在此串联ATRA/环化反应中的兼容情况进行了考察,结果表明多种全氟烷基碘(包括 n-C6F13I、 n-C8F17I、 n-C10F21I等)在此反应中具有良好的反应效果,顺利制备一系列全氟化2,4-二氢喹啉-2(1 H)-酮衍生物(产物3h-3l)。 此外,还探究若干相对惰性的氟烷基溴化物在此光诱导下的ATRA/环化中表现,结果表明K3PO4的使用对反应可能存在有一定抑制效应,在撤掉K3PO4后,多种全氟,二氟烷基溴化物(如C6F13Br,BrCF2CO2Et等)能有效地参与反应,从而转化为相应的溴代二氢喹啉-2(1 H)-酮。同时也具有优异的 E/Z选择性,只是产率略微下降(产品3m-3p)。
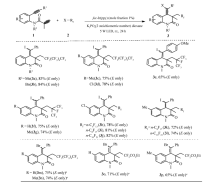 | Scheme 2 Substrate scope in the ATRA/cyclization of 1,7-enyen with perfloroalkyl iodides/bromides aWithout the use of K3PO4 |
表1 化合物3a优化反应条件摸索 Table 1 Optimization of reaction conditions for compound 3a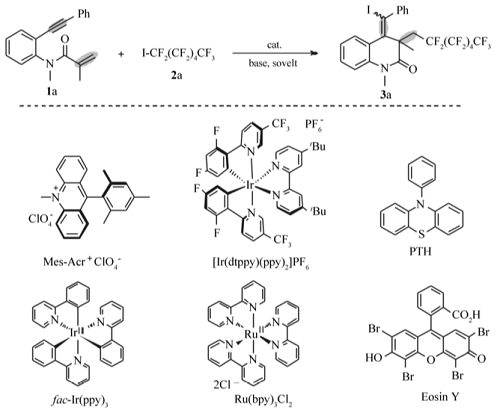 |
为了探测反应机理,设计并进行了一组控制试验(Scheme 3) 。控制实验结果显示在反应加入过量自由基清除剂TMEPO,此环化反应被严重抑制,此现象表明此反应可能经历了一个自由历程。
基于上述实验结果及文献报道,我们提出了一种可能的反应机理过程[2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18],如Scheme 4所示。 首先,在光照射下,催化剂[ fac-Ir(Ⅲ)(ppy)3]被激发为[ fac-Ir(Ⅲ)(ppy)3*],经CF3(CF2)4CF2-I氧化猝灭,形成 n-C6F13·自由基和碘负离子,同时生成[ fac-Ir(IV)(ppy)3]配合物。 接下来, n-C6F13·自由基对1,7-烯炔(1a)的C=C键上进行自由基加成,生成烷基自由基B,然后再对邻近C—C上进行自由加成,生成具有 E构象选择性的中间体C。 我们推测,可能由于中间体C双键末端位苯环与邻近的刚性芳环位阻排斥效应,因此更有利于形成基于位阻较小的中间体C ,而不是位阻位阻排斥较大的C'。 然后,上述当场形成的碘负离子随后被[ fac-Ir(IV)(ppy)3]氧化成碘自由基I·[17],并生成[ fac-Ir(III)(ppy)3]。 最后,自由基中间体C与碘自由基结合或者攻击 n-C6F13-I,得到目标产物3a,且其立体选择性优先为 E构型。 此外,另一种碱促进自由基反应历程也不能排除,这种可能性对K3PO4的使用可促进此ATRA/环化得到较好的印证。 值得指出的是,碱催化的方法可能不适合于全氟烷基溴化物的反应,因为K3PO4不容易介导未活化的全氟烷基溴化物有效均裂,导致形成的全氟烷基自由基通常是低效的,因此当此环化反应在涉及全氟烷基溴化物时,碱的使用反而起某种程度的抑制效应(产物3m-3p)。
发展了一种可见光诱导的1,7-烯炔与全氟烷基卤串联原子转移自由基加成(ATRA)/环化合成含氟2,4-二氢异喹啉-2(1 H)-酮的方法。 此方法以多氟烷基碘或溴为自由基前体, fac-Ir(ppy)3(摩尔分数1%)为光敏剂,在5 W 蓝光LED照射下,多种苯桥联1,7-烯炔顺利发生串联ATRA/环化反应,合成了一系列的含氟2,4-二氢异喹啉-2(1 H)-酮的衍生物。 此反应实现了1,7-烯炔与全氟烷基卤的ATARA环合,成功将全(多)氟烷基基团引入到了异喹啉分子骨架中。 此外,该反应条件温和、清洁、高效,为具有潜在药用价值的多氟化2,4-二氢异喹啉-2(1 H)-酮的合成提供一条新的途径。
辅助材料(Supporting Information)[目标产物的NMR数据及化合物3a单晶结构示意图]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|