水稻是我国重要的粮食作物,但杂草对水稻的产量和品质产生了严重影响。 化学防除是治理水稻田杂草最有效的途径。 文中设计合成了苯环2,6-取代和2,5-取代两个系列磺酰脲类化合物,并通过核磁共振波谱仪(NMR)和高分辨质谱仪(HRMS)等对其进行了结构表征。 通过水稻田除草活性和安全性测试发现化合物在水稻田中具有较好的除草活性,尤其是化合物10a对水稻田中的主要杂草稗草和醴肠除草活性(目测初筛防效大于90%)优于对照药醚苯磺隆和氯磺隆,安全性与之相当。
Rice is one of the most important food crops in China, but weeds therein have serious adverse effects on rice yield and quality. The use of chemical herbicides is the most effective way to control weeds in rice field. Two series of novel sulfonylurea compounds, 2,5-substituted and 2,6-substituted benzenes, were designed and synthesized with their structures characterized by nuclear magnetic resonance spectroscopy (NMR) and high-resolution mass spectrometry (HRMS). The herbicidal activity and crop safety tests of rice field showed that most of the new molecules showed good herbicidal activity in rice field, especially compound 10a has shown better herbicidal activity (the visual control effect of preliminary screening is more than 90%) toward the main weeds Echinochloa crusgalli and Eclipta prostratethan than that of ethersulfuron-methyl and chlorsulfuron as controls. The herbicidal crop safety of compound 10a is comparable to that of the controls.
水稻作为中国三大粮食作物之一,在全国的种植面积约3000公顷,稻米产量约2.1亿吨,占我国粮食总产量的三分之一,是中国65%的人口的主要口粮[1]。 水稻在国民经济中占据重要位置,但是杂草却严重影响着水稻的产量和品质。 水稻田杂草主要有:稗草( Echinochloa crusgalli)、醴肠( Eclipta prostrate)、马唐( Digitaria sanguinalis)、反枝苋( Amaranthus retroflexus)、马齿苋( Portulaca oleracea)和千金子( Euphorbia lathyris)等。 据统计,每年因杂草造成的水稻产量损失约1000万吨[1,2]。
作为水稻田除草剂的磺酰脲类除草剂,主要有吡嘧磺隆(Pyrazosulfuron-ethyl)、苄嘧磺隆(Bensulfuron methyl)和醚苯磺隆(Triasulfuron)等,该类除草剂的靶标为乙酰乳酸合成酶(Acetohydroxyacid synthase,AHAS),而该靶酶只存在于高等植物体内和菌类之中,在哺乳动物及人体内不存在,所以大部分磺酰脲类除草剂对人和哺乳动物是高度安全的[3,4]。 AHAS催化支链氨基酸缬氨酸、亮氨酸以及异亮氨酸的生物合成,该酶被抑制,3种支链氨基酸的合成受阻,进而导致无法正常合成蛋白质,最终引起植株的死亡。
磺酰脲类除草剂因其土壤中的残留药害问题,部分药物已被中国农业部所禁用,例如氯磺隆,甲磺隆和胺苯磺隆。 但该类药物在湿热及微酸性的中国浙江省水稻田中将有利于降解,再者水稻种植无轮作现象,故该类磺酰脲类除草剂在水稻田中可能仍具有高效的除草活性以及几乎无残留药害问题。 综上所述,无论从绿色高效除草方面,还是降解残留问题,对用于水稻田中的磺酰脲类除草剂的研究均具有重要的研究意义。
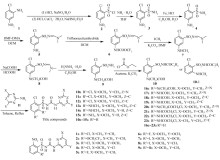
小麦、玉米和水稻同为禾本科植物,它们生长的田地中均存在杂草稗草。 在本课题组前期工作中所合成的化合物2a(Scheme 1),在小麦和玉米田中对稗草具有高效的除草活性[5],同时稗草又是水稻田中的主要杂草,并且已经出现对吡嘧磺隆和苄嘧磺隆等磺酰脲类除草剂的抗药性问题。 本文希望所涉及的化合物在小麦和玉米田中对稗草具有高效除草活性的同时,也在水稻田中仍具有高效除草活性,尤其对稗草的除草活性。 本文所涉及的化合物除有课题组在前期工作中合成的部分在小麦和玉米田中对稗草具有高效除草活性的化合物1a-9a(Scheme 1),还有据此所设计合成的两类新化合物:苯环2,5-取代和苯环2,6-取代的磺酰脲类化合物,其中11a、13a-23a(Scheme 1)为新化合物。
还原性铁粉、无水碳酸钾和亚硫酸氢钠购自天津市化学试剂供销公司;亚硝酸钠购自天津市北联精细化学品开发有限公司;二水合氯化铜购自天津市永大化学试剂有限公司;甲酸钠购自天津市化学试剂一厂;无水甲酸购自天津市光复精细化工研究所;以上试剂纯度为分析纯;硅胶(粒径48~75 μm)购自青岛海洋化工厂分厂。
Bruker Avance-400MHz型核磁共振仪器(NMR,瑞士Bruker公司);X-4型数字显示双目显微镜熔点测定仪(北京泰克仪器有限公司);Agilent 6520 Q-TOF LC/MS型高分辨质谱仪(HRMS,美国Agilent公司)。
化合物10a-23a的合成(Scheme 1)以化合物14a和16a为例进行说明,2-氯-5硝基苯胺(1)为起始原料,化合物2[6]、化合物3[7]、化合物4[8]、化合物5[9]、化合物6[10]、化合物7[10]、化合物8[11]、化合物9[9]和化合物10[12]可按照文献[6,7,8,9,10,11,12]中的方法来合成,化合物10-1的合成方法与化合物10相同。
化合物8[11] 将化合物7(2.29 mmol,0.6 g)置于3 mL甲酸中,加入甲酸钠(4.58 mmol,0.31 g),80 ℃加热反应,TLC监测反应,待反应结束后,降至室温,加20 mL水,体系有白色固体析出,继续搅拌1 h,抽滤,收集固体即为目标化合物8,干燥,得0.45 g,收率88%。
化合物16a 取化合物10(0.5 mmol,0.15 g),置于5 mL甲苯中,加入化合物11(0.75 mmol,0.1 g),加热回流,TLC监测,减压浓缩,快速柱层析纯化,甲醇:二氯甲烷(体积比1:40),得化合物16a(0.375 mmol,0.15 g)收率75%[13]。同理可得化合物14a、17a和18a-23a。
化合物10a-13a、15a 参考化合物14a和16a的合成方法可得化合物10a-13a、15a。
在本课题组的前期工作中对化合物1a-9a的合成,及在小麦和玉米田中对稗草具有高的的除草活性已有报道[5],在此不再详述。
N-(2-(4-甲氧基-6-甲基)三嗪基)-2, 6-二氯苯磺酰脲(10a) 白色固体; mp 168~170 ℃;1H NMR(400 MHz, acetone- d6), δ:13.16(s, 1H, SO2NHCONH), 9.91(s, 1H, SO2NHCONH), 7.72~7.66(m, 3H, Ph— 3H), 4.05(s, 3H, COCH3), 2.54(s, 3H, CH3);13C NMR(101 MHz, DMSO), δ:178.79, 170.59, 164.26, 148.96, 135.28, 135.03, 132.49, 131.96, 55.78, 25.60; HR-ESI/MS( m/z)[M+H]+ = 391.9987, 实测值391.9978。
N-(2-(4, 6-二甲氧基)嘧啶基)-2, 6-二氯苯磺酰脲(11a) 白色固体; mp 183~185 ℃;1H NMR(400 MHz, CDCl3), δ:13.07(s, 1H, SO2NHCONH), 7.51(s, 1H, SO2NHCONH), 7.51(s, 1H, Ph— H), 7.49(s, 1H, Ph— H), 7.43~7.38(m, 1H, Ph— H), 5.82(s, 1H, CCHC), 3.98(s, 6H, OCH3);13C NMR(101 MHz, CDCl3), δ:171.49, 155.24, 148.71, 136.14, 133.95, 133.38, 131.66, 85.45, 54.93; HR-ESI/MS( m/z)[M+H]+ = 406.9984, 实测值406.9982。
N-(2-(4, 6-二甲基)嘧啶基))-2, 6-二氯苯磺酰脲(12a) 白色固体; mp 200~202 ℃;1H NMR(400 MHz, acetone- d6), δ:13.80(s, 1H, SO2NHCONH), 9.42(s, 1H, SO2NHCONH), 7.74~7.51(m, 3H, Ph— H), 7.03(s, 1H, C = CH— CH), 2.47(s, 6H, CH3);13C NMR(101 MHz, DMSO), δ:168.28, 156.69, 149.73, 134.97, 134.90, 132.39, 115.44, 109.20, 23.65; HR-ESI/MS( m/z)[M+H]+ = 375.0085, 实测值375.0078。
N-(2-(4, 6-二甲氧基)嘧啶基)-2-氯-6-甲氨基苯磺酰脲(13a) 白色固体; mp 148~150 ℃;1H NMR(400 MHz, CDCl3), δ:12.75(s, 1H, SO2NHCONH), 9.50(s, 1H, SO2NHCONH), 7.91(dd, J = 8.1, 1.2 Hz, 1H, Ph— H), 7.52(dd, J = 7.8, 1.2 Hz, 1H, Ph— H), 6.91 (t, J = 8.0 Hz, 1H, Ph— H), 5.79(s, 1H, C = CH— CH), 5.64(s, 1H, NHCH3), 3.95(s, 6H, OCH3), 3.08(s, 3H, NCH3);13C NMR(101 MHz, CDCl3), δ:171.43, 156.36, 149.20, 147.06, 137.14, 135.61, 130.20, 128.49, 126.42, 103.60, 54.50, 35.00; HR-ESI/MS( m/z)[M+H]+ = 402.0639, 实测值402.0630。
N-(2-(4-甲氧基)嘧啶基)-2-氯-6-甲氨基苯磺酰脲(14a) 白色固体; mp 142~144 ℃;1H NMR(400 MHz, CDCl3), δ:12.91(s, 1H, SO2NHCONH), 8.25(d, J = 5.9 Hz, 1H, SO2NHCONH), 7.94(d, J = 8.0 Hz, 1H, N = CHCH), 7.52(d, J = 7.7 Hz, 1H, Ph— H), 6.91(t, J = 8.0 Hz, 1H, Ph— H), 6.47(d, J = 6.0 Hz, 1H, NCHCH), 5.80(d, J = 6.2 Hz, 1H, C = CH— CH), 5.64(s, 1H, NHCH3), 3.97(s, 3H, OCH3), 3.08(s, 3H, Ph— H);13C NMR(101 MHz, CDCl3), δ:171.32, 155.31, 148.96, 147.20, 137.24, 130.12, 128.40, 126.51, 120.95, 119.98, 85.24, 54.78, 35.08; HR-ESI/MS( m/z)[M+H]+ = 372.0533, 实测值372.0522。
N-(2-(4-甲氧基)嘧啶基)-2-氯-6-氨基苯磺酰脲(15a) 白色固体; mp 150~152 ℃;1H NMR(400 MHz, acetone- d6), δ:13.13(s, 1H, SO2NHCONH), 9.45(s, 1H, SO2NHCONH), 8.41(d, J = 5.6 Hz, 1H, N = CHCH), 7.20 (t, J = 8.1 Hz, 1H, Ph— H), 6.87(d, J = 8.7 Hz, 1H, Ph— H), 6.69(d, J = 7.6 Hz, 1H, Ph— H), 6.61(d, J = 6.2 Hz, 1H, NCHCH), 6.51(s, 2H, NH2), 3.98(s, 3H, OCH3);13C NMR(101 MHz, DMSO), δ:170.33, 156.92, 151.78, 132.43, 118.15, 117.58, 114.97, 103.13, 100.16, 99.23, 90.46, 54.67; HR-ESI/MS( m/z)[M+H]+ = 358.0377, 实测值358.0365。
N-(2-(4-甲氧基-6-甲基)三嗪基)-2-氯-5-( N-甲基甲酰胺)苯磺酰脲(16a) 色固体; mp 181~183 ℃;1H NMR(400 MHz, acetone- d6), δ:12.85(s, 1H, SO2NHCONH), 9.76(s, 1H, NCOH), 7.43(s, 1H, SO2NHCONH), 7.32(d, J = 8.8 Hz, 1H, Ph— H), 6.85(d, J = 6.5 Hz, 1H, Ph— H), 5.76(s, 1H, Ph— H), 4.03(s, 3H, OCH3), 2.85(s, 3H, NCH3), 2.51(s, 3H, CH3);13C NMR(101 MHz, MeOD), δ:178.70, 172.16, 149.04, 147.48, 136.61, 133.61, 131.77, 116.91, 115.92, 114.65, 114.58, 54.74, 28.78, 23.81; HR-ESI/MS( m/z)[M+H]+ = 415.0591, 实测值415.0583。
N-(2-(4-甲氧基-6-甲基)三嗪基)-2-氯-5-甲酰胺苯磺酰脲(17a) 白色固体; mp 142~144 ℃;1H NMR(400 MHz, acetone- d6), δ:13.03(s, 1H, SO2NHCONH), 9.85(s, 1H, NHCOH), 9.73(s, 1H, SO2NHCONH), 8.51(s, 1H, Ph— H), 8.50(s, 1H, NHCOH), 8.18~8.11(dd, 1H, Ph— H), 7.63(d, J = 8.6 Hz, 1H, Ph— H), 4.05(s, 3H, OCH3), 2.54(s, 3H, CH3);13C NMR(101 MHz, DMSO), δ:178.83, 170.54, 164.34, 149.28, 148.56, 132.64, 132.19, 116.78, 115.33, 114.82, 112.07, 55.69, 25.64; HR-ESI/MS( m/z)[M+H]+ = 401.0435, 实测值401.0425。
N-(2-(4, 6-二甲氧基)嘧啶基)-2-氯-5-甲酰胺苯磺酰脲(18a) 淡黄色固体; mp 208~210 ℃;1H NMR(400 MHz, acetone- d6), δ:13.12(s, 1H, SO2NHCONH), 9.72(s, 1H, NHCOH), 9.53(s, 1H, SO2NHCONH), 8.51(d, J = 2.5 Hz, 1H, Ph— H), 8.50(s, 1H, NHCOH), 8.14(dd, J = 8.7, 2.6 Hz, 1H, Ph— H), 7.63(d, J = 8.7 Hz, 1H, Ph— H), 5.91(s, 1H, CH = COCH3), 3.99(s, 6H, OCH3);13C NMR(101 MHz, DMSO), δ:170.07, 159.19, 154.78, 147.22, 136.42, 134.93, 131.33, 123.97, 122.88, 121.20, 82.86, 53.62; HR-ESI/MS( m/z)[M+H]+ = 416.0432, 实测值416.0425。
N-(2-(4, 6-二甲基)嘧啶基)-2-氯-5-甲酰胺苯磺酰脲(19a) 白色固体; mp 140~142 ℃;1H NMR(400 MHz, acetone- d6), δ:13.68(s, 1H, SO2NHCONH), 9.72(s, 1H, NHCOH), 9.37(s, 1H, SO2NHCONH), 8.49(s, 1H, NHCOH), 8.48(d, J = 2.5 Hz, 1H, Ph— H), 8.14(dd, J = 8.7, 2.5 Hz, 1H, Ph— H), 7.60(d, J = 8.7 Hz, 1H, Ph— H), 7.03(s, 1H, C = CH), 2.47(s, 6H, CH3);13C NMR(101 MHz, DMSO), δ:168.30, 160.66, 156.77, 138.00, 132.70, 125.50, 124.76, 122.34, 120.09, 115.54, 109.28, 23.71; HR-ESI/MS( m/z)[M+H]+ = 384.0533, 实测值384.0534。
N-(2-(4-甲氧基-6-甲基)三嗪基)-2-氯-5-( N-甲基氯乙酰胺)苯磺酰脲(20a) 淡黄固体; mp163~165 ℃;1H NMR(400 MHz, acetone- d6), δ:13.07(s, 1H, SO2NHCONH), 9.84(s, 1H, SO2NHCONH), 8.23(s, 1H, Ph— H), 7.79(d, J = 9.7 Hz, 2H, Ph— H), 4.04(s, 3H, OCH3), 3.36(s, 2H, COCH2Cl), 2.84(s, 3H NCH3), 2.53(s, 3H, CH3);13C NMR(101 MHz, acetone- d6), δ:179.77, 171.68, 165.15, 164.26, 164.06, 160.25, 157.62, 149.14, 146.20, 110.93, 100.92, 55.88, 42.92, 37.93, 25.49; HR-ESI/MS( m/z)[M+H]+ = 463.0358, 实测值463.0351。
N-(2-(4-甲氧基-6-甲基)三嗪基)-2-氯-5-氯乙酰胺苯磺酰脲(21a) 白色固体; mp 158~160 ℃;1H NMR(400 MHz, acetone- d6), δ:12.96(s, 1H, SO2NHCONH), 9.90(s, 1H, SO2NHCONH ), 9.85(s, 1H, CONH), 8.47(d, J = 2.5 Hz, 1H, Ph— H), 8.16 ((dd, J = 8.7, 2.5 Hz, 1H, Ph— H), 7.63(d, J = 8.7 Hz, 1H, Ph— H), 4.34(s, 2H, CONHCH2Cl), 4.05(s, 3H, OCH3), 2.21 - 2.02(m, 3H, CH3);13C NMR(101 MHz, acetone- d6), δ:178.84, 170.76, 165.14, 164.24, 148.12, 137.87, 136.71, 132.22, 125.45, 125.38, 123.36, 54.97, 43.11, 24.59; HR-ESI/MS( m/z)[M+H]+ = 449.0202, 实测值449.0191。
N-(2-(4, 6-二甲氧基)嘧啶基)-2-氯-5-氯乙酰胺苯磺酰脲(22a) 白色固体; mp 179~181 ℃;1H NMR(400 MHz, acetone- d6), δ:13.12(s, 1H, SO2NHCONH), 9.89(s, 1H, NHCOCH2Cl), 9.51(s, 1H, SO2NHCONH), 8.48(s, 1H, Ph— H), 8.16(d, J = 7.0 Hz, 1H, Ph— H), 7.64(d, J = 8.7 Hz, 1H, Ph— H), 5.91(s, 1H, C = CHCH), 4.34(s, 2H, COCH2Cl), 3.99(s, 6H, OCH3);13C NMR(101 MHz, acetone- d6), δ:171.66, 165.12, 156.28, 148.32, 137.87, 136.83, 132.17, 130.11, 125.35, 123.52, 84.23, 54.34, 43.11; HR-ESI/MS( m/z)[M+H]+ = 464.0198, 实测值464.0185。
N-(2-(4, 6-二甲基)嘧啶基)-2-氯-5-氯乙酰胺苯磺酰脲(23a) 白色固体; mp 171~173 ℃;1H NMR(400 MHz, acetone- d6), δ:13.69(s, 1H, SO2NHCONH), 9.91(s, 1H, NHCOCH2Cl), 9.37(s, 1H, SO2NHCONH), 8.44(d, J = 2.2 Hz, 1H, Ph— H), 8.17(dd, J = 8.7, 2.5 Hz, 1H, Ph— H), 7.61 (t, J = 8.2 Hz, 1H, Ph— H), 7.03(s, 1H, CCHC), 4.34(s, 2H, NHCOCH2Cl), 2.47(s, 6H, CH3);13C NMR(101 MHz, DMSO), δ:168.29, 165.83, 156.83, 149.36, 138.28, 136.83, 132.93, 125.45, 124.55, 122.82, 115.46, 43.98, 23.67; HR-ESI/MS( m/z)[M+H]+ = 432.0300, 实测值432.0289。
化合物1的重氮化反应要求浓酸溶剂,保持低温环境,否则在加入亚硝酸钠生成重氮盐后重氮基团会转化生成氮气,导致产率降低。 体系不宜搅动过快,亚硝酸钠1.1倍化学计量为宜,否则会有偶氮化合物的生成。 中间体3硝基的还原不可采用钯碳氢气来还原,否则会得到苯环2位氯原子也被还原的副产物。 中间体5氨基的酰基化过程中,选择DMF-DMA进行磺酰胺的保护,原因是磺酰胺基的反应活泼性远大于苯胺,在烷基化过程中首先是磺酰胺基进行反应。 因此,为了避免该类副产物的生成,需要对磺酰胺基进行保护,烷基化结束后用水合肼脱除保护基团。 中间体5(7)氨基的甲酰基化根据参考文献[11]中的方法(氨、甲酸和甲酸钠的加入量分别为1、4和0.2 mol),室温反应10 h,不能转化完全。 需以少量甲酸为溶剂,2倍化学计量甲酸钠,80 ℃,在1 h可转化完全,加水析出白色固体。
通过1H NMR和13C NMR表征了产物的结构。 以化合物21a的1H NMR数据为例说明: 13.12为磺酰脲桥上的活泼氢的峰(SO2NHCONH),9.90为磺酰脲桥SO2NHCONH上的第2个活泼氢的峰,9.85为苯环5位酰胺活泼氢的峰(NHCOCH2Cl)8.47,8.16,7.63(Ph—H)为3个苯环上的氢(Ph—H),分别以典型的d、dd、d峰的形式存在,相对应的耦合常数分别为: J=2.5 Hz; J=8.7,2.5 Hz; J=8.7 Hz。 4.34为氯亚甲基氢峰(CONHCH2Cl),4.05 为三嗪杂环甲氧基氢峰(OCH3)),2.21~2.02为三嗪杂环甲基氢峰(CH3)。
以化合物21a的13C NMR数据为例说明:脂肪族共有3组碳峰,分别为三嗪环上的甲基碳峰(24.59),甲氧基上的碳峰(54.97),以及氯亚甲基碳峰(43.11)。 芳香族包括苯环上的6个碳峰,三嗪环上的3个碳峰(165.14,164.24,148.12,137.87,136.71,132.22,125.45,125.38,123.36)脲桥碳峰(178.84),酰胺基碳峰(170.76)。
表1中为所有化合物在水稻田中除草活性的普筛结果。 筛选条件与结果:在杂草2~4叶期,150 g a.i.·ha-1(有效成分为150 g·ha-1),通过茎叶喷雾,药后21 d目测防效,结果显示全部化合物均具有高效除草活性,化合物14a和15a虽然对反枝苋、鱧肠和马齿苋双子叶杂草展现了高效的除草活性,尤其对反齿苋的除草活性分别达到了90%和98%,与对照药Chlorsulfuron相当,但对稗草、马唐和千金子单子叶杂草除草活性较差,故化合物14a和15a仍被淘汰。化合物1a-13a、16a-23a对稗草、马唐、千金子、反枝苋、马齿苋和鳢肠的除草活性,均与对照药Chlorsulfuron相当。 这对于除草活性进一步筛选创造了良好的前提条件。
| 表1 化合物在水稻田中除草活性普筛 Table 1 General screening of herbicidal activity of compounds in rice fields |
表2为化合物在水稻田中除草活性的初筛结果。 筛选条件与复筛结果:杂草2叶期,在不同浓度(3.75、7.5、15 g a.i.·ha-1)下将普筛具有高效除草活性的化合物进行初筛,筛选对稗草和鱧肠的除草活性,药后14 d目测防效,结果显示化合物4a、13a、19a-23a在各浓度条件下对稗草和鱧肠的除草活性较差,故被淘汰。 综合普筛和初筛除草活性数据,发现化合物10a要优于对照药Triasulfuron和Chlorsulfuron。 化合物1a-3a、5a-12a、16a-18a的除草活与对照药相当。 初筛结果完达到了预期目标。 经过两轮除草活性的筛选,将对具有高除草活性的化合物进行安全性实验。 在除草活性普筛的过程中化合物14a和15a对双子叶杂草(反枝苋、马齿苋和醴肠)展现了良好的除草活性(60%~90%),而对单子叶杂草(稗草、马塘和千金子)几乎没有除草活性(0%~20%)。 在3个初筛剂量下化合物13a对以稗草为代表的单子叶没有除草活性(0%),而对以醴肠为代表的双子叶植物仍具有较好除草活性(65%~70%),在3个初筛剂量下化合物17a对稗草的除草活性为(75%~85%),而对醴肠的除草活性仅为10%。 由此判断化合物13a、14a、15a和17a的除草谱发生了变化。
| 表2 化合物在水稻田中除草活性初筛 Table 2 Preliminary screening of herbicidal activity of compounds in rice fields |
综合文中所涉及的化合物通过除草活性初筛,除草活性规律可总结为:当为苯环2,6-取代时,同为拉电子基取代时>一个拉电子基和一个供电子基取代时,例如3.75 g a.i.·ha-1时化合物10a对稗草的除草率为95%而化合物13a为0%;当为2,5-取代时,5位为甲酰胺基取代时>5位为氯乙酰胺基取代时,例如3.75 g a.i.·ha-1时化合物16a对稗草的除草率为85%而化合物20a为45%。 化合物17a除外,在3个初筛剂量下对醴肠的除草活性仅为10%,小于其它化合物对醴肠的除草活性。
表3为安全性实验数据结果。 实验条件:经过普筛和初筛除草活性较好的化合物,在水稻4~6叶期进行土壤处理,有效剂量30 g a.i.·ha-1,15 d后计算化合物水稻的鲜重抑制率。 结果显示所选取的化合物安全性较好,安全性处于轻微药害到很安全之间。 经普筛和初筛以及安全性试验显示:化合物1a-3a、5a、6a、8a、10a-12a和16a-18a除草活性高安全性好。 化合物10a和12a的除草性能虽有所报道[14,15],但近年来随着该类化合物残留药害问题的出现,结合中国一年多茬,休耕时间短的种植模式,以及化合物本身的化学性质(在湿热及弱酸环境中加速降解),本文对其在水稻田中的除草性能及作物安全性进行了详细研究,发现该化合物除草性能优越,安全性良好,这对发展符合中国国情的绿色高效除草剂仍具有参考意义。 尤其是化合物10a在除草活性优于对照药的同时,安全性还与对照药相当。
| 表3 化合物在水稻田中的安全性筛选 Table 3 Safety screening |
本文基于氯磺隆、甲磺隆和胺苯磺隆等在小麦、玉米等中国北方碱性旱田中存在的药害残留问题,在小麦和玉米田中的除草活性和作物安全性的基础上,又详细研究了该类化合物在中国浙江省微酸环境水稻田中的除草性能和作物安全性。 发现在中国北方所出现的药害残留问题有较大改观,化合物3a、5a、6a、8a、10a、11a、12a和16a具有高除草活性和较好的安全性,尤其是化合物10a除草活性要优于照药Triasulfuron和Chlorsulfuron,且安全性与之相当。 化合物13a、14a和15a展现了对双子叶植物醴肠、反枝苋和马齿苋选择性的高效除草活性,而化合物17a展现了对单子叶植物稗草较好的除草活性,化合物的除草谱发生了变化。 综合文中所涉及的化合物其除草活性规律如下:苯环2,6-取代(同为拉电子基)>苯环2,6-取代(一个拉电子基和一个供电子基);2,5-取代(5位甲酰胺基)>2,5-取代(5位氯乙酰胺基)。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|