本文提出了对于手性药物普萘洛尔手性识别和手性分析的新方法。 该方法引用基于氧化石墨烯的指数富集配体系统进化筛选技术(GO-SELEX),经过10轮优化筛选出对心血管药物普萘洛尔有高度亲和力的特效适配体。 然后通过共振瑞利散射光谱法(RRS)对反应体系进行特效性检测,实验表明 S-普萘洛尔和 R-普萘洛尔有迥然不同的光谱差异, S-普萘洛尔与特效适配体结合后的RRS显著增强,而 R-普萘洛尔与适配体结合后的RRS几乎没有变化。 据此可以对心血管药物手性普萘洛尔进行有效的手性识别。 在考察反应体系和实验条件的基础上,可对 S-普萘洛尔进行实验检测,同时对外消旋体中的 R-普萘洛尔进行计算分析。 实验对 S-普萘洛尔的线性范围为5~275 nmol/L,检测限为0.5 nmol/L。 方法应用于外消旋药片的分析检测,结果令人满意。 实验表明,RRS检测特效适配体结合的手性靶标体系会彰显不同的光谱差异,从而可对手性对映体进行手性识别,尤其是可利用其光谱差异实现同时测定的手性分析,方法可在特殊情形下不经分离而同时测定手性对映体,具有推广应用价值。
This paper presents a new method for chiral identification and analysis of propranolol. The method quoted the systematic evolution of ligands by exponential enrichment technique based on graphene oxide (GO-SELEX). The specific aptamer with high affinity to the cardiovascular drug propranolol was selected after ten rounds of optimization and screening. Then resonance Rayleigh scattering spectroscopy (RRS) was used to detect the specificity of the reaction system. The experiment results showed that S-propranolol and R-propranolol had utterly spectral differences. The RRS spectrum of S-propranolol combined with the specific aptamer was significantly enhanced, while the RRS spectrum of R-propranolol's was almost unchanged. Therefore, the chiral propranolol could be effectively recognized. Based on the investigation of the reaction system and experimental conditions, S-propranolol could be tested experimentally and R-propranolol in the racemate can be calculated. The linear range of S-propranolol was 5~275 nmol/L and the detection limit was 0.5 nmol/L. The method was applied to the determination of racemic tablets with satisfactory results. The RRS spectra of chiral targets system binded with specific aptamer could reveal chirality differences and the chiral recognition of chiral enantiomers can be carried out.
普萘洛尔(Propranolol,以下简称Prol )是心血管疾病的特效药,是临床上最早的非选择性 β-肾上腺素受体阻断剂,目前已被广泛应用于肿瘤的治疗[1]。 临床药品为 S型和 R型等量混合的外消旋对映体(Racemic Enantiomers),其中 S-Prol的 β受体阻断作用比 R-Prol的强100倍,而 R-Prol对钠通道有抑制作用,所以二者在治疗心律失常时有协同作用。 因此在实际应用时采用外消旋体为临床药品。 随着心血管疾病的高发和年轻化,对于Prol的检测也有了较多的相关报道[2,3,4,5,6]。 在以 S-Prol为有效成分的心血管药品中 S-Prol的含量是衡量药品质量的重要指标,人们为了建立检测 S-Prol含量的有效方法已进行了大量的工作[7,8,9]。 目前鉴别和测定 S-Prol的方法有分光光度法[10]、流动注射光化学发光法[11,12]、高效液相色谱法[13,14]和电化学分析法[15],但它们同时具有较大的局限性。 尽管这些方法提供了快速、即时的检测,但它们很大程度上依赖于昂贵的仪器,而且灵敏度不高。 因此,快速、简便、高灵敏度和高特异性的检测手性Prol的新方法备受瞩目。 尤其是不经分离而同时测定 R-Prol和 S-Prol的手性分析方法颇受青睐。
特效适配体是从高度丰富的初始文库中筛选出来的单链寡核苷酸,能与小分子、蛋白质和病原体等靶标特异结合,且亲和力高。 适配体具有靶标多样,结合能力强,稳定性高,且易于合成和修饰的特点。 SELEX技术目前广泛应用于在体外筛选适配体,筛选过程中体积小,方法简便。 目前一些针对药物、蛋白质等多种靶标的适配体已逐步被公布。 基于适配体结合的特效性,多种专一的传感检测方法已被开发出来。 但还没有用于检测手性Prol的适配体及其特异方法的报道。
近年来,基于共振瑞利散射法(RRS)的检测方法已被广泛应用于药物、有机物、金属离子和生命大分子的检测。 正是由于RRS结合高新技术的选择性分析的拓展,取得了较大的进展,利用其进行手性识别和手性分析的新分析方法逐渐报道出来,尤其是不经分离而同时测定手性对映对映体的分析方法具有较大进展[16,17,18,19,20,21]。 因此基于适配体特异结合的RRS进行手性药物分析的工作仍具有挑战性,为急待发展用于手性药物检测无标记的生物传感器的新技术奠定了基础。
为此,本文特别考察识别 S-Prol的单链DNA适配体的筛选和表征。 经SELEX技术的5轮正筛选得到了与 S-Prol亲和力很高的DNA即正筛产物,去除与 R-Prol亲和力较高的DNA,得到与 S-Prol的特效反筛产物DNA,即为靶标适配体(Aptamer)。 富集的DNA特效适配体再被复制、测序和鉴定。 利用RRS对反应体系微粒聚散的敏感,可表征特效适配体与手性对映体的亲和性差异,正是 S-Prol与特效适配体结合后的RRS显著增强,而 R-Prol与适配体结合后的RRS几乎没有变化,从而对优势对映体与适配体的特异结合可以进行有效的评估,并以此对手性的心血管药物Prol进行手性识别。 在优化实验条件的基础上,RRS强度的增加与 S-Prol浓度呈线性正相关,从而可对 S-Prol进行实验检测,同时对外消旋体中的 R-Prol进行计算分析,以此实现不经分离而对实际样品中的 S-Prol和 R-Prol进行同时测定。
所有高效液相色谱(HPLC)纯化的寡核苷酸由生工生物工程(上海)有限公司化学合成。 引物和初始文库如表1所示[19]。 聚合酶链式反应(PCR)产物纯化试剂盒、琼脂糖电泳胶回收试剂盒、PAGE胶回收试剂盒购自生工生物工程(上海)有限公司;Taq DNA聚合酶、DNA marker、loading buffer均购自大连宝生物公司。 普萘洛尔购自阿拉丁试剂有限公司。 氧化石墨烯购自成都有机化学有限公司。 Tris碱、氯化钠、氯化钾、氯化镁、氯化钙购自阿拉丁试剂有限公司,分析纯。 溶液由超纯水配置。 结合缓冲液5×Binding Buffer(BB:50 mmol/L Tris,750 mmol/L NaCl,50 mmol/L KCl,12.5 mmol/L MgCl2,5 mmol/L CaCl2,pH=7.4)[22],用于调控适配体与 S-Prol的结合反应的pH值。
| 表1 筛选所用的引物与初始文库 Table 1 The initial library and primers used in the assay |
F-4500型荧光分光光度仪(日本日立公司)用于记录荧光光谱(狭缝为10.0 nm);FS 5型荧光光谱仪(英国爱丁堡公司)用于记录共振瑞利散射光谱(狭缝为5.0 nm);UV-2700型紫外可见分光光度计(UV-Vis,日本岛津公司)用于记录吸收光谱;WD-9402D型PCR仪(北京六一生物科技有限公司);DYCP-31CN型琼脂糖水平电泳仪(北京六一生物科技有限公司);DYCZ-25D型双垂直电泳仪(北京六一生物科技有限公司);LRH-70型生化培养箱(上海一恒公司);THZ-300C型恒温培养摇床(上海一恒公司);Bio-Rad 2000型凝胶成像系统(美国伯乐公司);90005-02型纯水系统(美国 LABCONCO公司)。 RNA structure 6.1(美国Mathews lab公司)。
单链DNA文库包含一个由40个核苷酸组成的中心随机序列,随机序列两侧是固定的引物结合位点(5'-AGCAGCACAGAGGTCAGATG-N40-CCTATGCGTGCTACCGTGAA-3')。 引物(FAM-TT CACGGTAGCACGCATAGG)和另一引物(AGCAGCACAGAGGTCAGATG)用于PCR扩增。
1.2.1 文库预处理
使用前,ssDNA溶解于1mL 结合缓冲液在95 ℃孵育10 min,随后立即冰浴10 min,然后在室温条件下静置30 min以使其形成三级结构。
1.2.2 适配体预备物的筛选
如图1采用GO-SELEX方法对识别 S型普萘洛尔的适配体进行筛选。 以第1轮筛选为例,1 nmol 随机文库与1 mL 4 mg/mL GO悬浊液混合,振荡离心后,弃上清。 然后向沉淀中加入50 nmol的 S-Prol(32.42 μL 的0.4 mg/mL S-Prol +120 μL 5×结合缓冲液+447.58 μL灭菌水,共600 μL),振荡孵育。 再将该混合溶液于离心后,吸取结合了 S-Prol的ssDNA上清液备用。 经过凝胶电泳对扩增条件进行确认,以上清液为模板,进行PCR扩增。 所得凝胶经纯化后为下一轮ssDNA文库。
在第6轮加入反筛过程。 将第5轮产物与反向靶标 R-Prol混合震荡孵育。 在混合溶液中加入GO悬浊液使得GO充分吸附未与反向靶标结合的ssDNA。 经离心后,去除结合 R-Prol的ssDNA上清液,得到GO沉淀。 以1mL 1×BB缓冲溶液加入沉淀,离心后去除残余的反向靶标-ssDNA复合物。 然后进行正筛选过程,所取得上清液。 经过凝胶电泳对扩增条件进行确认,进行PCR扩增。所得凝胶经纯化后为下一轮ssDNA文库。
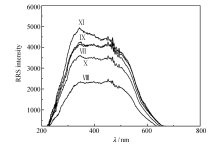
克隆和测序:经过10轮筛选,通过PCR扩增得到5轮正筛产物和5轮反筛产物,其中反筛产物为实验最终产物。 因为RRS法对于体系中微粒的聚集现象极为敏感,微粒聚集程度较高时,RRS强度很高,微粒聚集程度较低时,RRS强度很低。 由此,应用RRS光谱检测靶标和适配体的亲和力是可行的。 为了得到与靶标亲和力最强的适配体预备物混合溶液,对5轮反筛产物进行了RRS检测,所得RRS光谱谱图如图2所示,图2中标示Ⅵ、Ⅶ、Ⅷ、Ⅸ及Ⅹ的谱线为5轮反筛产物与靶标结合的RRS光谱,其中6轮反筛产物在350 nm处RRS强度最高,9轮反筛产物次之。 考虑到6轮反筛产物只进行了一轮反筛选过程,其依旧对反筛靶标 R-Prol具有一定的亲和力,因而选定9轮反筛产物为筛选最终产物即适配体预备物。
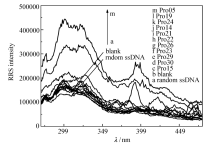
对第9轮产物进行测序,得到近4万条ssDNA序列。 经过RNA structure 6.1分析后,从所得序列中31条序列被挑选出进行RRS检测,所得RRS光谱如图3所示,在300 nm处,样品虽然均高于随机ssDNA样品和空白样品,但其中Pro05的RRS强度最高,即相同条件下,Pro05对于正筛靶标 S-Prol亲和力最强,二者结合最为紧密,因此Pro05被挑选出来作为适配体,进行后续试验。
1.2.3 光谱实验方法
在室温条件下,于2 mL 离心管中依次加入100 μL 0.1 μmol/L DNA,200 μL结合缓冲液5×Binding Buffer,定容至1 mL。 经预处理过程后,依次加入相应量的 S-Prol和 R-Prol,200 μL结合缓冲液5×Binding Buffer,定容至2 mL。 适配体与靶标振荡反应0.5 h后,开始扫描DNA-靶标复合物的RRS光谱,波长范围设在250~700 nm,狭缝为2 nm,并在其最大RRS波长处记录体系的RRS波长强度变化。 同样扫描紫外吸收光谱,波长范围设在250~700 nm,狭缝为2 nm。
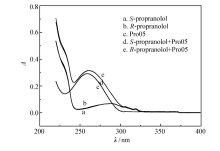
本文采用了体系的紫外可见吸收光谱来确认适配体是否能与靶标结合并产生构型变化(见图4)。 在此实验中,无适配体情况下, S-Prol和 R-Prol的最强吸收峰波长在288 nm,图4谱线a和b两条吸收谱线几乎完全重叠。图4吸收谱线c为适配体Pro05,其最强吸收峰波长在259 nm左右。 当适配体与靶标物( S-Prol和 R-Prol)结合形成适配体-靶标复合物时的最强吸收峰波长在261 nm左右,谱线明显蓝移,而图4谱线d和e,这两条吸收谱线也几近完全重叠。 从而推测, 适配体与靶标发生了结合,但尚未能说明适配体对于 S-Prol的专一性。
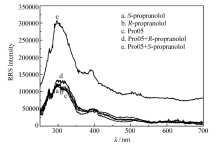
为了验证适配体对于 S-Prol的专一性和高亲和性,进行了进一步的实验。图5为不同组分的RRS光谱。可以看出 S-Prol与 R-Prol拥有近似的较低强度的RRS光谱,说明了体系中 S-Prol与 R-Prol的微粒聚集程度相近,所以光谱强度近似(见图5谱线a和b)。 适配体与反筛靶标 R-Prol的结合并未产生较大的RRS强度变化(见图5谱线d),而与正筛靶标 S-Prol的结合产生了较大的变化(见图5谱线e),RRS强度增强,这表明适配体与正筛靶标的聚集程度比反筛靶标高,即适配体与正筛靶标的亲和力高于反筛靶标。 由此,适配体对于靶标具有较高的亲和性和专一性,可用于普萘洛尔的手性识别。
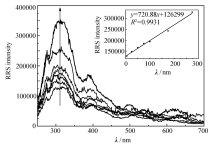
对 S-Prol的检测是基于其与特效适配体之间的特异反应和体系微粒的聚集能使共振瑞利散射光谱增强。 因此,通过配制 S-Prol系列浓度的标准溶液,按实验方法记录不同浓度的靶标与一定浓度的适配体结合的RRS光谱在 λ=300 nm处的强度,结果如图6中的插图所示,在5~275 nmol/L的 S-Prol浓度范围内,线性方程为: y=720.88 x+126299, 相关系数为: R2=0.9945,检出限为0.5 nmol/L。
在前期筛选试验基础上,为保证适配体能在最佳的条件下发挥作用,后期的光谱测量实验采用了与筛选过程相同的条件。 在筛选过程中预备物筛选部分的适配体预备物用量为100 μL 0.1 μmol/L,并已成功地筛选出了适配体Pro05,所以检测体系中的适配体用量为100 μL 0.1 μmol/L Pro05。
由于DNA为生物样品,为保证其活性,应使其所处环境pH=7.4,本文中采用的缓冲溶液为结合缓冲液5×Binding Buffer pH=7.4(50 mmol/L Tris-HCl,750 mmol/L NaCl,50 mmol/L KCl,12.5 mmol/L MgCl2 and 12.5 mmol/L CaCl2 pH=7.4)[22]。 经pH计测量,结合缓冲液5×Binding Buffer pH=7.4在稀释5倍后,pH值几乎无变化,故采用其为缓冲溶液;最佳用量为2 mL的体系中缓冲溶液用量为400 μL。
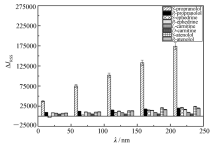
在最佳反应条件下,实验讨论了适配体-靶标体系的选择性,将不同浓度的样品和几种结构类似物分别加入体系中,再测定各体系的RRS光谱,结果如图7所示。 适配体-靶标体系中的RRS强度随浓度的增加依次增加,但同一浓度下的适配体与 S-Prol的RRS始终最强,且随浓度增加与其它靶标区别度增加。 考虑到实际样品盐酸普萘洛尔片的共存物质为淀粉等,适配体对其亲和力极低,所以共存物质对检测无干扰。 因此,共振瑞利散射法用于分析对应适配体的靶标 S-Prol具有良好的选择性,且能实现 S-Prol与 R-Prol的手性分析。
2.6.1 盐酸普萘洛药片分析
为证明创建的实验方法具有对实际样品测定的可行性。 本实验以实际药品盐酸普萘洛尔片剂为实际样品,其有效成分表示量为每片10 mg,称量50片药品质量,得到平均质量为78.5 mg每片。 取314 mg药片研磨成粉,溶解于2 mL水中,6000 r/min离心2 min后取上清液,稀释5倍作为样品。 实验样品分3份,每份取相等量(100 nmol/L 2 mL),加标均不一样。 结果如上表所示,创建的方法用于检测样品中的 S-Prol,同时可以计算分析得到外消旋普萘洛药片中的 R-Prol的含量。 结果如表2所示,药片样品中 S-Prol回收率为99.2%~103.2%,相对标准偏差RSD<5%,说明方法准确可靠。
| 表2 盐酸普萘洛药片分析结果( n=7) Table 2 Analysis of propranolol hydrochloride tablets |
2.6.2 尿样中的盐酸普萘洛药物的回收实验
为验证本实验创建的方法对实际样品测定的可靠行性。 以健康志愿者的新鲜尿液为实际样品,经1000 r/min离心15 min以去除表面不溶物,取上清液稀释1000倍后,用于加标回收试验。 在此之前,考察尿样中可能存在的共存物质和离子作抗干扰试验。 其中阳离子(Na+,K+,N
尿样的加标回收实验结果如表3所示,创建的方法用于检测样品中的 S-Prol,考虑到尿液中的共存物质例如上表中的常规金属离子、非金属离子、常见的生物大分子对本方法的检测结果影响很小,尿样中 S-Prol回收率97%~100.5%,相对标准偏差RSD<5%。
| 表3 尿样中的 S-Prol药物的回收实验( n=7) Table 3 Recovery test of S-Prol in urine samples( n=7) |
本实验通过GO-SELEX技术筛选了一种对 S-Prol具有极高亲和力和选择性的适配体,利用共振瑞利散射(RRS)光谱法可对手性药物普萘洛尔进行手性分析。 当 S-Prol和 R-Prol同时出现在反应体系中,适配体由于其特效性会与 S-Prol发生专一性结合,其RRS强度随 S-Prol浓度的增加而增强,而 R-Prol则不与适配体作用,其RRS强度没有显著变化,据此可对其外消旋体系进行手性识别。 在一定的浓度范围内RRS强度与 S-Prol的浓度呈正比,基于此建立了共振瑞利散射法检测 S-Prol含量的实用方法,同时可计算得到 R-Prol的含量。 该法可用于检测实际样品盐酸普萘洛尔片和人尿样的检测,均取得预期满意的结果。 实现了外消旋手性药物普萘洛尔的同时测定。.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|