利用恒电势法在钛丝表面原位阳极氧化组装固相微萃取(SPME)纤维,通过考察不同浓度电解质溶液和电解时间对二氧化钛纳米管(TiO2NTs)形成及尺寸的影响来确定最佳的SPME纤维的形貌。 结果表明,NH4F在水相中的质量分数为0.5%,乙二醇在水相中的体积分数为50%,氧化电势为20 V,温度为25 ℃,氧化时间30 min的条件下,得到内径为100 nm,壁厚为25 nm的有序纳米管排列。 利用组装得到的二氧化钛纳米管纤维涂层(TiO2NTs/Ti)与高效液相色谱(HPLC)联用测定水样中的多环芳烃(PAHs)。 在优化的萃取条件下,该方法灵敏度高,线性范围宽,选择性和重复性好,操作简便。 利用此方法测量了实际水样中的PAHs浓度,得到了令人满意的分析结果。
In this article, solid phase microextraction (SPME) fibers were assembled by in situ anodization on the surface of titanium wire with a constant voltage and anodization time. Effect of the electrolyte solutions of different concentrations (concentration of NH4F and ethylene glycol) and electrolysis time on the formation and size of TiO2 nanotubes (TiO2NTs) was investigated. TiO2NTs arrays were arranged with the wall thickness of 25 nm and the pore diameter of 100 nm in ethylene glycol and water (volume ratio 1:1) containing 0.5% mass fraction of NH4F at 20 V for 30 min at 25 ℃. Development of titanium dioxide nanotube array as a fiber coating for solid-phase microextraction coupled to high performance liquid chromatography for sensitive determination of polycyclic aromatic hydrocarbons (PAHs) in water. Under the optimized SPME conditions, this method has a higher sensitivity, wider linear range, better selectivity and repetition, and was easier to operate. The proposed method was successfully applied to the preconcentration and determination of target PAHs in river water and wastewater samples with satisfactory analytical results.
商品固相微萃取(SPME)涂层由于机械性能差,操作过程中易折断,增加了操作难度。 此外商品SPME涂层品种单一,应用受到限制。 为了改善或克服上述问题,在SPME纤维制备技术中,重要的一项进展就是以金属为基体,得到机械强度高和化学稳定性好的涂层,提高涂层对目标化合物的灵敏度和选择性。 自从Gong研究小组[1]报道以氟化物为电解质,在钛箔表面原位阳极氧化得到二氧化钛纳米管(TiO2NTs)结构以后,分析工作者对以TiO2纳米结构为涂层的SPME技术研究倾注了大量心血[2,3]。 目前,TiO2NTs的制备、表征和应用已引起广泛的关注[4,5,6,7],其制备方法有水热合成法、模板合成法和阳极氧化法。 阳极氧化法制备的TiO2NTs是高度有序的垂直导向阵列结构,其操作可控、结果重复性好、氧化制备过程简单。 TiO2NTs的尺寸对其性能产生重要影响。 不同的电解质溶液和不同的电解时间均会对TiO2的形貌产生影响,进而影响到TiO2的萃取效果。
多环芳烃(PAHs)是一类分布广泛的有机污染物,具有较强的致突变、致畸和致癌作用,尤其是含有4个或更多芳香环的PAHs[8,9]。 许多现代分析技术已被开发并应用于PAHs在自然环境中的监测[10]。 由于PAHs在水中的溶解度很低,导致它们在水中的浓度极低,准确测定困难,仪器分析之前必须进行样品预处理,痕量分析的样品预处理是分析过程中的瓶颈和主要误差来源。 目前,从环境样品中富集PAHs的技术有溶剂萃取[11,12]、固相萃取[13,14]、SPME[15,16]、加压液体萃取[17]和超临界流体萃取[18]等。 SPME与高效液相色谱(HPLC)联用是最常用的技术,具有制备方法简便、富集效率高和消耗时间少的特点。
钛丝(外径250 μm,纯度99.99%)购自美国Alfa Aesar公司;微孔滤膜(0.45 μm)购自上海新亚微孔滤膜公司。 甲醇(色谱纯)购自山东禹王化工分公司;氯化钠(NaCl,分析纯),氟化铵(NH4F,分析纯)和乙二醇(ethylene glycol,分析纯)均购自国药集团化学试剂标准样品:萘(Naphthalene,Nap)、芴(Fluorene,Flu)、菲(Phenanthrene,Phe)、蒽(Anthracene,Ant)、荧蒽(Fluoranthene,Flt)和芘(Pyrene,Pyr)均购自德国Aldrich,Steinheim公司。 实验用水为超纯水。
高效液相色谱仪系统:N2000型色谱工作站(浙大智达自动化工程有限公司),Waters 600型高压泵,Waters 2487型紫外-可见双波长检测器(美国Waters公司),Agilent Zorbax Eclipse Plus C18型反相色谱柱(4.6 mm×150 mm,5 μm,美国安捷龙公司),六通阀和解吸室(美国 Supelco 公司)。 WY-3D型稳压直流电源(上海科艺仪器仪表有限公司);Zeiss Ultra plus型场发射扫描电子显微镜(SEM,德国蔡司光学仪器);KQ-100B型超声清洗器(昆山超声仪器公司);SDLA-B-X型超纯水机(重庆市澳凯龙医疗器械研究有限公司);DF-101S型集热式恒温加热磁力搅拌器(郑州紫拓仪器设备有限公司)。
1.2.1 样品的制备
称取适量Nap、Flu、Phe、Ant、Flt和Pyr,用甲醇配制成100 mg/L的储备液,在4 ℃下避光保存。 实验所需不同浓度溶液按一定比例用超纯水稀释。 实际水样(自来水、河水、湖水、废水和雨水)均采自甘肃兰州不同区域,用0.45 μm微孔滤膜过滤后,储存于棕色瓶中,置于冰箱中4 ℃保存。
1.2.2 TiO2NTs纤维的组装
截取6 cm钛丝,用丙酮、乙醇和超纯水依次超声清洗。 采用二电极的直流稳压电源进行阳极氧化,钛丝为工作电极,铂为对电极,电解液为不同浓度的氟化铵和乙二醇溶液,控制电势20 V,阳极氧化一定时间后,用去离子水充分淋洗,除去表面残存的电解液,晾干后用SEM观察其微观形貌。
1.2.3 SPME-HPLC步骤和色谱条件
移取15 mL待测样于20 mL萃取瓶中,瓶中加入磁子。 SPME萃取装置由1 μL微量进样器改制而成,钛丝插入注射器不锈钢内管,刺破萃取瓶的聚四氟乙烯隔膜,将TiO2涂层用手柄推出不锈钢内管,浸入溶液中,保持恒定的温度,在磁子搅拌下进行萃取,当两相达到平衡,将萃取涂层收回到不锈钢内管,将萃取装置从萃取瓶中取出,快速插入SPME-HPLC接口解吸室静态解吸。 待有机物在解吸室内解吸,然后,六通阀切换至进样位置,依靠流动相将其带入色谱柱进行分离分析。
测定PAHs的色谱条件:流动相甲醇/水 (体积比90:10),紫外检测器波长为254 nm,流动相的流速为1 mL/min。 每次萃取前用甲醇和超纯水将萃取涂层分别清洗15和5 min以消除可能的萃取残留对下次测定结果的干扰。
2.1.1 水溶液体系
根据Macak等提出的氧化机理[19,20,21],在阳极氧化钛丝生成TiO2NTs阵列过程中,阳极氧化速率制约TiO2NTs阵列的生长形成速率,化学刻蚀速率支配TiO2NTs阵列溶解速率,这二者对TiO2NTs阵列的形貌结构起着决定性作用。 电解液的组成和浓度对TiO2NTs阵列结构有重要影响。 在以水为溶剂的电解液中,加入不同浓度的NH4F,考察阳极氧化钛丝生成TiO2的情况。
在NH4F的水溶液中,钛丝表面能较容易地被氧化为TiO2,随着NH4F浓度的增大,化学刻蚀速率远大于纳米管阵列的形成速率,从图1可以看出,当NH4F浓度增大至2.5%后,基本不能形成纳米管。
 | 图1 氟化铵水溶液中钛丝阳极氧化的SEM照片Fig.1 SEM images of Ti wires anodized in aqueous solution of NH4F w(NH4F)/%:A.0.1; B.0.25; C.0.5; D.1.0; E.2.5; F.5.0 Electrochemical anodization condition:25 ℃, 20 V, 30 min |
2.1.2 有机电解质溶液体系
为降低阳极化钛丝原位生长TiO2NTs化学刻蚀速率,引入有机溶剂型电解质,在有机电解质中,F-对TiO2NTs的刻蚀速率小,反应时间内阳极氧化速率大于化学刻蚀速率,从而得到规则的TiO2NTs阵列。
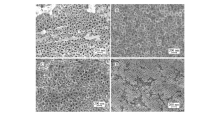
化学刻蚀速率随着F-浓度的增加而增加,而TiO2NTs阵列形成速率会随着F-浓度的增加而减小。 因此,通过调节和优化NH4F的浓度,可控制TiO2NTs阵列生长中阳极氧化和化学刻蚀这两个动力学过程的动态平衡,达到TiO2NTs阵列结构的可控生长。图2是乙二醇浓度相同的条件下,不同NH4F浓度下,钛阳极氧化的SEM照片。 由图2A和2B可以看出,当NH4F浓度较低时,钛丝表面有片状层,说明刻蚀速率较低,片状物覆盖了纳米管,导致不能形成连续规则的纳米管;NH4F浓度进一步增大,化学刻蚀速率增大后,钛丝表面形成了阵列TiO2NTs(图2C和2D);NH4F浓度继续增大(图2E和2F),化学刻蚀速率远大于氧化速率,Ti4+的迁移速率增大,阵列TiO2NTs的结构受到破坏,最终形成片状TiO2。
TiO2NTs优异的性能很大程度上取决于纳米管孔径的大小。 在水为溶剂的电解液中,虽然氧化得到了TiO2纳米管,但纳米管较短(图1)。 为增加管的长度,实验采用含乙二醇溶液的电解质,研究了乙二醇浓度对TiO2NTs的影响。
固定氟化铵的质量分数为0.5%,乙二醇为的体积分数分别为20%、50%、60%和80%。 在20 V恒电势下电解30 min,利用SEM观察其形貌,结果如图3所示。
从图3可以看出,随着乙二醇浓度的增大,得到的TiO2NTs变得更长更平滑。 乙二醇是有机溶剂型电解液,其酸性较水溶性电解液弱,F-对TiO2NTs的刻蚀速率下降,在较长的反应时间,阳极氧化速率大于化学刻蚀速率,从而得到较长的TiO2NTs阵列。 因此,乙二醇的浓度越低,得到的纳米管越短,随着乙二醇浓度的增大,纳米管在变长的同时,其不规则性也增加。 纳米管出现了叠加,其机械强度将随之降低。 综合考虑纳米管的长度和强度,最佳的电解液组成为NH4F质量分数0.5%,乙二醇体积分数50%。
用SEM对阳极化的钛丝表面进行表征,由图4可见,钛丝表面(图4A,4C)阳极氧化后生成了高度有序的TiO2NTs阵列(图4B,4D),其平均孔径约为100 nm,壁厚约25 nm。
将所组装的TiO2NTs阵列涂层应用于SPME,以PAHs为目标化合物,与HPLC联用,考察TiO2NTs涂层的萃取性能。 为了获得更佳的萃取效果,系统地研究了萃取温度、萃取时间、解吸时间、离子强度、搅拌速率对萃取效率的影响。 实验过程中,PAHs混合溶液各化合物的质量浓度均采用50 μg/L。
一般来说,萃取时间取决于PAHs在萃取涂层与水样之间的分配平衡时间,如果萃取时间短,富集到纤维涂层的PAHs量太少而影响测定方法的灵敏度。 萃取时间太长,又会导致测定时间过长而使方法失去时效性。 在10~60 min内,考察了时间对萃取效率的影响,如图5A所示,PAHs在萃取涂层的量在达到平衡之前随着萃取时间的延长而增多(以峰面积表示),在50 min内除了蒽以外,其它化合物的萃取已经基本达到了平衡。 综合考虑,在后续实验中,萃取时间确定为50 min。
 | 图5 萃取条件对萃取效率的影响Fig.5 Effect of extraction time(A), desorption time(B), temperature(C), stirring rate(D) and ionic strength(E) on extraction efficiency |
在SPME过程中,两个步骤非常重要,一是分析物在纤维涂层表面的吸附,另一个是分析物从纤维涂层解吸。 理想情况下这两个步骤越快越好。 由于条件不同,两个步骤都会发生变化。 用甲醇-水溶剂从TiO2NTs阵列洗脱PAHs的量由解析时间决定。 为了实现完全脱附PAHs,解吸时间在2~7 min的范围内进行了考察,结果见图5B,PAHs在6 min基本达到解析完全,所以实验确定解析时间为6 min。
温度对萃取效率有两个不同的影响。 一方面,升高温度可以增加分子的迁移速率,从而加快萃取速度;另一方面,它会降低分析物在固相涂层与样品溶液之间的分配系数。 因此,选择一个合适的温度对萃取过程是非常必要的。 在实验中,在20~70 ℃范围研究了温度对PAHs萃取效率的影响,结果如图5C所示,色谱峰面积在50 ℃ 达到大多数化合物的最大值,所以实验以50 ℃为萃取温度。
溶液搅拌可以加快分析物扩散到纤维涂层的平衡时间。 磁子转速从400~900 r/min范围变化来考察搅拌速率对萃取效率的影响。 如图5D所示,在转速较小时,萃取效率随搅拌速率的增加而增加。 然而,磁子转速超过700 r/min后萃取效率反而降低。 这可能是由于强烈的流体剪切应力,待测物不容易吸附到纤维涂层表面。 因此,实验搅拌速率固定在700 r/min。
众所周知,在样品溶液中加入盐(如NaCl)后,氯化钠完全电离成Na+和Cl-,溶液中离子总浓度增大,静电作用增强,会减少分析物在水中的溶解度[24]。 “盐析效应”会增加PAHs在萃取纤维的富集量。 同时,由于Na+和Cl-在萃取涂层表面与PAHs发生竞争性吸附而导致吸附位的减少,使得萃取效率反而下降。 实验考察NaCl质量浓度在5~30 g/L的萃取效率。结果如图5E所示,当NaCl质量浓度范围为5~15 g/L,随着NaCl质量浓度的增大,萃取效率会有所增加,此时应当是“盐析效应”的作用大于“竞争吸附”作用;而当NaCl质量浓度大于15 g/L后,萃取效率反而随着NaCl质量浓度的增大而减小,说明此时起主导作用的是“竞争吸附”。 因此,实验采用加入15 g/L的NaCl以增加萃取量。
在优化萃取条件下,评价了TiO2NTs/Ti纤维的分析性能,考察了该方法的线性范围(LR)、拟合方程的相关系数(R)、检出限(LOD)、定量限(LOQ)以及单个纤维(single fiber)与多个纤维(fiber-to-fiber)测定结果的相对标准偏差(RSD)等性能参数。
通过测定9个不同浓度的PAHs混合溶液,得到回归方程的线性范围在0.20~500 μg/L之间, R2系数在0.9980~0.9992范围变化,说明该测定方法中浓度与峰面积具有良好线性范围。 如表1所示,单个纤维测定5次的RSD范围是3.5%~4.7%,而3个纤维平行测定所得RSD的值在5.2%~7.9%之间。 LOD是评价一个分析方法的重要指标,达到 S/N=3时的样品最低浓度即为LOD。 LOQ则是指定量分析实际可以达到的极限,是指 S/N=10时的样品最低浓度。 由实验结果可计算得到LOD(0.03~0.05 μg/L)和LOQ(0.12~0.18 μg/L)。 LOD值较低,意味着该纤维涂层具有良好的定量分析的检测能力,TiO2NTs/Ti纤维在分析环境水样中微量的PAHs时具有高效率和高灵敏度特点。
| 表1 TiO2NTs/Ti-SPME-HPLC法测定水样中PAHs的特征数据 Table 1 Analytical parameters of the proposed method with the TiO2NTs/Ti fiber |
根据已经优化的实验条件,测定5个实际水样中Nap、Flu、Phe、Ant、Flt和Pyr 6种PAHs含量,水样分别是自来水、雨水、黄河水、兰州某地湖水及污水,测定结果如表2所示。
| 表2 TiO2NTs/Ti-SPME-HPLC测定不同环境水样中PAHs的分析结果 Table 2 Analytical results of UV filters in different environmental water samples |
图6为在实验所得优化条件下测得的污水试样中PAHs含量的色谱图,由图6可以看出,TiO2NTs/Ti纤维对水中PAHs化合物具有很好的富集效果。
本文讨论了不同浓度的NH4F和乙二醇组成的电解液对原位阳极氧化钛丝所得二氧化钛纳米管形貌的影响,确定得到规则有序的二氧化钛纳米管的最佳电解质组成。 并以组装得到的二氧化钛纳米管作为固相微萃取的纤维,与高效液相色谱—紫外检测器联用,成功萃取并测定了环境水样中的6种多环芳烃。 所建立的测定多环芳烃的方法,灵敏度高、精密度好且检出限低。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|