‡共同第一作者
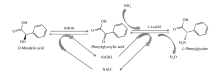
L-苯甘氨酸是重要的手性非天然 α-氨基酸,可广泛用于合成多种食品添加剂及药物中间体,探索其绿色合成工艺具有重要的意义。 本研究将新型高活性的 D-扁桃酸脱氢酶(LhDMDH)和 L-亮氨酸脱氢酶(EsLeuDH)偶联,在辅酶内循环的前提下,仅需较低浓度的辅酶即可实现生物催化 D-扁桃酸合成 L-苯甘氨酸。 通过对加酶量、氧化型烟酰胺腺嘌呤二核苷酸(NAD+)浓度、NH4+浓度和底物浓度等因素进行优化,获得了一个最经济的反应条件:200 mmol/L的 D-扁桃酸、6.5 kU/L的加酶量、0.1 mmol/L NAD+、0.5 mol/L NH4+的条件下、30 ℃,反应12 h,在此条件下,产物的得率和对映体过量( e.e.)值分别可达98%和99%以上,具有较大的产业化潜力,为实现 L-苯甘氨酸规模化的生物合成奠定了坚实的基础。
‡Co-first author
L-Phenylglycine is an important class of chiral non-natural amino acids, and can be used to synthesize a variety of important pharmaceutical intermediate. Exploiting the green synthesis process of phenylacetone acid has significant economic value. In this study, novel and highly active D-mandelate dehydrogenase (LhDMDH) and L-leucine dehydrogenase (EsLeuDH) are coupled to achieve bio-transformation of D-mandelic acid into L-phenylglycine on the premise of coenzyme circulation, and this reaction only requires a lower concentration of coenzyme. By optimizing the transformation conditions including added amount of enzyme, β-nicotinamide adenine dinucleotide (NAD+) concentration, NH4+ concentration and substrate concentration, we obtain the most economical condition: 200 mmol/L D-mandelic acid, 6.5 kU/L enzyme, 0.1 mmol/L NAD+, 0.5 mol/L NH4+ and 30 ℃ for 12 h. The product yield and enantionmeric excess ( e.e.) value can reach more than 98% and 99% under the most economical condition, respectively. This transformation has large industrialization potential, and lays a solid foundation for achieving large-scale biosynthesis of L-phenylglycine.
手性 α-氨基酸的用途非常广泛,可广泛用于药物、动物饲料和人工甜味剂领域[1]。 L-苯甘氨酸也称为苯基甘氨酸,是一种非天然的芳香族 α-氨基酸[2],它是医药及化工工业中重要的手性砌块。 L-苯甘氨酸及其衍生物是合成紫杉醇[3]及 β-内酰胺类抗生素[4]的重要手性中间体,其中 L-邻氯苯甘氨酸也是合成氯吡格雷的关键中间体[5]。 随着化工技术的不断发展,化学合成苯甘氨酸的工艺非常成熟。 但传统的化学合成中会用到剧毒的氰化物或者强碱,对环境的污染较为严重[6]。 此外,化学合成苯甘氨酸的对映选择性较差,增大了后续手性拆分等纯化的成本。 相比化学合成,生物合成具有手性选择性强、反应条件温和、环境友好及对设备要求低等优势[7],随着环境问题日益突出,绿色、环保的生物合成更受关注和青睐[8,9]。 因此,后续也出现了一些利用苯海因酶转化法[10]、 D-苯甘氨酸氨基转移酶法[11]和氨基酸脱氢酶法[12]等生物合成苯甘氨酸的报道。 然而,它们仍存在一定的缺陷,例如需要硫酸的辅助[10]、催化活性低[11]或需要额外的辅酶循环系统[12]等。 因此,目前亟待开发一条转化效率高、对映选择性好、成本低廉并且环境友好的 L-苯甘氨酸制备路线。
D-扁桃酸脱氢酶( D-mandelate dehydrogenase,DMDH)能选择性地催化 D-扁桃酸脱氢氧化[9,13], L-亮氨酸脱氢酶( L-leucine dehydrogenase, L-LeuDH)能催化苯乙酮酸的胺化还原[14],它们在 L-苯甘氨酸生物合成中有巨大的应用潜力。 在前期的研究中,本研究团队从哈尔滨乳杆菌中挖掘到了一个高活性的 D-扁桃酸脱氢酶LhDMDH[15],利用重组大肠杆菌全细胞催化 D-扁桃酸制备苯乙酮酸,在无辅酶和辅底物添加的条件下,产物的得率和纯度分别可达45%和99%左右[8]。 同时,通过引入 L-乳酸脱氢酶,强化了重组菌辅酶再生的能力,对 D, L-扁桃酸的转化效率高达40%[9]。 在有氧化还原反应的生物合成中,寻找合适的辅酶循环反应,高效解决辅酶再生问题,是科研工作者共同关注的焦点[16,17]。 传统的引入其他酶和辅底物的辅酶再生途径,增加了催化剂的使用成本,更增加了后续产物分离的难度和成本[2]。
在本研究中,拟建立一条以 D-扁桃酸脱氢酶和 L-亮氨酸脱氢酶为核心催化剂的级联生物合成(cascade biosynthesis)工艺(图1),试图在实现辅酶内循环、不引入辅底物及额外的生物催化剂的前提下,实现 L-苯甘氨酸的高效生物合成,为进一步实现 L-邻氯苯甘氨酸的生物合成奠定基础。
重组大肠杆菌 E coli BL21/pET28a-LhDMDH菌株[9]由本研究室构建和保藏,用于 D-扁桃酸脱氢酶的生产;重组大肠杆菌 E.coli BL21/pET28a-EsleuDH菌株[14]由华东理工大学许建和教授馈赠,用于生产 L-亮氨酸脱氢酶; D-扁桃酸、苯乙酮酸、 D-苯甘氨酸和 L-苯甘氨酸均购自上海阿拉丁生化科技股份有限公司,均为分析纯试剂;异丙基硫代- β-D-半乳糖苷(Isopropyl- β-D-thiogalactopyranoside,IPTG)购自于上海生工生物工程有限公司;氧化型的烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD+)和还原型的烟酰胺腺嘌呤二核苷酸(Reduced nicotinamide adenine dinucleotide,NADH)购自于深圳邦泰生物工程有限公司;甲醇购自于天津科密欧化学试剂有限公司,色谱纯;其它试剂均为国产或进口的分析纯产品。 LB(Luria-Bertani,溶菌肉汤)培养基:1%胰蛋白胨、1%氯化钠和0.5%酵母提取物,自然的pH值,121 ℃灭菌20 min,主要用于 E.coli的培养。
EC 2006型高效液相色谱系统(HPLC,大连依利特分析仪器有限公司);Thermo Hypersil C18柱(美国Thermo Scientific公司),用于产物的定性和定量分析;Chirobiotic T手性柱(大赛璐药物手性技术(上海)有限公司)用于产物的手性分析;Thermo Scientific LTQ Orbitrap XL型高分辨质谱仪(美国Thermo Scientific公司)。
用超纯水将 L-苯甘氨酸分别配成1.0~3.0 mmol/L的溶液(以0.5 mmol/L为间隔),然后分别取20 μL进行HPLC分析,获得各浓度下样品的峰面积,并进行线性拟合获得回归方程及相关系数。 HPLC色谱柱为Thermo Hypersil C18柱,检测波长为215 nm,柱温30 ℃,流动相为甲醇/水(体积比为20:80),流速为1 mL/min。 产物以同样的条件进行HPLC分析,根据测得的峰面积可依回归方程计算出相应的样品浓度。 在此条件下, L-苯甘氨酸的保留时间约为3.43 min,将 L-苯甘氨酸不同浓度浓度值对相应的峰面积进行线性拟合,获得 L-苯甘氨酸的标准曲线,得出 L-苯甘氨酸浓度对应的回归方程为 y=0.0003 x-0.3307,相关系数为0.9998。
先参照1.2节中的方法对产物进行普通C18柱的HPLC分析。 然后,利用Chirobiotic T手性柱对产物及 L-苯甘氨酸标准品进行HPLC分析,流动相为甲醇/水/三氟乙酸(体积比为20:80:0.1),流速为0.5 mL/min,检测波长为254 nm,柱温30 ℃,依此来计算产物中 L-苯甘氨酸的对映体过量( e.e.)值。 根据在相同分析条件下,产物在普通Thermo Hypersil C18柱以及Chirobiotic T手性柱中的保留时间,与 L-苯甘氨酸标准品的保留时间是否一致,来对产物进行初步的定性分析。 最后,对底物和产物进行高分辨质谱分析,基于质荷比对其进行定性分析。
采用低诱导剂浓度及低温策略对重组大肠杆菌进行诱导表达[18],分别将 E.coli BL21/pET28a-LhDMDH和 E.coli BL21/pET28a-EsLeuDH菌株接种至含卡拉霉素的4 mL LB液体培养基,37 ℃、200 r/min的条件下培养14 h,再以2%接种量转接至100 mL新鲜的无抗LB液体培养基,37 ℃、200 r/min培养2.5 h,加入IPTG至终浓度为0.1 mmol/L,16 ℃、200 r/min诱导培养20 h,8000 r/min、4 ℃,离心5 min,收集菌体,加入10 mL裂解缓冲液,重悬,然后进行超声破碎,然后进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)及酶活性分析[2,9,14]。
在50 mL的具塞三角瓶中构建10 mL的反应体系,10 mL反应液中包含500 mmol/L NH4Cl-NH3·H2O(pH=9.5)缓冲液、100~400 mmol/L的 D-扁桃酸、5.0~10 kU/L的LhDMDH、5.0~10 kU/L的EsLeuDH、0~10 mmol/L的NAD+,混匀后于30 ℃、180 r/min,反应12 h,每隔2 h,取样1次,经离心后用HPLC法测定产物的得率。
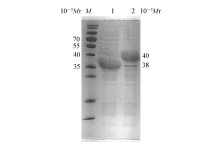
分别将重组大肠杆菌 E.coli BL21/pET28a-LhDMDH和 E.coli BL21/ pET28a-EsLeuDH菌株按照1.4节中的方法进行诱导表达,将100 mL诱导后的菌液冷冻离心收集菌体,经10 mL裂解缓冲液重悬,再超声破碎后进行酶活性及蛋白分析。 SDS-PAGE的结果如图2所示, E.coli BL21/pET28a-LhDMDH和 E.coli BL21/ pET28a-EsLeuDH的表达产物分别在约3.8×104和4.0×104处均有明显的特异性条带,结果表明这两种菌株在IPTG的诱导下均成功表达出目的蛋白。 D-扁桃酸脱氢酶和 L-亮氨酸脱氢酶酶活性分析的结果显示,在30℃、pH=9.5(NH4Cl-NH3·H2O缓冲环境)的测定条件下, D-扁桃酸脱氢酶对 D-扁桃酸的氧化活性为250 U/mL,而 L-亮氨酸脱氢酶对苯乙酮酸的还原活性为54 U/mL,酶的表达水平与文献报道的基本一致[14]。
2.2.1 加酶量对 L-苯甘氨酸得率的影响
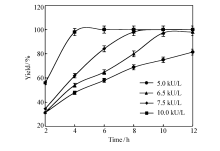
参照1.5节中的方法,首先考察了不同加酶量对 L-苯甘氨酸得率的影响。 由于在该级联催化反应中, D-扁桃酸脱氢酶和 L-亮氨酸脱氢酶的辅酶恰好可以实现反应内部的辅酶循环[2],在本研究中将两种酶的添加比例暂定为1:1。 在100 mmol/L底物、0.1 mmol/L NAD+和0.5 mol/L NH4+的条件下,考察了各酶加酶量为5.0、6.5、7.5和10 kU/L反应液时的转化效率,反应进程曲线如图3所示。 由图3可知,加酶量越大,反应速率越快。在已考察的4种条件下,当加酶量为10 kU/L时,反应速率最快,反应进行到第4 h时产物得率接近100%。 而加酶量为6.5 kU/L时,反应进程相对较缓,在第10 h时产物得率可达98%,综合考虑酶的使用成本及生产效率,选择将加酶量6.5 kU/L作为下一步继续考察的条件。
2.2.2 辅酶添加量对 L-苯甘氨酸得率的影响
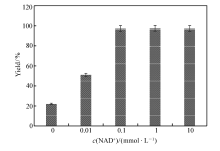
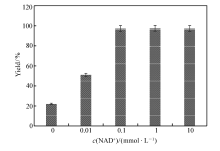
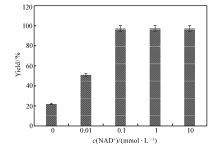
辅酶是氧化还原酶的重要辅因子,在氧化还原反应中起关键的作用[2]。 过低的辅酶浓度会降低氧化还原反应的效率,过高的辅酶浓度又会增加辅酶的使用成本,有时甚至还会产生辅酶抑制效应[16]。 在100 mmol/L底物、6.5 kU/L加酶量和0.5 mol/L NH4+的条件下,分别考察了0、0.01、0.1、1和10 mmol/L NAD+下 L-苯甘氨酸的得率,结果如图4所示。 结果表明,NAD+的浓度对产物得率有较大影响,0.1 mmol/L的NAD+是一个临界点,当添加量低于0.1 mmol/L时,由于反应体系中含有的辅酶浓度太低,影响到了氧化还原反应中电子的传递速率,减慢了整个反应的速率;而当添加量超过0.1 mmol/L时,反应的速率提升并不明显,表明此时辅酶浓度已经完全满足氧化还原反应的需求,过多的添加辅酶只会增加成本,不会提高生产效率。 而在没有额外添加NAD+的条件下, L-苯甘氨酸的得率也能达到22%,表明在此条件下级联反应也能进行,这可能归因于加入的酶液中含微量的由大肠杆菌产生的NAD+,而低浓度的辅酶能够维持氧化还原反应,但反应速率较低。 这一现象与我们前期研究中利用全细胞催化技术,在无辅酶添加条件下,以扁桃酸为底物进行苯乙酮酸生物合成的案例保持一致[9],也为后续利用全细胞催化合成 L-苯甘氨酸奠定了理论基础。
2.2.3 NH4+浓度对 L-苯甘氨酸得率的影响
NH4+是中间产物苯乙酮酸胺化还原的重要辅底物,其浓度对终产物的形成有重要的影响[2,5]。 为了获得最佳的NH4+浓度,在100 mmol/L底物、0.1 mmol/L NAD+和6.5 kU/L加酶的条件下,考察了0.1、0.2、0.5、1和2 mol/L NH4+对产物得率的影响,结果如图5所示。 在一定范围内,提高NH4+浓度有利于提高产物的得率,这可能归因于高浓度的NH4+能促进中间产物的胺化还原,有利于产物的生成。 当NH4+浓度达到5倍底物浓度时,产物得率可达98%,且此后得率随NH4+浓度增加的趋势已不明显。 因此,基于节约NH4+的使用及降低后续产物分离成本的考虑,将5倍底物浓度的NH4+浓度定为最佳的浓度。
2.2.4 底物浓度对 L-苯甘氨酸得率的影响
提高反应体系中的底物浓度能够提高产物的浓度及时空得率,可以降低后续产物分离的成本,提高设备的利用率[2,14]。 在0.5 mol/L NH4+、0.1 mmol/L NAD+和6.5 kU/L加酶量的条件下,考察了100、200、300和400 mmol/L底物浓度对产物得率的影响,结果如图6所示。 结果表明,在底物浓度为200 mmol/L时,产物得率也能达到98%左右;当底物浓度达到300 mmol/L时,得率会显著下降。 此外,当底物浓度超过200 mmol/L时,反应过程中会出现白色的絮状物,将絮状物离心收集复溶于超纯水,经HPLC检测,发现该物质与中间产物苯乙酮酸的保留时间一致。 这一现象表明,过高的底物浓度会使中间产物的生成速率过快,中间产物来不及进一步转化为 L-苯甘氨酸;同时,由于苯乙酮酸的极性低于 D-扁桃酸,故会以沉淀的形式析出。 在以后的研究中,可以采用底物流加(Substrate flow)的工艺,逐渐提高底物浓度,以获得更高的时空得率。经过对催化条件的初步优化,200 mmol/L的 D-扁桃酸在6.5 kU/L的加酶量、0.1 mmol/L NAD+、0.5 mol/L NH4+的条件下,30 ℃,反应12 h后,产物的得率和 e.e.值分别可达98%和99%以上,转化率明显高于前人的报道[2]。 另外,由于该研究所选用的 D-扁桃酸脱氢酶的活性更高[2,19],使酶的使用成本更低,具有更高的技术经济性。
将反应产物经过离心及硅胶柱纯化后,按照1.3节中的方法进行普通C18柱的HPLC分析,产物保留时间约为3.4 min,与相同分析条件下 L-苯甘氨酸的保留时间一致。 将底物及纯化的产物进行高分辨质谱分析,结果如图7所示。 在图7A中,由质荷比可以推出物质的分子式可能为C8H8O3Na+(M+Na)+,表明该物质是C8H8O3(扁桃酸)结合了一个Na+;在图7B中,由质荷比可以推出物质的分子式可能为C8H10NO2+(M+H)+,表明该物质是C8H9NO2(苯甘氨酸)结合了一个H+。
 | 图7 底物和产物的高分辨质谱分析Fig.7 The high resolution mass spectrometry analysis of the substrate(A) and the product(B) |
用Chirobiotic T手性柱参照1.3节中的方法对 L-苯甘氨酸、 D-苯甘氨酸及产物进行HPLC分析, L-苯甘氨酸和 D-苯甘氨酸的保留时间分别约为7.4和8.9 min,大部分产物的保留时间在7.4 min左右,在8.9 min左右的峰面积较小。结合普通C18柱HPLC分析及高分辨质谱的分析结果,进一步表明该级联反应的终产物主要为 L-苯甘氨酸,且其 e.e.值大于99%,该级联反应具有较高的对映体选择性。
本文成功地以 D-扁桃酸脱氢酶和 L-亮氨酸脱氢酶作为核心催化剂,构建了能够实现辅酶内循环的级联反应体系,基于辅酶内循环,在不引入辅底物及额外的生物催化剂的前提下,实现 L-苯甘氨酸的高效生物合成。 在10 mL反应体系中,200 mmol/L的 D-扁桃酸在6.5 kU/L的加酶量、0.1 mmol/L NAD+和0.5 mol/L NH4+的条件下,30 ℃,反应12 h, L-苯甘氨酸的得率可达98%,且产物的 e.e.值>98%。 该反应策略能够显著降低催化剂的使用成本及后续产物纯化的成本,具有重要的应用价值。 本研究取得的成果丰富了 L-苯甘氨酸生物合成的策略,也会后续以 D, L-扁桃酸为底物进行 L-苯甘氨酸及衍生物的生物合成奠定了坚实的基础。
致谢 感谢华东理工大学许建和教授和江南大学邬敏辰教授为本研究提供宝贵的建议和技术支持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|