以钛粉为还原剂,氯金酸为氧化剂,将二者在180 ℃水热反应釜中发生氧化还原反应,最终生成直径800 nm左右的TiO2,比表面积为3.5 m2/g左右,其表面均匀担载了直径20 nm左右的金纳米颗粒。 采用X射线衍射(XRD)、场发射扫描电子显微镜(FE-SEM)、X射线光电子能谱分析(XPS)、紫外可见漫反射光谱、光电流密度、光催化制氢性能等测试表征了该复合催化剂的结构及性能。 结果表明,一步法制备的复合催化剂形貌规整,TiO2为锐钛矿晶型,金纳米颗粒的局域表面等离子体共振(LSPR)作用促进了催化剂对可见光有较强的吸收,催化剂催化产氢性能伴随金含量增大存在先增后减规律,可见光下最大产氢速率为0.1 μmol/(g·h),光催化活性表现稳定。
Titanium powders as the reductant and HAuCl4 were used as the oxidant to prepare TiO2-Au composite in the hydrothermal reactor at 180 ℃. Finally, the surface of TiO2 with 800 nm diameter was evenly coated by gold nanoparticles with 20 nm diameter. The specific surface area is about 3.5 m2/g. The structures and properties of the samples were characterized by X-ray diffraction(XRD), field emission scanning electron microscopy(FE-SEM), X-ray photoelectron spectroscopy(XPS), ultraviolet-visible diffuse reflectance spectroscopy, photocurrent density and photocatalytic hydrogen production performance. The morphology of the catalyst synthesized by the one-step method is regular. The final TiO2 is anatase. The catalyst has a strong absorption in the visible region, benefitting from the local surface plasmon resonance(LSPR) of gold nanoparticles. The hydrogen production performance of the catalyst increases firstly and then decreases with the increase of Au. Under visible light, the maximum hydrogen production rate is 0.1 μmol/(g·h) and the photocatalyst has good stability.
纳米TiO2是一种重要的无机功能材料, 因其具有湿敏、气敏、介电效应、光电转换、光致变色及优越的光催化等性能, 使其在传感器、介电材料、光电材料、自洁材料和催化剂及载体等领域具有广泛的应用前景[1,2,3,4,5]。 近年来,环境保护越来越多地受到大家关注,作为光催化材料的TiO2也逐渐成为材料科学及催化科学的研究热点。 自1972年日本学者报道了光电池中受辐射的TiO2可以持续地致使水分解产生H2以来[6],TiO2为基础的光催化技术吸引了科技工作者强烈的兴趣,它以其价廉、无毒、光催化活性高、稳定性好而备受青睐。 在诸如水和空气的净化,细菌和病毒的破坏,癌细胞的失活,异味的控制,水的光解,固氮及石油泄漏的清除等方面得到广泛的应用。
TiO2有板钛矿相、锐钛矿相和金红石相,其中板钛矿极少被应用,究其原因是结构不稳定,而其它两种在工业用途中比较广泛。 这是因为,锐钛矿的带隙宽,具有更加开放的结构,使得光激发产生的电子-空穴对复合几率比较小,光催化效果更好;对于金红石来说,其带隙比较窄,激发波长范围比较广,所以,可见光也可以激发产生电子-空穴。 金红石相TiO2是热力学稳定相,有广泛的市场前景[7],但是,金红石相结构比较稳定,因此光生电子-空穴的复合几率比较大,所以锐钛矿相在光催化上更占据优势,
不同结构的TiO2材料由于在催化剂、光子晶体、生物活性物的保护和过滤等方面有着潜在的应用[8,9,10,11,12,13],所以越来越多地引起了人们的注意。 近年来,制备TiO2微结构引起了研究者的广泛兴趣。 多种形貌的TiO2被合成制备出来,如球状、空心、立方体等,通过不同的合成方法来制备Ti
贵金属纳米颗粒担载在TiO2表面是促进催化剂对可将光吸收的有效手段之一。 但是在已有的报道中,有关金属氧化物半导体-纳米贵金属复合材料的制备方法普遍比较繁琐[16,17,18,19,20],主要分为两个步骤,制备贵金属纳米材料然后与TiO2混合担载,这种预混的制备方法普遍会带来催化剂结构上的不稳定,贵金属纳米颗粒与TiO2结合不牢固,催化过程中容易脱落。 所以,有必要去开发一些简单易行的制备方法促进复合光催化剂批量生产,并增强其结合能力,这样才能实现进一步推广和应用。
钛化合物的结构以及水热参数的优化组合给控制材料微观结构带来了新思路,通过控制产物的结构和取向能进一步加深对微观物质催化能力和规律的认知,即通过反应物的形貌结构来设计和建造产物的纳米结构[22,23,24,25,26,27,28,29,30,31]。 换而言之,就是控制各反应物溶剂比例、制备TiO2与Au的复合材料,最终实现钛粉与氯金酸的充分反应。 尝试用低价态钛作为还原剂,以高价态金作为氧化剂,设计试验条件,使二者发生氧化还原反应。 最终生成TiO2负载了单质金纳米颗粒的复合催化剂,这种制备方法大大简化了材料制备的繁琐过程。 同时,氧化得到的TiO2与还原得到的金纳米颗粒之间存在着比一般制备方法更为紧密和牢固的连接,这是因为高价态金与低价态钛因接触才能发生化学反应,这种异质间的连接方式是伴随接触反应过程而形成的,是普通的机械混合或简单浸渍法所不能相比的。
本文结合常见的水热反应和氧化还原反应,使用低价态钛粉作为还原剂,以高价态金作为氧化剂,设计试验条件,使二者发生氧化还原反应。 最终生成了TiO2表面负载了金纳米颗粒的复合光催化剂,后续对催化剂的晶型、形态、结构、光学性质、光电性质、光催化性能和光催化机理进行了详细研究。 考虑到材料制备的方法得到了大大简化,这一研究为原理上可以通过氧化还原反应一步制备的复合材料提供了思路和参考。
氯金酸(Au质量分数>48%,阿拉丁试剂有限公司);双氧水(化学纯),氢氟酸(分析纯,质量分数>40%)钛粉(50 nm,质量分数15%)购自于国药集团化学试剂有限公司。
UV-2600型紫外可见分光光度计(UV-Vis,日本岛津公司);S-4800型扫描电子显微镜(SEM,日本JEOL公司);JEM-2010型透射电子显微镜(TEM,日本JEOL公司);D8 ADVANCE型X射线仪(XRD,德国布鲁克公司);ESCALAB 250型X射线光电子能谱(XPS,美国Perkin Elmer公司);Kubo X1000型比表面仪(北京彼奥德);CHI-660D型电化学工作站(上海辰华仪器有限公司);CEL-HXF300型光解水制氢设备(北京中教金源科技有限公司);N2000型气相色谱(GC,浙大智达自动化工程有限公司);Agilent 5973-N型气相色谱-质谱联用仪( GC-MS,美国安捷伦公司)。
将0.01 g钛粉分散在含有0.5 mL H2O2,17 mL H2O,0.06 mL HF混合溶液中,磁力搅拌5 min后,依次加入50、100、150和200 μL浓度为1 mmol/L的HAuCl4,按照金的质量分数对应记为TiO2-Au0.059、TiO2-Au0.118、TiO2-Au0.177和TiO2-Au0.236并超声分散均匀。 水热反应180 ℃保持2 h,最后自然冷却至室温,8000 r/min,离心20 min后收集淡红色沉淀,用乙醇和去离子水清洗3次,最后在80 ℃条件下真空干燥。
使用XRD分析样品的结晶状态,铜靶为射线源( λ=0.154 nm)。 使用场发射SEM(FE-SEM)以及高分辨TEM(HRTEM)观察样品的表面形貌。 使用XPS分析元素价态。 使用比表面仪测试样品的比表面积。 使用紫外可见近红外光谱仪得到样品的漫反射光谱图(DRS),测试时选用BaSO4粉末作为标样。 所有的测试均在室温下进行。
光催化制氢反应采用顶部照射,并连接一个封闭循环体系的石英玻璃反应器。 抽真空排除反应溶液里面的空气,然后使用500 W氙灯照射进行反应。 入射光源使用可见光滤光片( λ>420 nm),反应溶液保持在5 ℃,循环水控温。 选择中教金源CEL-SPH2N石英反应容器,取0.05 g催化剂分散到100 mL等体积比的甲醇和水的混合溶液中。 采用浙大智达气相色谱,N2气为载气对产物进行定量分析(甲醇起到了牺牲剂作用,用来消耗光生空穴)。
首先,制备工作电极,取0.01 g的样品分散于1 mL的去离子水中,超声使样品均匀,用移液枪将样品溶液涂到3 cm×1 cm的氟掺杂的SnO2透明导电玻璃(FTO)上,在烘箱中60 ℃干燥3 h。
使用标准三电极体系的CHI-660D型电化学工作站测试光电流。 将待测样品覆盖到FTO导电玻璃上作为工作电极,其有效面积约为1 cm2。 石墨电极和饱和甘汞电极分别作为对电极和参比电极,电解液为0.1 mol/L的Na2SO4溶液。 光源使用500 W氙灯。 光电流密度与电压特性曲线( J-V)测试的扫描速度10 mV/s,光电流曲线在0.8 V偏压下测量。
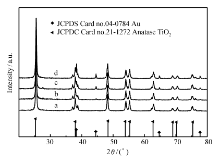
不同氯金酸添加量的催化剂样品XRD 谱图如图1所示。 由图1可见,从TiO2-Au0.059、 TiO2-Au0.118、TiO2-Au0.177和TiO2-Au0.236这4个样品对应的TiO2均为锐钛矿相。 2 θ为25.3°、37.8°、48.1°、54.0°、55.1°和62.8°均对应了锐钛矿的衍射峰位置(标准XRD卡片,JCPDS 卡号:21-1272)。 且从XRD图谱上可以看出,这4个样品对应Au的衍射峰强度逐渐加强,表明还原出的金单质也越来越多。 44.4°、64.6°和77.5°峰位置对应了金的衍射峰(标准XRD卡片,JCPDS 卡号:04-0784)。
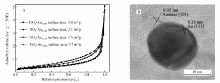
图2为不同含金量的TiO2-Au催化剂对应的FE-SEM照片。 TiO2-Au催化剂的颗粒粒径在800 nm左右,形貌基本上呈球形,但是表面交错堆叠了沟槽棱角,整体像花苞一样。 TiO2-Au0.059、TiO2-Au0.118、TiO2-Au0.177和TiO2-Au0.236中均匀地分布着大小为20 nm左右的明亮的小点,场发射背散射成像条件下,这些亮点均是担载在TiO2表面的金纳米颗粒,图2C中插图为TiO2-Au0.177对应的能谱图,可以看出对应元素。 4个样品表面担载的金纳米颗粒数量越来越多,这与氯金酸的添加量相一致。
图3A为样品TiO2-Au的氮气吸脱附等温线,可以看出伴随样品含金量逐渐增大,其对应的材料比表面积也由3.0 m2/g增大到3.7 m2/g,可能是因为表面金纳米颗粒量增加的缘故,但是总体比表面积均不算大,这主要是因为材料中TiO2颗粒比较大。图3B为样品TiO2-Au0.177的高分辨透射电子显微镜照片,可以清楚看到0.35 nm的锐钛矿(101)晶格衍射条纹间距和0.24 nm对应的Au(111)晶格衍射条纹间距,金纳米颗粒的粒径在20 nm左右。
为了更好的研究和理解Au@TiO2材料的组分结构,对晶化后的材料进行了XPS测试。图4中A是Au元素的高分辨的光电子能谱,键能归属分别为83.6 eV(Au4 f7/2),86.9 eV(Au4 f5/2),均属于单质态的金。 在较高的键能区域再未发现可观察到的峰位出现,说明没有金的氧化物存在,均已经被还原成单质金。图4B对应的是Ti元素的2 p轨道的能级,458.8和464.5 eV均对应着+4价态Ti元素2 p3/2和2 p1/2键能,说明最终单质钛均已经氧化成TiO2。
TiO2-Au材料的固体紫外可见漫反射光谱如图5A所示。 在大于450 nm波长的可见光范围内可以明显观察到,TiO2-Au材料相较与纯TiO2均有明显的吸收光增强,这可能是因为金纳米颗粒的局域表面等离子体共振(LSPR,Localized Surface Plasmon Resonance Absorbance)。 520 nm的吸收峰刚好对应了金纳米颗粒的吸收峰位置。图5谱线a-d可见光范围吸收峰红移,同时吸光度也逐渐增强,这是因为越来越多的金纳米颗粒包埋或者担载在TiO2上,该结果与FE-SEM、XRD表征一致。图5B所示为能带分布,伴随金含量增加,对应能带逐渐变窄,由3.2 eV降低到2.9 eV。 在可见光范围内增强的吸收光很可能对光生电子和空穴的产率有提升,进而对光催化反应有促进作用。
为了更为深入的了解TiO2-Au催化剂的光电化学性质,在可见光下,对材料施加一定范围的电势,测试其电流密度变化。图6为测试结果,在无光照条件下,初始TiO2的光电流在这一电势范围内非常低,即暗电流可以忽略不计。 TiO2-Au催化剂在可见光照射下,刚施加电压不久,光电流就开始急速上升,然后在0.8 V左右达到最大值。 其中,TiO2-Au0.177样品的最大饱和光电流密度可以到达1.7 mA/cm2,是这几种催化剂中效果最好的。 这一结果表明,TiO2-Au样品可以作为可见光光阳极。
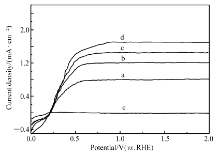 | 图6 TiO2-Au光电流密度与电压特性曲线( J-V),扫描速度10 mV/sFig.6 Current density versus potential( J-V) curves of TiO2-Au with 10 mV/s scan speed a.TiO2-Au0.059; b.TiO2-Au0.118; c.TiO2-Au0.177; d.TiO2-Au0.236; e.TiO2 |
图7为开关光路时材料产生的光电流图,测试电压选择0.8 V。 光电流响应的测试使用了上海辰华的电化学工作站(CHI-660D),在自制标准的三电极体系中测试。 三电极体系选用铂片作为对电极,饱和甘汞电极作为参比电极,工作电极为修饰了TiO2-Au材料的导电ITO玻璃。图7所示,当施加光照的瞬间,此类材料光电流信号迅速出现,而将光源关闭时,光电流也会很快消失,没有表现出较为迟缓的上升沿和下降沿,这说明材料对光信号的响应速度非常迅速。
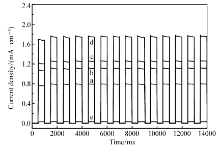 | 图7 可见光下,TiO2-Au光电流密度Fig.7 The transient amperometric on-off current-time curves of TiO2-Au under visible light a.TiO2-Au0.059; b.TiO2-Au0.118; c.TiO2-Au0.177; d.TiO2-Au0.236; e.TiO2 |
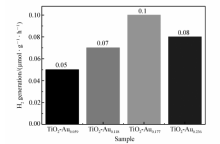
可见光下TiO2-Au产氢速率如图8所示,TiO2-Au样品对应的含金量依次渐增,可以从图8看出,样品TiO2-Au0.177能够得到最大的产氢速率为0.1 μmol/(g·h)。样品A-C伴随含金量逐渐增大,催化剂表现出的可见光下光解水产氢速率逐渐增大,当含金量高于样品C的含金量时,催化剂表现出的可见光下光解水产氢速率出现下降,这很可能是因为过多的金纳米颗粒担载在TiO2表面,不仅遮盖了活性位点,同时也遮挡了一部分光线照射到TiO2表面。 最终催化剂的催化性能没有得到有效提升。
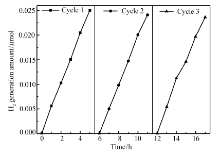
对于催化剂催化历程来说,因为涉及到化学反应过程中的许多步骤,反应过程中有可能会出现催化剂中毒现象,因此,催化剂的稳定性同样是决定催化剂能否被实际应用的一个重要性能指标。 为此,进行了连续3 d的催化试验,每天持续催化反应进行5 h。 每次反应结束后将催化剂离心清洗回收准备第2天的催化试验。图9是催化实验的结果,可以看出连续催化试验3 d,催化剂的活性只是略微有一些降低,这应该是因为在催化剂离心回收过程中有一些质量损失造成的。
如图10A所示,持续催化过程中,可以直接从气相色谱的氢气谱图看出催化剂TiO2-Au0.177的性能,连续催化16 h过程中能保持稳定的性能。 实验色谱条件下的H2出峰时间为1.65 min左右,随着时间延长,峰强度和峰面积都在增强,最大峰对应时间逐渐延长。 持续催化反应后,对反应剩余溶液离心处理,取上清液进行GC-MS分析,图10B可以看到催化反应产物中有甲醛生成,应该是牺牲剂甲醇被空穴氧化后的产物。
基于上述研究结果,我们提出了催化剂可见光下催化光解水产氢的可能机理。 可见光照射到金纳米材料上引起LSPR现象,在金纳米材料与TiO2接触的界面上热电子会快速迁移到TiO2表面,避免了与空穴复合,迁移出的电子在TiO2表面还原水分子产生氢气;空穴在金纳米材料表面对甲醇起到氧化作用生成甲醛。 金纳米材料本身作为一个大的电子富集体有利于空穴的捕获,有利于光生电子和空穴的分离,最终促进了可见光下光解水产氢性能。
本文结合水热反应和氧化还原反应,一步法制备出TiO2-Au催化剂。 相比于传统制备方法,大大简化了制备工艺,一步得到表面均匀担载金纳米颗粒的锐钛矿相的TiO2。 可见光区,材料表现出较好的光吸收性能,其光电流密度较大,对可见光响应迅速。 在可见光激发下,TiO2-Au表现出一定的光催化分解水制氢活性,材料存在最优的金担载量,表现出一定的可见光催化制氢性能。 在TiO2-Au光催化剂中,金纳米粒子的局域表面等离子共振效应通过电子转移效应和电磁场增强效应,使得光生电子和空穴的复合几率减小,更多的光生电子参与到光催化反应中,故此TiO2-Au光催化活性得到了提高,实现了可见光光催化分解水制氢。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|