为了探究目前表面活性剂生产和应用中用脂肪酸甲基单乙醇酰胺或脂肪酸单乙醇酰胺替代脂肪酸二乙醇酰胺的趋势的可行性,本文首先采用亚硝酸叔丁酯法合成3种乙醇胺的亚硝胺化合物作为基准物,通过鉴定产物结构研究亚硝胺的形成历程,然后以亚硝酸法合成亚硝胺化合物,通过生成率比较3种乙醇胺形成亚硝胺化合物的难易程度。 亚硝化历程分析结果表明,二乙醇胺或甲基单乙醇胺均直接形成相应的亚硝胺,而单乙醇胺通过歧化反应生成二乙醇胺继而形成少量 N-亚硝基二乙醇胺。 与二乙醇胺相比,甲基单乙醇胺或单乙醇胺更不易生成亚硝胺,因此用脂肪酸甲基单乙醇酰胺或脂肪酸单乙醇酰胺替代脂肪酸二乙醇酰胺是合理可行的。 本研究结果对保障人类生命健康安全具有理论和实践意义。
To investigate the reasonability and feasibility to substitute fatty acid diethanolamide by monoethanolamide and methylethanolamide in surfactant production and application, the nitrosation of methylethanolamine or monoethanolamine was compared with diethanolamine. In this study, nitrosamines were prepared from three ethanolamines by nitrosating agents of both tert-butyl nitrite and nitrous acid. The products of nitrosation by tert-butyl nitrite were identified to reveal nitrosation mechanisms, while the yields of the nitrosamines formed by nitrous acid were used to evaluate the easiness of nitrosation among three ethanolamines. Mechanism analysis of nitrosation shows that diethanolamine or methylethanolamine forms the corresponding nitrosamines, while monoethanolamine solely forms trace amount of N-nitroso-diethanolamine owing to the formation of intermediate diethanolamine by disproportionation of monoethanolamine. The experimental results also reveal that methylethanolamine and monoethanolamine are more difficult to form nitrosamines than diethanolamine. Therefore, it is reasonable and feasible to substitute fatty acid diethanolamide by monoethanolamide and methylethanolamide in surfactant production and application, which has theoretical and practical significance for safeguarding human health and safety.
亚硝胺由胺类化合物经亚硝化形成,是一类可引起动物癌变的有害污染物[1],它可存在于食品、化妆品和烟草等众多日常用品当中,易被人体摄入[2]。 烷醇酰胺类表面活性剂是一类性能优异的增稠稳泡剂,被广泛应用于化妆品、个人洗护产品和家居清洁用品[3,4]等日用化学品领域,也被用于餐具洗涤剂、瓜果蔬菜清洗剂和食品加工机械清洗剂[5,6]等食品洗消剂中。已有较多研究表明二乙醇胺容易被亚硝化形成致癌性 N-亚硝基二乙醇胺[7,8,9],故脂肪酸二乙醇酰胺已被国内外禁限用[10]。 另外两种分别由甲基单乙醇胺和单乙醇胺衍生的烷醇酰胺作为替代品正在市场上流行,但对其形成亚硝胺的机理及其与二乙醇胺比较的难易程度尚缺少研究。目前研究多集中在添加抑制剂来阻碍亚硝胺的形成[11,12],通常仅在模拟高温、高压CO2存在下胺的亚硝化反应能力的报道[13]中才涉及到胺结构对形成亚硝胺的影响;也有利用计算化学比较不同种类的胺与亚硝酸反应的活化能[14],但并未涉及到与烷醇酰胺生产相关的上述3种乙醇胺。 因此,本文将选取与烷醇酰胺生产和应用相关的3种乙醇胺,首先采用绿色高效的亚硝酸叔丁酯法合成用于分析检测的亚硝胺基准物,并根据产物结构探讨其亚硝化历程;随后在以亚硝酸为亚硝化试剂时比较3种乙醇胺形成亚硝胺的难易程度及其与分子结构的关系,从而为目前用脂肪酸甲基单乙醇酰胺和脂肪酸单乙醇酰胺替代脂肪酸二乙醇酰胺的合理性和可行性提供依据。
Nicolet 6700型傅里叶全反射红外光谱仪(FT-IR,美国Thermo Fisher Scientific公司);LCZ/2690 XE/996型质谱仪(ESI-MS,美国Waters公司);AVANCE III 400MHz型核磁共振仪(NMR,德国Bruker公司); Ultimate 3000型超高效液相色谱(UPLC,美国Thermo Fisher Scientific公司);GC9720型气相色谱仪(GC,浙江福立分析仪器股份有限公司);Milli-Q超纯水机(美国Millipore公司)。
单乙醇胺和二乙醇胺(化学纯,国药集团化学试剂公司);甲基单乙醇胺(>99%,BASF(中国)有限公司);亚硝酸叔丁酯(>95%,上海Adamas试剂公司);亚硝酸钠(分析纯,国药集团化学试剂公司);柱层析用硅胶(48~75 μm,青岛海洋化工有限公司);其余试剂均为分析纯。
分别将0.02 mol甲基单乙醇胺(1.50 g )、二乙醇胺(2.10 g)或单乙醇胺(1.22 g)加入25 mL圆底烧瓶中,加入0.04 mol亚硝酸叔丁酯(4.12 g),45 ℃水浴中磁力搅拌避光反应,并用薄层层析色谱监测反应。 旋转蒸发除去生成的叔丁醇以及未参与反应的亚硝酸叔丁酯,经硅胶柱层析纯化产品。 用FT-IR、正离子模式ESI-MS、1H NMR和13C NMR鉴定产物结构。
将5 mL NaNO2(0.2 mol/L)分别与5 mL 浓度为0.2 mol/L的甲基单乙醇胺、二乙醇胺或单乙醇胺水溶液混合,加入1 mL盐酸(2 mol/L)后50 ℃水浴避光反应,不同时间取样经UPLC(C18反相色谱柱,流动相乙腈-水,检测波长230 或234 nm)测得相应亚硝胺的生成率。
将5 mL NaNO2(0.01 mol/L)分别与5 mL浓度为0.1 mol/L的甲基单乙醇胺、二乙醇胺或单乙醇胺水溶液混合,加入1 mL盐酸(3 mol/L)后37 ℃水浴避光反应,不同时间取样经UPLC测得相应亚硝胺生成率。
配制单乙醇胺的乙醇溶液及系列浓度二乙醇胺的乙醇溶液,通过GC法分析单乙醇胺中二乙醇胺的杂质含量。
为了比较3种乙醇胺形成亚硝胺的难易程度,需要以 N-亚硝基乙醇胺化合物为基准物并借助液相色谱[15,16]或液相色谱串联质谱[17]等方法定量,因此需要高产率合成高纯度 N-亚硝基乙醇胺类化合物。 目前,大多数合成 N-亚硝基乙醇胺类化合物的方法中产物收率低和难纯化[18,19],而Chaudhary等[20]发明的无催化剂和无溶剂条件下亚硝酸叔丁酯法合成亚硝胺的方法更为绿色高效而给我们启示。 本文将参考上述亚硝酸叔丁酯法合成3种乙醇胺的亚硝化产物,通过鉴定产物结构探讨其亚硝化历程;同时在后续亚硝酸法中以其作为基准物,评价3种乙醇胺形成亚硝胺的难易性;为更贴近实际情形,亚硝酸法中的亚硝化试剂采用亚硝酸盐[21]。
2.1.1 甲基单乙醇胺的亚硝化产物结构表征
图1给出了甲基单乙醇胺的亚硝化产物的FT-IR、ESI-MS、1H NMR和13C NMR;图1A中3391 cm-1附近为—OH的伸缩振动吸收峰,2950和2885 cm-1附近为—CH2的不对称和对称伸缩振动吸收峰,1443 cm-1处为—N—N=O的伸缩振动吸收峰,1333 cm-1附近为C—N的伸缩振动吸收峰,1067 cm-1附近为N—N的伸缩振动吸收峰;图1B中分子结合一个H+形成的[M-H]+质荷比为105.1,对应化合物相对分子质量为104;图1C中1H NMR, δ:4.91(s,1.09H;—OH),4.16(t, J=5.4 Hz,2.02H;—OCH2),3.77(s,0.83H;—CH3),3.70(t, J=5.3 Hz,1.99H;—NCH2),3.64(t, J=5.7 Hz,0.54H;—OCH2),3.48(t, J=5.6 Hz,0.54H;—NCH2),3.34(s,0.73H;—OH),和3.01(s,3.00H;—CH3);图1D中13C NMR, δ:60.15(s,—OCH2),58.92(s,—OCH2),56.11(s,—NCH2),48.21(s,—NCH2),40.80(s,—CH3)和32.76(s,—CH3)。
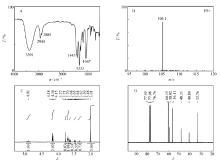 | 图1 甲基单乙醇胺的亚硝化产物的结构表征Fig.1 Structural characterization of the nitrosation product of methylethanolamine A.FT-IR; B.ESI-MS; C.1H NMR(DMSO); D.13C NMR(101 MHz,CDCl3) |
上述NMR结果表明,该分子内存在8种不同环境的H:其中 δ 4.91,4.16,3.70和3.01为一种异构体结构且四者的峰面积之比为1∶2∶2∶3,而 δ 3.77,3.64,3.48和3.34为另一种异构体结构且前三者的峰面积之比为3∶2∶2,但最后一个H不符合比例;以及6种不同环境的C:其中60.15(s),56.11(s)和32.76(s)为一种异构体结构,而58.92(s),48.21(s)和40.80(s)为另一种异构体结构。1H NMR的H质子积分结果显示两种异构体的比例约为78∶22,即使精馏分离获得单组份后,经过室温放置后1H NMR显示仍然维持几乎固定的异构体比例。这是由于不对称取代 N-亚硝基化合物存在如图2所示的两种异构化现象[20],当R1(CH2CH2OH)与R2基团(CH3)不同时,首先存在亚硝胺结构(Ⅰ)和(Ⅱ)的亚硝胺-重氮氢氧化物互变异构现象,其次因分子中N=N键的不可旋转性导致(Ⅱ)和(Ⅲ)的顺反异构现象。 由于R1和R2两侧位阻不同,故有利于(Ⅱ)和(Ⅲ)两种异构体中(Ⅲ)的比例居多[22],而分子内氢键的稳定作用有利于(Ⅲ)通过分子内氢键形成环状异构体(Ⅳ),因此形成的重氮氢氧化物环状异构体(Ⅳ)与亚硝胺异构体(Ⅰ)的物质量比约为4∶1,还可以解释(Ⅰ)的1H NMR中 δ 3.34的质子与其它质子不成比例源于自由羟基非定量出峰。 以上解析结果表明,甲基单乙醇胺的亚硝化产物为 N-亚硝基甲基单乙醇胺,与文献结果一致[23]。
2.1.2 二乙醇胺的亚硝化产物结构表征
对图3中二乙醇胺的亚硝化产物的FT-IR、ESI-MS、1H NMR和13C NMR表征图谱的解析结构如下所示:图3A中3372 cm-1附近为缔合—OH的伸缩振动吸收峰,2948和2887 cm-1附近为—CH2—的不对称和对称伸缩振动吸收峰,1450 cm-1处为—N—N=O的伸缩振动吸收峰,1358 cm-1附近为C—N的伸缩振动吸收峰,1052 cm-1附近为N—N的伸缩振动吸收峰;图3B中分子结合一个H+形成的[M-H]+质荷比为135.1,对应化合物相对分子质量为135;图3C中1H NMR, δ:4.86(s,2H;—OH),4.19(t, J=5.6 Hz,2H;—OCH2),3.72(t, J=5.6 Hz,2H;—OCH2),3.66(t, J=5.9 Hz,2H;—NCH2)和3.45(t, J=5.9 Hz,2H;—NCH2);图3D中13C NMR, δ:59.23(s,—OCH2),57.23(s,—OCH2),55.49(s,—NCH2)和46.96(s,—NCH2)。 以上解析结果表明,二乙醇胺的亚硝化产物为 N-亚硝基二乙醇胺,与文献[24]结果一致。
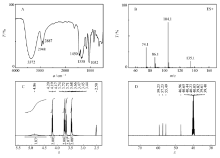 | 图3 二乙醇胺的亚硝化产物的结构表征Fig. 3 Structural characterization of the nitrosation products of diethanolamine A.FT-IR; B.ESI-MS; C.1H NMR(DMSO); D.13C NMR(101 MHz,DMSO) |
2.1.3 单乙醇胺的亚硝化产物产物结构表征及其亚硝化历程分析
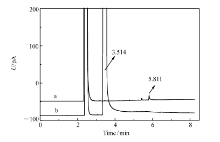
对纯化后的单乙醇胺的亚硝化产物进行ESI-MS、1H NMR和13C NMR表征,得到的图谱与 N-亚硝基二乙醇胺几乎相同,似乎表明单乙醇胺的亚硝化产物是 N-亚硝基二乙醇胺。图4A中将纯化后的单乙醇胺的亚硝化产物的FT-IR与图3A中 N-亚硝基二乙醇胺的FT-IR进行对比,几乎相同;在图4B的UPLC流出曲线中,将纯化后的单乙醇胺的亚硝化产物(a)与 N-亚硝基二乙醇胺(b)及纯化前的单乙醇胺的亚硝化反应混合物(c)进行对比,FT-IR和UPLC结果与上述结果共同证实单乙醇胺的亚硝化产物确实为 N-亚硝基二乙醇胺。 文献[25]曾从反应机理角度解释单乙醇胺的亚硝胺化反应会首先形成碳正离子并释放出N2,进一步转化为二乙醇胺,进而形成 N-亚硝基二乙醇胺;Eirik等[26]在单乙醇胺参与的模拟CO2吸收装置中也检测到 N-亚硝基二乙醇胺存在。 为了证明在单乙醇胺的亚硝化反应中得到的 N-亚硝基二乙醇胺来自于歧化反应产物二乙醇胺而非杂质二乙醇胺,本文用GC法测定了单乙醇胺原料中二乙醇胺杂质的含量,图5表明其质量分数低于0.022%,而图4B中UPLC结果表明,单乙醇胺与亚硝酸叔丁酯在45 ℃下避光反应8 h后生成的 N-亚硝基二乙醇胺需要由质量分数1.34%的二乙醇胺杂质完全反应才能获得。 综合已有文献报道[25,26]及本文实验结果,一方面说明单乙醇胺的亚硝化产物为 N-亚硝基二乙醇胺而不是预想中的 N-亚硝基单乙醇胺,另一方面证明单乙醇胺与亚硝酸叔丁酯的亚硝化反应产物 N-亚硝基二乙醇胺确实源于单乙醇胺经歧化反应新生成的产物二乙醇胺而非产自原料中的杂质二乙醇胺。
已有文献[27,28]报道,亚硝酸与胺的反应速率与亚硝酸浓度的二次方、胺浓度的一次方成正比,且温度升高,反应速率升高,pH值1~3时,随pH值增大反应速率下降。 将表1和表2中两种反应条件下3种乙醇胺形成相应亚硝胺的反应结果相比,可以发现:1) 以亚硝酸为亚硝化试剂时,高温和适宜pH值条件下乙醇胺类化合物更容易形成相应亚硝胺;2)当温度接近脂肪酸烷醇酰胺的生产温度(50 ℃)时,二乙醇胺对应的亚硝胺的生成率约为甲基单乙醇胺的2倍,而当温度接近人体温度(37 ℃)时,反应3 h后二乙醇胺对应的亚硝胺的生成率约为甲基单乙醇胺的6倍,因此条件越剧烈这种差距越缩小,进一步说明甲基单乙醇胺衍生产物在实际使用中更安全,而在2 h以内检测不到 N-亚硝化甲基单乙醇胺;3)两种实验条件下,单乙醇胺与亚硝酸反应生成亚硝胺的量均低于液相色谱检测限,即生成率低于0.0089%,说明几乎不形成亚硝胺因而最安全。 因此,表1和表2的结果比较表明,二乙醇胺最易形成亚硝胺,甲基单乙醇胺和单乙醇胺均不易形成亚硝胺。
| 表1 50 ℃时亚硝胺的生成率 Table 1 The yield of nitrosamine at 50 ℃ |
| 表2 37 ℃时亚硝胺的生成率 Table 2 The yield of nitrosamine at 37 ℃ |
从胺与亚硝酸发生亚硝化反应活性的角度看,胺作为亲核试剂与亚硝酸反应,胺分子的电负性越大,亚硝化反应活性越高[14]。 甲基单乙醇胺与二乙醇胺相比,—CH3的给电子能力低于—CH2CH2OH,因而其亚硝化反应活性远远低于二乙醇胺;而单乙醇胺作为伯胺并不直接生成亚硝胺,需要先转变为仲胺(上述已证明为二乙醇胺)后再形成亚硝胺,因而歧化反应限制使其亚硝化反应活性最低。 从上述乙醇胺类化合物结构与其亚硝化反应活性之间的关系,我们可以推断电负性较大的仲胺易形成亚硝胺,而伯胺与仲胺相比更不易形成亚硝胺。从产物的稳定性而言, N-亚硝基二乙醇胺左右两侧 β位—OH均可以与N形成分子内氢键,其产物稳定性增加故更易于形成亚硝胺;而 N-亚硝基甲基单乙醇胺只有一侧可形成分子内氢键,故产物稳定性低于 N-亚硝基二乙醇胺。 综上所述,从反应活性及产物稳定性两方面考虑,都支持二乙醇胺最易于形成亚硝胺,甲基单乙醇胺次之,而单乙醇胺最不易形成亚硝胺的实验结果。
本文用两种方法合成亚硝胺,首先由亚硝酸叔丁酯法获得两种亚硝胺的基准物并用于后续分析检测;其次用亚硝酸作为亚硝化试剂,研究了甲基单乙醇胺、单乙醇胺形成亚硝胺的难易程度,并与二乙醇胺比较。 本文实验结果表明,二乙醇胺或甲基单乙醇胺均直接形成相应的亚硝胺,而单乙醇胺通过歧化反应生成二乙醇胺继而形成少量 N-亚硝基二乙醇胺;与甲基单乙醇胺或单乙醇胺相比,二乙醇胺更容易生成亚硝胺,因此用甲基单乙醇胺或单乙醇胺替代二乙醇胺为原料,可以减少有害性亚硝胺的产生。 本文的结果和结论支持目前在表面活性剂生产和应用中用脂肪酸甲基单乙醇酰胺或脂肪酸单乙醇酰胺替代脂肪酸二乙醇酰胺的趋势,具体品种选择还需视对增稠和稳泡的需求而定。 因此,本文的研究结果为评判乙醇胺类化合物是否易于形成亚硝胺,保证人类生命健康安全提供理论指导。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|