为进一步发现氟喹诺酮药物向抗肿瘤活性转化的结构修饰新策略,用酰氨基为左氧氟沙星(1)C-3羧基的电子等排体,5-芳苄叉基饶丹宁为其功能修饰基,设计合成了 N-(5-芳苄叉基饶丹宁)左氧氟沙星酰胺类目标化合物(6a-6n)。 体外抗肿瘤活性结果表明,所合成的14个化合物的活性均强于母体左氧氟沙星,且对正常细胞表现出较低的细胞毒性作用。 构效关系表明,增大芳基取代基的体积或供电性均导致抗肿瘤活性的明显降低,反之,吸电子取代苯基或芳香杂环类目标化合物的抗肿瘤活性强于其他取代基类。 其中,硝基化合物6l、呋喃6m和吡啶6n对人胰腺癌细胞株(Capan-1)的半数抑制浓度(IC50) 与对照抗肿瘤药阿霉素(1.6 μmol/L)相当,分别为1.8、0.8和1.3 μmol/L。 因此,芳苄叉基饶丹宁修饰的酰氨基替代C-3羧基有利于提高氟喹诺酮的抗肿瘤活性。
To develope an efficiently structural modification strategy for transforming antibacterial fluoroquinolone into antitumor agent, novel N-arylidene arylidene rhodanine levofloxacin amide derivatives(6a-6n) were synthesized via amide modification with functionalized arylidene rhodanine scaffold as the bioisostere of the C-3 carboxylic group. The in vitro antitumor assay indicated that the title compounds exhibited more significant potency against three test cancer cell lines than levofloxacin, but with lower cytotoxicity against the normal cells than doxorubicin as a comparison. The SAR(structure-activity relationship) reveals that the increase in the bulky or electron-donating substituents bearing phenyl ring obviously reduces the antitumor activity. Conversely, compounds with electron-withdrawing nitro- or fluorophenyl or heteroaromatic rings such as furan or pyridine ring display comparable activity to doxorubicin. Thus, an amide group modified by arylidene rhodanine scaffold as an isostere of the C-3 carboxylic acid group appears to an alternative route for further design of antitumor fluoroquinolone.
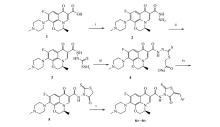
基于五元唑杂环作为重要的药效团而被广泛应用参与构建具有药理活性的化合物库,尤其以2-硫代噻唑烷-4-酮为优势骨架的饶丹宁唑杂环因其独特的化学结构在药物分子构建中备受关注[1]。 其中,对饶丹宁环的结构修饰主要包括3-位N原子引入极性侧链以增加水溶性而提高其生物利用度[2],及对5-位活泼亚甲基(—CH2)进行羟醛缩合反应形成叉基并与4-羰基构筑 α, β-不饱和酮结构[3]。 鉴于所构建的3-取代-5-叉基饶丹宁骨架不仅含有理化性质各异的N、O、S供电子原子可与大分子靶点以氢键或静电形式相结合而产生多种生物活性,而且其 α, β-不饱和酮结构也是许多天然有效成分如查尔酮和黄酮类的特征药效团结构[4],同时也作为重要的有机合成子易与大分子靶点的供电子基发生迈克尔加成反应而产生细胞毒作用发展新型抗肿瘤化学治疗剂[5]。 另一方面,基于机制或结构理性药物设计策略,以抗菌氟喹诺酮(FQ)的作用靶标—拓扑异构酶为靶点及其“喹啉-4-酮-3-羧基”为药效骨架结构,利用药物化学结构修饰方法可将其抗菌活性转化为抗肿瘤活性,拓展氟喹诺酮药物研究的新领域[6],并发现C-3羧基并非是抗肿瘤活性所必需的药效团,用唑杂环[7]或唑稠杂环[8]替代可提高其抗肿瘤活性。 与此同时,鉴于电子等排体替代是产生新导物最经济有效的药物化学修饰手段,考虑到氨基(—NH2)与羟基(—OH)互为经典的电子等排体,导致酰氨基(—CONH2)与羧基(—COOH)也互为电子等排体,然而,用酰胺基作为FQ C-3羧基的电子等排体、叉基饶丹宁作为其修饰基,构建氟喹诺酮(饶丹宁不饱和酮)酰胺类抗肿瘤化合物的尝试尚未见报道。 为此,鉴于叉基饶丹宁独特的结构特征及其在抗肿瘤药物分子构建中的重要性,本文以酰氨基为左氧氟沙星C-3羧基的电子等排体,叉基饶丹宁骨架为其功能修饰基,构建了 N-芳苄叉基饶丹宁氟喹诺酮C-3酰胺类目标化合物(6a-6n),合成路线见Scheme 1。 试图通过优势骨架的拼合实现活性的叠加效应和理化性质的互补以促进其药效学和药动学性质的改善,为氟喹诺酮的进一步结构修饰提供新思路。
左氧氟沙星(1)为市售品,左氧氟沙星酰肼(2)按文献[9]中的合成方法制备,所用其它试剂均为市售分析纯;实验所用人肝癌细胞株(SMMC-7721)、人胰腺癌细胞株(Capan-1)和人白血病细胞株(HL60)均购自中科院上海细胞生物研究所;正常细胞为非洲绿猴肾细胞株(VERO)购自上海通派生物科技有限公司。
WK-1B型数字熔点仪(上海申光仪器有限公司);AM-400型核磁共振波谱仪(NMR,德国Bruker公司);Esquire LC型质谱仪(MS,德国Bruker公司);PE2400-Ⅱ型元素分析仪(美国Perkin-Elmer公司);RAD-680型酶标仪(美国Bio-Rad公司)。
1.2.1 ( S)-6-氟-7-(4-甲基-哌嗪-1-基)-8,1-(1,3-氧丙基)- N-饶丹宁-3-基-喹啉-4(1 H)-酮-3-甲酰胺(5)
10.0 g(27.0 mmol)悬浮于95%乙醇(50 mL)和浓氨水(25 mL)混合溶剂中,冰浴搅拌下慢慢滴加二硫化碳(3.0 g,40.0 mmol),常温搅拌反应5 h。 滤集固体,用冰水和无水乙醇依次洗涤固体,干燥,得白色粉末粗品左氧氟沙星酰肼二流代甲酸铵盐(3)11.0 g。 将中间体3溶于蒸馏水(50 mL),常温滴加氯乙酸钠(3.1 g,27.0 mmol)水溶液(20 mL)约1 h。 常温搅拌至原料消失,用浓盐酸慢慢调pH=2.0,回流反应6 h。 冷却至室温,用浓氨水慢慢调pH=7.0,放置析出固体。 过滤,水洗,干燥。 用甲醇-氯仿重结晶,得淡黄色结晶 N-饶丹宁-3-基左氧氟沙星酰胺(5) 7.6 g,收率58.0%,mp 183185 ℃;1H NMR(CDCl3,400 MHz), δ:12.84(s,1H,CONH),8.81(s,1H,2-H),7.60(d, J=12.0 Hz,1H,5-H),4.874.43(m,3H,OCH2CHN),3.52(s,2H,SCH2),3.463.24(m,8H,piperazine-H),2.81(s,3H,N—CH3),1.44(d, J=6.0 Hz,3H,CH3);ESI-MS ( m/z):492[M+H]+,计算值:491[M]+。
1.2.2 6-氟-7-(4-甲基-哌嗪-1-基)-8,1-(1,3-氧丙基)- N-[5-芳苄叉基-饶丹宁-3-基]-喹啉-4(1 H)-酮-3-甲酰胺(6a-6n)的合成通法
1.0 g(2.0 mmol)中间体5、0.22 g(2.0 mmol)苯甲醛和0.33 g(4.0 mmol)无水乙酸钠溶于冰乙酸(20 mL)中,混合反应物搅拌回流反应12 h。 减压蒸除溶剂,加去离子水50 mL和适量的活性炭,回流脱色1 h。 热过滤,用浓氨水碱化pH值9.010.0,二氯甲烷(30 mL×3)提取,合并有机相,饱和食盐水(30 mL×3)洗涤,无水硫酸钠干燥。 柱层析纯化( V(二氯甲烷): V(甲醇)=30:1),得黄色固体6-氟-7-(4-甲基-哌嗪-1-基)-8,1-(1,3-氧丙基)- N-(5-苯苄叉基-饶丹宁-3-基)-喹啉-4(1 H)-酮-3-甲酰胺(6a)目标化合物,收率68.5%,mp 187189 ℃。 分别用取代苯甲醛或芳香醛替代苯甲醛,按照化合物6a相同的制备方法分别制得化合物6b-6n。
化合物6a:收率68.5%,mp 187189 ℃;1H NMR(CDCl3,400 MHz), δ:12.37(s,1H,CONH),8.88(s,1H,2-H),7.72(br,1H,5-H),7.397.14(m,6H,Ph—H和=C—H),4.714.29(m,3H,OCH2CHN),3.27(br,4H,piperazine-H),2.50(br,4H,piperazine-H),2.31(s,3H,N—CH3),1.40(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):580[M+H]+,计算值:579[M]+。 元素分析(C28H26FN5O4S2计算值)/%:C 58.25(58.02),H 4.32 (4.52),N 12.32 (12.08)。
化合物6b:收率57.5%,mp 174176 ℃;1H NMR(CDCl3,400 MHz), δ:12.35(s,1H,CONH),8.87(s,1H,2-H),7.76(br,1H, =C—H),7.457.23(m,5H,Ph—H和5-H),4.684.26(m,3H,OCH2CHN),3.30(br,4H,piperazine-H),2.52(br,4H,piperazine-H),2.32,2.37 (2s,6H,N—CH3和Ph—CH3),1.39(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):594[M+H]+, 计算值:593[M]+。 元素分析(C29H28FN5O4S2计算值)/%:C 58.92(58.67),H 4.58(4.75),N 12.03(11.80)。
化合物6c:收率52.4%,mp 170172 ℃;1H NMR(CDCl3,400 MHz), δ:12.37(s,1H,CONH),8.88(s,1H,2-H ),7.78(br,1H,5-H),7.537.15(m,5H,Ph—H和=C—H),4.724.28(m,3H,OCH2CHN),3.27(br,4H,piperazine-H),2.53(br,4H,piperazine-H),2.32,2.41 (2s,6H,N—CH3和Ph—CH3),1.40(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):594[M+H]+,计算值:593[M]+。 元素分析(C29H28FN5O4S2计算值)/%:C 58.91(58.67),H 4.53(4.75),N 12.05(11.80)。
化合物6d:收率62.8%,mp 184186 ℃;1H NMR(CDCl3,400 MHz), δ:12.42(s,1H,CONH),8.93,7.78 (2s,2H,2-和5-H),7.507.00(m,5H,Ph—H和=C—H),4.774.37(m,3H,OCH2CHN),3.88(s,3H,OCH3),3.36(br,4H,piperazine-H),2.56(br,4H,piperazine-H),2.35(s,3H,N—CH3),1.48(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):610[M+H]+,计算值:609[M]+。 元素分析(C29H28FN5O5S2计算值)/%:C 57.35 (57.13),H 4.42 (4.63),N 11.72 (11.49)。
化合物6e:收率56.3%,mp 178180 ℃;1H NMR(CDCl3,400 MHz), δ:12.38(s,1H,CONH),8.70,8.18 (2s,2H,2-和5-H),7.656.95(m,5H,Ph—H和=C—H),4.654.36(m,3H,OCH2CHN),3.93(s,3H,OCH3),3.44(br,4H,piperazine-H),2.65(br,4H,piperazine-H),2.44(s,3H,N—CH3),1.57(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):610[M+H]+,计算值:609[M]+。 元素分析(C29H28FN5O5S2计算值)/%:C 57.37(57.13),H 4.46(4.63),N 11.70(11.49)。
化合物6f:收率80.5%,mp 223225 ℃;1H NMR(CDCl3,400 MHz), δ:12.43(s,1H,CONH),9.05(s,1H,2-H ),7.65 6.83(m,5H, =C—H、5-H和Ph—H),6.06(s,2H,OCH2O),4.854.37(m,3H,OCH2CHN),3.34(br,4H,piperazine-H),2.56(br,4H,piperazine-H),2.37(s,3H,N—CH3),1.47(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):624[M+H]+,计算值:623[M]+。 元素分析(C29H26FN5O6S2计算值)/%:C 56.07(55.85),H 4.36(4.20),N 11.45(11.23)。
化合物6g:收率62.8%,mp 181183 ℃;1H NMR(CDCl3,400 MHz), δ:12.41(s,1H,CONH),8.92,7.78 (2s,2H,2-和5-H),7.63 7.16(m,4H, =C—H和Ph—H),4.834.35(m,3H,OCH2CHN),3.87,3.85(2s, 6H,2(OCH3),3.32(br,4H,piperazine-H),2.55(br,4H,piperazine-H),2.36(s,3H,N—CH3),1.45(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):640[M+H]+,计算值:639[M]+。 元素分析(C30H30FN5O6S2计算值)/%:C 56.57(56.33),H 4.52(4.73),N 11.17(10.95)。
化合物6h:收率53.7%,mp 217219 ℃;1H NMR(CDCl3,400 MHz), δ:12.48(s,1H,CONH),8.95,7.70 (2s,2H,2-和5-H),7.28 6.70(m,3H, =C—H和Ph—H),4.804.39(m,3H,OCH2CHN),3.93,3.92 (2s,9H,3×OCH3),3.37(br,4H,piperazine-H),2.57(br,4H,piperazine-H),2.38(s,3H,N—CH3),1.47(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):670[M+H]+,计算值:669[M]+。 元素分析(C31H32FN6O7S2计算值)/%:C 55.84(55.59),H 4.63(4.82),N 10.71(10.46)。
化合物6i:收率65.7%,mp 180182 ℃;1H NMR(CDCl3,400 MHz), δ:12.47(s,1H,CONH),9.01(s,1H,2-H),7.75(d, J=12.0 Hz,1H,5-H),7.477.15(m,5H, =C—H和Ph—H),4.824.37(m,3H,OCH2CHN), 3.34(br,4H,piperazine-H),2.55(br,4H,piperazine-H),2.38(s,3H,N—CH3),1.47(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):598[M+H]+,计算值:597[M]+。 元素分析(C28H25F2N5O4S2计算值)/%:C 56.52(56.27),H 4.38(4.22),N 11.74(11.72)。
化合物6j:收率62.3%,mp 186188 ℃;1H NMR(CDCl3,400 MHz), δ:12.47(s,1H,CONH),9.00(s,1H,2-H),7.72(d, J=12.0 Hz,1H,5-H),7.397.14(m,5H, =C—H和Ph—H),4.814.37(m,3H,OCH2CHN), 3.33(br,4H,piperazine-H),2.55(br,4H,piperazine-H),2.37(s,3H,N—CH3),1.46(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):614[M+H]+, 计算值:613[M]+(35Cl)。 元素分析(C28H25ClFN5O4S2计算值)/%:C 54.53(54.76),H 4.32(4.10),N 11.66(11.40)。
化合物6k:收率76.0%,mp 183185 ℃;1H NMR(CDCl3,400 MHz), δ:12.38(s,1H,CONH),8.81(s,1H,2-H),7.73 7.23(m,6H, =C—H、5-H和Ph—H),4.864.38(m,3H,OCH2CHN),3.38(br,4H,piperazine-H),2.57(br,4H,piperazine-H),2.38(s,3H,N—CH3),1.52(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):660,658[M+H]+,计算值:659,657[M]+(81Br,79Br)。 元素分析(C28H24BrFN5O4S2计算值)/%:C 51.34(51.57),H 3.68(4.03),N 13.62(13.45)。
化合物6l:收率53.6%,mp 197199 ℃;1H NMR(CDCl3,400 MHz), δ:12.58(s,1H,CONH),9.01(s,1H,2-H),7.77(d, J=12.0 Hz,1H,5-H),7.477.15(m,5H, =C—H和Ph—H),4.824.37(m,3H,OCH2CHN),3.34(br,4H,piperazine-H),2.55(br,4H,piperazine-H),2.38(s,3H,N—CH3),1.47(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):624[M+H]+, 计算值:623[M]+。 元素分析(C28H25FN6O6S2计算值)/%:C 54.17(53.94),H 3.62(3.88),N 13.72(13.48)。
化合物6m:收率62.4%,mp 232234 ℃;1H NMR(CDCl3,400 MHz), δ:12.62(s,1H,CONH),9.07(s,1H,2-H),8.877.42(m,6H, =C—H,5-H和Py—H),4.874.38(m,3H,OCH2CHN),3.36(br,4H,piperazine-H),2.57(br,4H,piperazine-H),2.38(s,3H,N—CH3),1.52(d, J=6.0 Hz,3H,CH3);ESI-MS( m/z):581[M+H]+,计算值:580[M]+。 元素分析(C27H25FN6O4S2计算值)/%:C 56.06(55.85),H 4.18(4.34),N 14.68(14.47)。
化合物6n:收率57.6%,mp 214216 ℃;1H NMR(CDCl3,400 MHz), δ:12.56(s,1H,CONH),8.92(s,1H,2-H),8.327.36(m,6H, =C—H,5-H和Py—H),4.864.36(m,3H,OCH2CHN),3.34(br,4H,piperazine-H),2.56(br,4H,piperazine-H),2.37(s,3H,N—CH3),1.50(d, J=6.0 Hz,3H,CH3);ESI-MS ( m/z):587[M+H]+, 计算值:586[M]+。 元素分析(C26H24FN5O4S3计算值)/%:C 53.45(53.23),H 4.18(4.42),N 12.18(11.96)。
对合成的14个新C-3(5-芳苄叉基饶丹宁)酰胺(6a-6n)目标化合物和对照蒽醌类抗肿瘤药阿霉素(Doxorubicin)及母体左氧氟沙星(1)计16个供试样品,用二甲基亚砜(DMSO)配成1.0×10-2 mol/L浓度的储备液,测试前用培养液稀释成具有5个浓度梯度(0.1、1.0、5.0、10.0、50.0×10-6 mol/L)的工作液。 取对数生长期的SMMC-7721、Panc-1和HL60及VERO细胞株,分别以每孔7000个细胞接种于96孔板,培养隔夜后,分别加入上述16个供试样品的具有5个浓度梯度的工作液,继续培养48 h弃去培养基。 每孔加入1 g/L 3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑溴盐(MTT)溶液100 μL,继续培养4 h后弃去上清液。 每孔加入150 μL DMSO,轻轻振荡30 min,用酶标仪在570 nm波长处测定各自的吸光度(OD)值。 计算各自组不同浓度的供试样品对实验细胞的抑制率:细胞抑制率=[(1-实验组OD值/对照组OD值)]×100%。 然后以各供试样品浓度的负对数值对各浓度下的抑制率作图,得出浓度—效应方程,以此计算出各供试样品对实验细胞的半数抑制浓度(IC50)。 所有实验在相同的条件下重复3次,最终结果以Mean±SD表示。
左氧氟酰肼(2)的末端氨基在氨性介质中与CS2缩合生成相应的C-3酰肼二硫代甲酸铵(3),分离出的粗品3与氯乙酸钠发生亲核取代反应生成相应的C-3酰肼硫代甲酸硫代乙酸钠盐(4),不经分离直接在酸性水溶液中发生分子内环合到C-3(饶丹宁)酰胺中间体5。 试图对3不经分离直接在碱性介质中与氯乙酸钠取代反应到4,但仅得到收率较低(≈15%)的预期产物4,母液可分离得到C-3噁二唑硫醇[9],表明,在碱性介质中4易离去一分子的巯基乙酸而发生分子内环合到C-3噁二唑硫醇。 分离纯化的噻唑烷酮饶丹宁中间体5在HOAc-NaOAc体系中与芳香醛可顺利发生Claisen-Schmidt缩合反应形成芳苄叉基进而构筑C-3(5-芳苄叉基饶丹宁)酰胺目标物6。 同时,粗品4与芳香醛在HOAc-NaOAc体系中反应也可得到预期产物6,说明4在弱酸性介质中也可发生羧基与氨基的脱水闭环反应到 γ-内酰胺饶丹宁环。 为此,中间体4在碱性介质中以羰基O为亲核试剂发生分子内闭环反应可生成C-3噁二唑硫醇,而在酸性介质中以氨基与羧基间的脱水闭环形成饶丹宁环。
分析产物的核磁测试结果可知,中间体4在化学位移12.84和8.81处出现的单质子单峰化学位移峰分别归属于酰胺(CONH)和喹啉骨架2-位(2-H)质子,而在7.60处出现的单质子双峰化学位移峰可归属于喹啉骨架5-位(5-H)质子,高场3.50处的双质子单峰化学位移峰可归属饶丹宁环的亚甲基(S-CH2)质子, N-甲基哌嗪和甲基恶嗪环各骨架对应的化学位移峰与母体左氧氟沙星相似。 目标物6与4相比较,除3.50处的亚甲基(S-CH2)质子峰消失和出现新的取代苯环或芳香杂环化学位移峰外,在7.30处出现的单质子单峰化学位移峰可归属为叉甲基(=C—H)质子。 另外,目标物6的MS谱图均出现稳定的分子离子峰,其 m/z值与分子组成计算值相吻合,进一步确证了目标物的结构[10]。
16个供试化合物的体外抗细胞增殖活性结果(表1)表明,14个目标化合物对3种试验肿瘤细胞株的IC50(<40 μmol/L)值均低于对照左氧氟沙星(IC50>100 μmol/L)和阿霉素(IC50<3.0 μmol/L),其中化合物6i、6l、6m、6n对Capan-1细胞的IC50与对照抗肿瘤药阿霉素相当。 有意义的是,14个目标化合物对VERO细胞的IC50(>40 μmol/L)显著低于对照阿霉素(IC50<4.0 μmol/L),显示出较强的选择性。 与此同时,构效关系表明,饶丹宁5-芳苄叉基的苯环带有供电子基,如甲氧基或甲基化合物,其活性低于吸电子基卤素或硝基取代化合物,尤其是强吸电子硝基(NO2)化合物(6l)对3种癌细胞的IC50均在微摩尔浓度,活性优于对照阿霉素;同时,随着苯环取代基体积的增大可导致活性降低,如三甲氧苯基化合物(6h)活性均低于其它化合物。 另外,当苯环被芳香杂环替代,如呋喃(6m)或吡啶(6n)类化合物,对3种实验癌细胞的IC50均在微摩尔浓度(1.0×10-6 mol/L),与硝基苯类化合物(6l)的活性相当。 同时,无论是卤代苯类或硝基苯类或芳香杂环类目标物,其对VERO的IC50值远高于对癌细胞及对照阿霉素,表现对肿瘤细胞有较强的选择性,具有潜在的成药性研究价值。
| 表1 目标化合物(6a-6n)对SMMC-7721、Capan-1和HL60肿瘤细胞的抗肿瘤活性 Table 1 Antitumor activity of the tested compounds(6a-6n) against SMMC-7721, Capan-1 and HL60 tumor cells |
基于氟喹诺酮的作用靶标—拓扑异构酶及其优势骨架“喹啉-4-酮-3-羧酸”,用酰氨基作为C-3羧基的电子等排体、5-芳苄叉基饶丹宁为其功能修饰基,合成了5-芳苄叉基饶丹宁酰胺类左氧氟沙星衍生物,体外抗肿瘤实验结果表明,芳苄叉基中的芳基为卤代苯基或硝基苯基或芳香杂环呋喃或吡啶基等化合物,其抗肿瘤活性强于其它取代基,且对正常细胞表现出较低的毒性,推猜增加芳环的吸电子效应可活化叉基的亲电性,有利于与大分子靶点发生迈克尔加成反应而增加抗肿瘤作用。 为此,芳苄叉基噻唑酮修饰的酰胺替代C-3羧基可能是抗肿瘤氟喹诺酮分子构建的有效方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|