建立了一种简单高效的毛细管电色谱-电喷雾-飞行时间/质谱(CEC-ESI-TOF/MS)联用技术分离混合氨基酸对映体的方法。 以 D, L-精氨酸、 D, L-缬氨酸和 D, L-谷氨酸为研究对象,通过优化CEC分离条件和MS检测条件,3种混合氨基酸对映体的6个组分在15 min内实现了分离,分离度分别为3.03、1.59和1.37。 该方法为混合对映体的分离分析提供了参考方法和基础数据。
A simple and efficient capillary electrochromatography-electrospray- time of flight/mass spectrometry(CEC-ESI-TOF/MS) method for the separation and analysis of mixed amino acid enantiomers was established. D, L-arginine, D, L-valine, and D, L-glutamate acid were taken as the research objects. By optimizing the CEC separation conditions and MS detection conditions, the six components of the three mixed amino acid enantiomers were separated within 15 min, and the resolutions were 3.03, 1.59 and 1.37, respectively. It provides a reference method for the separation and analysis of mixed enantiomers.
氨基酸是构成蛋白质的基本单元,大多数氨基酸存在生理活性不同的 D、 L型两种对映体[1,2]。 常见的 L-氨基酸是多肽和蛋白质结构的重要组成部分,而 D-氨基酸在人体内的含量超过一定时会引起一些重要的生理疾病(如:阿尔兹海默症、精神分裂症等)[3]。 实际生活中大多数氨基酸都不是单一存在的,因此,建立高效的混合氨基酸对映体分离分析方法具有重要的研究意义。 尽管已经开发了许多混合氨基酸对映体分离分析的方法,例如气相色谱-质谱(GC-MS)联用技术[4],液相色谱-质谱(LC-MS)联用技术[5,6],液相色谱-荧光检测(LC-FLD)技术[7]等,但这些分析方法在分离前大多数都需要对样品进行衍生化处理,步骤复杂且样品用量大。 毛细管电色谱-质谱(CEC-MS)联用技术综合了CEC的高效快速、高分离能力与MS的高灵敏度与较强的定性能力等特点,一次分析中可以同时得到的样品离子的迁移时间、相对分子质量和碎片等信息,分离前无需对样品进行衍生化处理,分析方法简单,样品用量少。 可用于鉴别重叠峰甚至未被完全分离的混合物,并且具有较高灵敏度,已成为手性分离分析的一种强有力方法[8,9,10]。
β-环糊精( β-CD)及其衍生物( β-CDs)是一种常用的色谱手性固定相,在手性拆分领域应用广泛。 Wang等[11]制备了同时具有甲氧基烷烃和氨基的 β-CD衍生物(mono-6A-(4 -methoxybutylamino)-6A- β-CD),并将其作为手性添加剂,利用毛细管电泳法(CE)实现了3种氨基酸对映体的手性分离。 李英杰等[12]制备了烯丙基- β-环糊精聚合物毛细管整体柱,在CEC模式下成功拆分了18种氨基酸对映体。 Al-Hussin等[14]利用含七(2,3-二- O-乙酰基-6- O-磺基)- β-环糊精(HS βCD)的酰氨基丙基三甲基氯化二乙烯基苯(APAT-DVB)聚合物多孔层开管(PLOT)毛细管柱,采用CEC技术实现了 D, L-天冬氨酸, D, L-酪氨酸以及 D, L-赖氨酸混合对映体的分离。 可见, β-环糊精及其衍生物作为色谱固定相在氨基酸对映体分离领域具有一定的潜力。
基于上述研究现状,本文利用自制的烯丙基咪唑鎓- β-环糊精(AI- β-CD)毛细管电色谱整体柱作为手性分离柱,应用CEC-ESI-TOF/MS技术以3种混合氨基酸对映体( D, L-精氨酸、 D, L-缬氨酸、 D, L-谷氨酸)为分离对象,拟建立一种简单高效的混合氨基酸对映体拆分检测方法。
7100 CE-6230 ESI-TOF/MS型毛细管电泳-飞行时间质谱联用仪(美国安捷伦公司),电喷雾双离子源(dual ESI),鞘流液由1260 Infinity单元泵提供;SpecctrumOne型傅里叶变换红外光谱仪(FTIR,美国Perkin-Elmer公司);S-4300型扫描电子显微镜(SEM,日本日立公司)。
D, L-精氨酸、 D, L-缬氨酸和 D, L-谷氨酸购自北京化学试剂有限公司(纯度>98%);甲醇和醋酸铵购自美国Mreda公司,色谱纯;其它试剂均为色谱纯,实验用水均为超纯水。
AI- β-CD整体柱的制备参照文献[16]的方法,分别用1 mol/L HCl溶液、超纯水、1 mol/L NaOH溶液和硅烷化试剂( V(KH570): V(丙酮)=1:1)预处理毛细管柱。 40 ℃水浴反应24 h,甲醇冲洗,N2气吹干,待用。 然后称取0.060 g乙二醇二甲基丙烯酸酯(EDMA)、0.090 g甲基丙烯酸缩水甘油酯(GMA)、0.25 g环己醇、0.50 g正十二醇、0.0012 g偶氮二异丁腈(AIBN)、0.2 mL AI- β-CD的二甲基亚砜(DMSO)溶液(0.15 g/mL),超声混匀,将该混合物填充到预处理的毛细管中,填充毛细管有效长度为26.5 cm。 两端封口,45 ℃水浴反应24 h后用甲醇冲洗。 获得AI- β-CD毛细管电色谱整体柱。
色谱柱:AI- β-CD电色谱整体柱(总长120 cm,有效长度26.5 cm);缓冲溶液为20 mmol/L的NH4Ac;分离电压为15 kV;运行柱温为20 ℃;压力进样5×103 Pa×3 s;检测波长200 nm。
离子源为dual ESI,采用负离子全扫描方式在 m/z 50~200范围内扫描,毛细管电压4.0 kV,雾化气压力2.4×105 Pa,干燥气为N2气(纯度99.999%):温度300 ℃,流速8 L/min;鞘流液为50%CH3OH( V(CH3OH): V(H2O)=1:1),流速为0.6 mL/min。
2.1.1 整体柱扫描电子显微镜表征
通过扫描电子显微镜观察AI- β-CD整体柱内固定相的形貌特征,如图1所示。图1A和1B分别为整体柱横截面和整体柱局部横截面SEM照片。 从图1可以看出,整体柱内固定相具有均匀的网状结构,从而保证了整体柱具有良好的通透性。 柱内固定相与柱壁键合紧密使该整体柱具有良好的机械强度和稳定性。
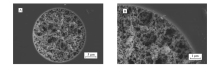 | 图1 整体柱固定相扫描电子显微镜照片Fig.1 Scanning electron micrographs of the stationary phase in a monolithic column A.Cross section of the monolithic column; B.Partial section of the monolithic column |
2.1.2 元素分析表征分析
对空毛细管柱、AI- β-CD整体柱进行了元素分析表征,得到了C、H和N的质量分数,结果见表1。
| 表1 整体柱固定相元素分析 Table 1 Elemental analysis of the stationary phase in the monolithic column |
由表1可知,空毛细管柱与AI- β-CD整体柱相比C的质量分数差异显着,分别从8.32%增加到11.87%,此外,H的质量分数从0.25%增加到0.72%,N的质量分数从0.70%增加到0.87%。 元素分析结果说明在毛细管柱内成功键合了AI- β-CD。 由表1计算出该AI- β-CD整体柱内单位面积AI- β-CD的量为3.02 mmol/m2。
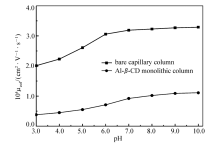
电渗流(EOF)作为CEC中流动相的驱动力,在样品的分离分析过程中起着重要的作用,稳定的EOF能使分离效果更佳[14]。 然而EOF的大小受缓冲溶液pH的影响很大。
本文采用1.3节中的CEC分离条件,研究了pH值范围为3.0~10.0的空毛细管柱和AI- β-CD整体柱的EOF值。 EOF随pH的变化类似于强碱滴定弱酸的滴定曲线。 如图2所示,无论是空毛细管柱还是AI- β-CD整体柱,EOF均呈逐渐增加的趋势,在pH<4.0或pH>7.0时,EOF随pH变化较平缓,pH值在4.0~7.0之间,EOF变化很快,甚至呈现“突跃”。 对于空毛细管柱而言,EOF主要是由毛细管内壁Si-OH的解离而产生。 随着缓冲溶液pH增加,SiO-解离数量增多,Zeta电势增加,导致EOF变大[15]。 反之,pH值减小,EOF减小。 而整体柱EOF的产生主要归因于AI- β-CD表面的—OH解离,由于AI- β-CD的—OH解离数量小于空柱内壁Si—OH的解离数量,导致整体柱的EOF始终低于空柱;且AI- β-CD整体柱的EOF与空毛细管柱的EOF相比“突跃”更小,更加稳定。 该结果表明AI- β-CD整体柱在对映体拆分方面具有更佳的分离效果。
以硫脲为标记物,柱效及柱效相对标准偏差(RSD)为评价指标对整体柱的性能进行评价。 采用1.3节的CEC运行条件,缓冲溶液pH=7.0,实验重复次数均为5次,评价结果见表2。 结果表明,该整体柱柱内,日间和柱间的平均柱效均达到62123 plates/m以上,RSD均小于2.00%,说明该AI- β-CD整体柱具有良好的稳定性和重现性。
| 表2 整体柱性能评价 Table 2 Performance evaluation of monolithic columns |
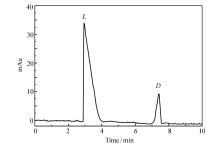
为考察整体柱的手性分离能力,应用所制备的整体柱对 D, L-组氨酸进行手性拆分。 在缓冲溶液pH=5.0,1.4节的CEC运行条件下, D, L-组氨酸在8 min内达到基线分离,其分离度为3.56,表明该整体柱具有良好的手性分离能力。 典型的色谱分离图如图3所示。
2.4.1 缓冲溶液pH的考察
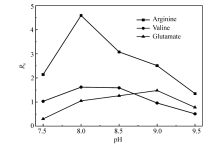
选择碱性 D, L-精氨酸、中性 D, L-缬氨酸和酸性 D, L-谷氨酸3种混合氨基酸的对映体为研究对象,以分离度( Rs)为评价指标,考察了缓冲溶液pH值范围7.5~9.5对混合氨基酸对映体分离的影响。 如图4所示,随着缓冲溶液pH值的增加,3种氨基酸对映体的 Rs均呈现先增大后减小的趋势。 其中精氨酸和缬氨酸在pH=8.0时分离度最大( Rs>1.5),谷氨酸在pH=9.0时分离度达到最大(1< Rs<1.5)。 当缓冲溶液pH值为8.0和8.5时3种氨基酸的 Rs均大于1,且精氨酸和缬氨酸 Rs均大于1.5(表3)。 但使用pH=8.0的缓冲溶液时,精氨酸的 D型对映体与缬氨酸的 L型对映体峰会有部分重叠(见辅助材料图S1)。 而当pH=9.0时,尽管谷氨酸对映体能更好地分离,但缬氨酸对映体的 Rs<1。 所以,综合分析,最终确定pH=8.5为缓冲溶液最佳pH值。
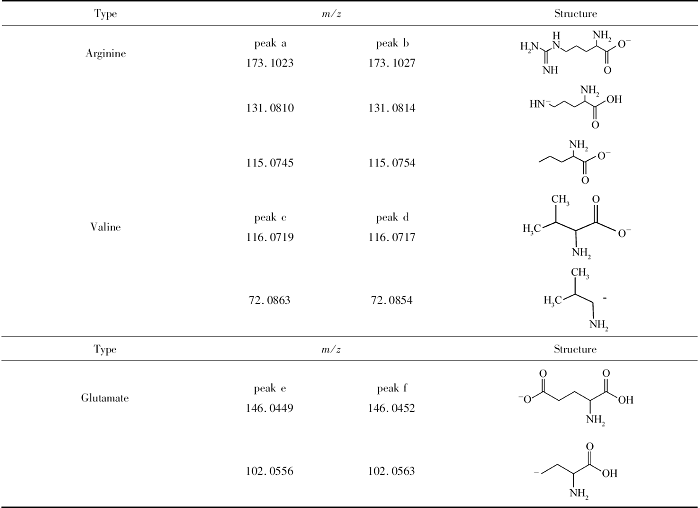
| 表3 D, L-精氨酸、 D, L-缬氨酸和 D, L-谷氨酸碎片分析 Table 3 Debris analysis of D, L-Arginine, D, L-Valine and D, L-Glutamate |
由CEC分离机理可知,样品出峰顺序依次为带正电的粒子、中性粒子和带负电的粒子。 本实验拆分的混合氨基酸出峰顺序分别为精氨酸、缬氨酸和谷氨酸,与CEC基础理论相符。 整个分离过程与分析物携带的电荷有关,氨基酸对映体的总电荷取决于缓冲液pH和其p Ka值[15]。 当缓冲液pH大于pI且小于p Ka2时,氨基酸带有负电荷;pH<pI值时,氨基酸将带有正电荷。 在本实验的最佳pH值条件下,精氨酸带正电荷,其运动方向与电渗流方向相同,故先出峰,同时由于精氨酸与AI- β-CD之间存在氢键相互作用,疏水包合相互作用等使其成功分离。 而谷氨酸带有的负电荷与电渗流方向相反,且其pI值小于缬氨酸的pI值,与AI- β-CD之间存在的静电吸引作用力更强,致使其出峰更慢。 同时谷氨酸含有两个COO-基团,两个COO-竞争与AI- β-CD相互作用,削弱了“三点”相互作用,导致其分离度较小。 与先前的研究工作[13]相比,该整体柱不仅对单种氨基酸对映体有较好的拆分效果( D, L-酪氨酸, Rs=1.80),而且在本实验中对于不同性质的混合氨基酸对映体也体现出优越的分离性能,可见,该整体柱在手性拆分方面具有较为广泛的应用价值。
2.4.2 分离电压和分离温度的考察
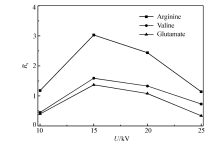
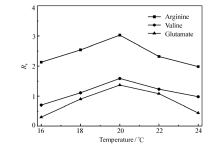
分离电压的大小会影响EOF和焦耳热,进而影响分析物对映体的分离效率。 本实验考察了分离电压分别为10、15、20和25 kV的情况。 从图5中可以看出,最佳分离电压为15 kV,而随着电压进一步增大,产生大量的焦耳热,分离度反而下降;分离温度主要影响着缓冲溶液的粘度,温度越高,溶液粘度越小,分析物迁移时间变短。 分离温度的考察范围为16~24 ℃,(图6)当分离温度为20 ℃时3种氨基酸对映体的 Rs均达到最大值,因此,最终确定最佳分离温度为20 ℃。
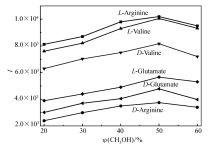
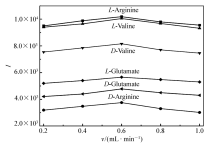
MS检测时,离子强度越大,灵敏度越高。 实验中考察了鞘流液中甲醇体积分数和鞘流液流速对离子强度的影响。 鞘流液是影响电喷雾电离的重要因素,本文以甲醇作为鞘流液,同时考察了鞘流液中甲醇含量变化对离子强度的影响,如图7所示。 结果表明,当甲醇体积分数为50%时,样品的离子强度最高。 本文考察了鞘流液流速在0.2~1.0 mL/min范围内对离子强度的影响,如图8所示。 结果表明,当鞘流液的流速在0.2~0.6 mL/min范围内时,样品的离子强度随着鞘流液流速的增加而增加,当流速为0.6 mL/min时检测的离子强度最强,当流速大于0.6 mL/min时,离子强度反而降低,尽管鞘流液流速与鞘流液中甲醇体积分数相比较对离子强度影响相对较小,但为了提高灵敏度,故选择鞘流液的流速为0.6 mL/min。
在优化的CEC运行条件及MS检测条件下成功分离了精氨酸、缬氨酸和谷氨酸3种混合氨基酸对映体。图9为混合氨基酸的总离子流(TIC)谱图,混合氨基酸对映体在15 min内被成功拆分,3种氨基酸对映体分离度分别为3.03、1.59和1.37。 为确认3种氨基酸对映体的6个组分,提取的质谱图见图10。
 | 图9 混合氨基酸对映体的总离子流谱图Fig.9 Fig 9 TIC chromatogram of mixed amino acid enantiomers a. L-Arginine; b. D-Arginine; c. L-Valine; d. D-Valine; e. L-Glutamate; f. D-Glutamate |
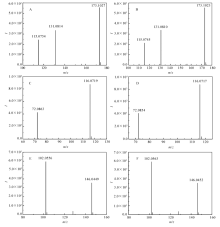 | 图10 混合氨基酸对映体的质谱图Fig.10 MS spectra of mixed amino acid enantiomers A. L-Arginine; B. D-Arginine; C. L-Valine; D. D-Valine; E. L-Glutamate; F. D-Glutamate |
图10A和10B分别为保留时间8.543和9.628 min组分提取的质谱图,其中 m/z为173.1023/173.1027的碎片峰对应精氨酸的[M-H]-峰,而 m/z为131.0810/131.0814的碎片峰对应精氨酸的[M-CN2H3]-峰, m/z为115.0745/115.0754为精氨酸的[M-CN3H4-H]-碎片峰,由此可判断图9中的峰a和峰b为精氨酸的对映体峰;图10C和10D分别为保留时间11.563和12.631 min组分提取的质谱图,其中 m/z为116.0719/116.0717和72.0863/72.0854分别对应缬氨酸的[M-H]-峰和[M-COOH]-峰,由此可判断图9中的峰c和峰d为缬氨酸的对映体峰;图10E和10F分别为保留时间14.032和14.582 min组分提取的质谱图,其中 m/z为146.0449/146.0452和102.0556/102.0563分别对应谷氨酸的[M-H]-峰和 [M-COOH]-峰,由此可判断图9中的峰e和峰f为谷氨酸的对映体峰。
本文应用自制的AI- β-CD整体柱作为CEC手性分离柱,应用CEC-ESI-TOF/MS联用技术成功分离了3种直接混合的氨基酸对映体( D, L-精氨酸、 D, L-缬氨酸和 D, L-谷氨酸),分离度分别为3.03、1.59和1.37。 可见,该方法简单高效,可应用于混合对映体分离分析领域。
辅助材料(Supporting Information)[混合氨基酸对映体电色谱分离图]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|