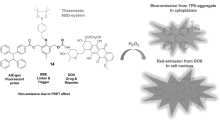
近年来,随着癌症发病率的不断升高,癌症治疗技术的更新和发展显得尤为重要,特别是化学疗法(Chemotherapy)的提出促进了荧光小分子抗癌药物释放体系的研究。 将具有荧光效应的有机小分子与抗癌药物结合在一起,使得药物释放体系表现出低毒性、优异的癌细胞靶向性和方便药物跟踪监测等特点。 因此,设计不同性能的前药可以研究抗癌药物释放的动力学过程,为实现癌症的精准治疗提供有力的工具。 本文主要介绍了基于喜树碱、SN-38和阿霉素等前药的研究进展,并对其发展前景作了展望。
In recent years, with the rising incidence of cancer, the renewal and development of cancer therapy technology is particularly important. Especially, the introduction of chemotherapy has promoted the research for the release system of fluorescence small molecule anticancer drugs. An anticancer drug release system combines organic fluorescent molecules with anticancer drugs based on fluorescent effect, which has the characteristics of low toxicity, excellent targeting to cancer cells and convenience to track and monitor. Therefore, design of prodrugs with different properties can be used to study the kinetic process of the release of anticancer drugs and provide a powerful tool for the accurate treatment for cancers. This paper mainly introduces the research progress of prodrugs based on camptothecin, SN-38 and adriamycin, and the prospects for their development.
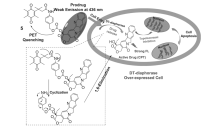
荧光技术作为一种新的检测和疾病诊疗手段,具有高灵敏性、高专一性、响应时间短和可实时监测的特点[1,2,3,4,5],目前已被广泛应用于离子和生物分子检测、生物成像及医学诊断等[6,7]。 通常,生物荧光传感器可以提取与疾病相关的信息,且能够在高度复杂的生物系统中保持高灵敏度和分辨率[8,9,10,11]。 特别是近红外吸收和发射的荧光分子具有较深的组织穿透能力,在血红蛋白、肌红蛋白等组织中有极小的吸收,是良好的生物组织成像工具。 小分子荧光化合物在临床肿瘤切除手术中也具有广泛的应用前景[12]。 生物医学研究工作者尝试设计合成具有良好性能的荧光化学小分子,用于肿瘤组织成像[13,14]和释放化疗药物的监测[15,16]。
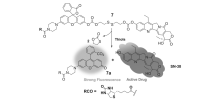
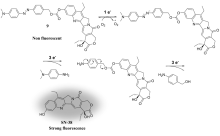
基于小分子药物释放体系的癌症化学疗法(Chemotherapy)因其自身结构简单、易于修饰和特异性强等特点[17,18,19]受到越来越多的生物化学家和医学研究者的关注。 一般情况下,荧光小分子抗癌药物释放体系由两部分组成:一部分是荧光信号基团,另一部分是化疗药物基团,二者通过特定的连接器连接。 在特殊的环境中,如较低的pH,低氧环境或高水平的硫醇等,导致化学键断裂,同时产生药物和荧光分子,从而实现药物释放的实时监测。 近年来,随着荧光成像和靶向治疗技术的快速发展,抗癌药物的靶向释放与治疗也取得了关键性突破[20,21]。 目前报道的释放体系中,常用的荧光基团包括花菁、萘酰亚胺、香豆素、四苯乙烯等荧光分子。 在前药设计中,需要考虑的主要因素包括以下几个方面:释放体系自身的低毒性,较高的肿瘤靶向选择性;良好的抗癌药物释放监测性能;理想的荧光成像或产生荧光信号转变能力。 此外,前药需要容易穿透细胞膜,对肿瘤细胞具有更大攻击性,从而实现对癌症药物的示踪治疗(图1)。 因此,光学成像结合抗癌药物释放,通过无创、实时和高分辨成像为肿瘤诊断和治疗提供了有力的手段[22]。 鉴于荧光小分子抗癌药物释放体系作为载药体系的诸多优势,研究抗癌药物的靶向治疗过程,成为当今癌症治疗和诊断领域的一项重要课题。 本文综述了近年来小分子药物释放体系在癌症诊疗方面的研究进展,期望对该领域研究工作者提供信息。
喜树碱(CPT)是从喜树中提取出来的一种具有抗癌活性的生物碱,其化学结构由5个平面环组成。 其抗癌机理为喜树碱结构中内酯环(E环)与肿瘤细胞核内的DNA拓扑异构酶相结合,导致DNA复制和RNA转录过程发生紊乱[23],从而引发肿瘤细胞凋亡。 然而,由于喜树碱结构良好的共平面性,其水溶性较差,且对正常细胞具有强毒副作用。 此外,研究发现,在生理条件下,大部分喜树碱结构会发生由内脂形式到羧酸盐形式的转变,从而降低抗癌效果。 近年来,各种喜树碱抗癌药物载药体系被广泛研究。
为了提高喜树碱在体内的药效,设计具有靶向性能的药物释放体系具有重要意义。 与聚合物纳米粒子、超分子和凝胶等药物载体相比较,小分子药物释放体系具有结构简单,易于修饰,利用率高,细胞摄取能力强等特点,是近年来高度关注的肿瘤化学疗法。 目前所报道的大多数喜树碱荧光小分子药物释放体系,是依靠谷胱甘肽(GSH)的刺激完成抗癌药物释放的。下面主要综述抗癌药物分子为喜树碱及其衍生物的药物释放体系。
关于GSH响应肿瘤治疗和释放体系前药的设计,大多采用二硫键作为连接基团,根据对不同的发光性能的需求,选择各种荧光团与抗癌药物喜树碱。 当前药处于高浓度GSH的环境时,二硫键断裂,抗癌药物喜树碱被释放[24]。 2014年,Zhu等[25]设计合成了一种近红外前药分子1(图2)。 该前药的结构由二硫键连接近红外发光的二氰亚甲基-4 H-吡喃和抗癌药物喜树碱组成,与聚乙烯乙二醇-聚乳酸(PEG-PLA)形成纳米粒子。 通过体外试验表明,前药1中的二硫键被肿瘤细胞内高浓度的GSH刺激断裂,抗癌药物喜树碱被释放,并观察到近红外荧光被打开,伴随着200 nm的斯托克斯位移。 在发射波长为665 nm下,具有近红外荧光的前药1对癌细胞中高浓度的GSH响应迅速,可直接作为GSH活化前体药物的信号示踪器。 该研究工作为深入理解和探索癌症治疗药物传输系统提供了重要依据。
 | 图2 近红外荧光下喜树碱药物释放机理[25]Fig.2 The release mechanism of camptothecin under near-infrared fluorescence[25] |
2016年,Zhu等[26]再次报道了基于二硫键的新型双通道荧光喜树碱前药2(图3)。 该前体药物结构中,抗癌药物与近红外花菁染料结合,由内源性谷胱甘肽激活并诱导释放抗癌药物喜树碱,其发射波长由825 nm的NIR荧光通道转移到650 nm。 研究发现,静脉注射24 h后的肝脏组织发挥药物激活和荧光检测的功能,而且加载在聚乙烯乙二醇-聚乳酸(PEG-PLA)纳米颗粒中对治疗糖尿病具有显著的疗效。 该研究结果提供了深入了解抗癌治疗和药物动力学之间关系一个独特的途径。 该工作是首次将花菁荧光团引入荧光小分子药物释放体系的例子,为抗癌药物生物组织成像研究提供思路。
 | 图3 喜树碱被激活机理与前药2荧光变化[26]Fig.3 Proposed mechanism in camptothecin activation and fluorescent variation of the prodrug 2[26] |
花菁及其衍生物具有近红外区良好的发光性能,成为生物医学成像研究中被广泛采用的荧光分子。 2016年,Xu等[27]开发了一种基于近红外花菁荧光团的靶向抗癌药物释放体系3(图4)。 其结构设计中,荧光团与抗癌药物连接基团与前面所报道的结构相似,药物释放的机理也相同。 研究发现,前药3对癌细胞表现出高的抗癌活性而对正常细胞表现出小的副作用。 此外,与单一游离的抗癌药物喜树碱相比,前药3对肝癌细胞的毒性要高于正常细胞。 其在原位和活体中具有良好的监测药物释放的能力及好的治疗效果,对特定的肿瘤药物释放体系是一个很有前景的研究平台。
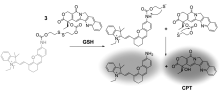 | 图4 近红外荧光下喜树碱药物释放机理[27]Fig.4 The release process of camptothecin under near-infrared fluorescence[27] |
2012年,Kang等[28]报道了一种基于荧光靶向细胞吞噬和治疗药物释放监测的前药4(图5)。 在该前药结构中,同样采用二硫键作为连接器,萘酰亚胺作为荧光发光基团,精氨酸-甘氨酸-天冬氨酸环肽作为癌症细胞的靶向单元,喜树碱作为抗癌药物活性分子。 在pH=7.4的中性水溶液中,前药与硫醇反应,二硫键立刻发生断裂,促使释放出游离的药物活性分子,伴随着在发射波长为535 nm处产生红移。 共聚焦成像试验研究表明,人神经胶质瘤细胞(U87)比胶质瘤细胞(C6)更容易结合该前药分子。 该药物输送系统可以作为一种新的诊断治疗发展的研究方向,在亚细胞水平上获得治疗效果和药物摄取相关的影像学信息。
 | 图5 在生理条件下前药4与GSH的反应机理[28]Fig.5 Proposed reaction mechanism of prodrug 4 with GSH under physiological conditions[28] |
近年来,与酶相关疾病的研究引起科学家广泛关注[29,30,31]。 2015年,Zeng等[32]报道了一种可以被DT-心肌黄酶激活的前药5(图6)。 该前药的结构由抗癌药物喜树碱通过连接器和荧光触发基团组成。 研究发现,前药5可以用于检测DT-心肌黄酶,追踪药物释放以及选择性地杀死癌细胞。 其机理为DT-心肌黄酶存在的情况下,前药5经过环化和1,6-消除反应,释放出具有活性的抗癌药物喜树碱,通过荧光信号检测到心肌黄酶,从而实现药物释放的实时监测。 前药5对DT-心肌黄酶过量表达的癌细胞表现出高的细胞毒性。 具有诊断和治疗双重功能的诊断前药是生物医学中的新兴技术,该策略为开发酶催化的癌症治疗及诊断提供了新的途径。
在喜树碱的相关衍生物中,7-乙基-10-羟基喜树碱(SN-38)是一种具有代表性的抗癌活性药物[33]。 其结构中,羟基在C10的位置,而乙基在C7的位置。 SN-38在生理pH条件下,具有稳定性较好和抗癌活性高,与其它抗肿瘤药物产生协同作用等特点。其作为抗癌药物的明星分子,近年来被广泛关注。 目前,临床上所用SN-38是经过碱性化开环后的羧酸盐注射液,但存在开环后活性降低,代谢快的现象。 相比较于喜树碱小分子抗癌药物释放体系,SN-38释放刺激物的种类更多,如活性氧,硫醇等。
转移性的恶性肿瘤去除历来是癌症治疗攻关的难题。 研究发现,转移性肿瘤具有高水平的活性氧物质,如过氧化氢(H2O2)等。 依据这一现象,2014年,Kim等[34]设计合成了一种前药6(图7),此前药可以用于治疗转移性恶性肿瘤。 该前药分子由可被氧化调控的硼酸盐结构和可以检测释放治疗药物SN-38的荧光分子组成。 随着H2O2的加入,荧光分子被快速裂解生成香豆素类似物和抗癌药物SN-38,香豆素类似物产生荧光信号实现释放抗癌药物监测。 前药6被H2O2活化后,选择性抑制肿瘤细胞生长。 此外,在转移性肺癌的小鼠模型中,前药6表现出有效的抗肿瘤活性。 该体系是首例以香豆素为荧光团,抗癌药物SN-38为抗癌药物的荧光小分子药物释放体系。
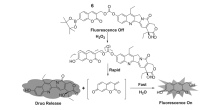 | 图7 前药6与H2O2在生理pH条件下可能的反应机理[34]Fig.7 Proposed reaction mechanism of prodrug 6 with H2O2 under physiological conditions[34] |
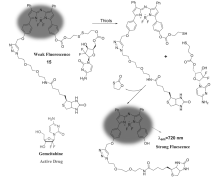
众所周知,生物素是一种癌症靶向结构单元,也是细胞生长的促进剂。 研究发现,生物素受体在白血病(L1210FR)、卵巢癌(Ov2008, ID8)、肺癌(M109)和乳腺癌(4T1, MMT06056)等多种肿瘤细胞中的表达均高于叶酸或维生素B-12受体。 近年来,以生物素为靶向官能团的肿瘤靶向治疗及追踪监测研究被广泛关注[35]。 Hong等[36]报道了一种新的用于治疗癌症的前体药物7(图8),其结构包含 N-生物素化的哌嗪硫醇荧光信号部分和抗癌药物SN-38药效基团,两部分由二硫键连接组成。 前药7结构本身显示较弱的荧光信号,然而,当暴露于GSH环境中时,7a的荧光荧光强度是前体药物7的32倍。 研究发现,前药在体内和体外可以实现抗癌药物SN-38的递送、释放以及监测。 存在Hela细胞的小鼠肿瘤模型中前药7对人宫颈癌细胞也显示出抗癌活性。 该研究体系具有显著的靶向、释放、成像诊断和治疗作用,该研究结果在癌症诊断治疗中具有重要意义。
2016年,Bhuniya等[37]报道了一种生物素化的聚乙烯醇(biotinPVA)制备的前药8(图9)。 该前药结构包含抗肿瘤药物SN-38,荧光染料对甲氨基酚绿及二硫键连接基团。 研究发现,与单一前药相比,由生物素聚乙烯醇制得的前体药物(PTP1)对血清和细胞特异性活化的稳定性显著提高,其具有好的生物相容性。 该体系显著的特点是可以通过调节细胞内环境中荧光信号,PTP1可以实时监控和释放局部异构酶Ⅰ的抑制剂SN-38。 此外,该治疗药物PTP1对受体阳性的人宫颈癌细胞表现出剂量依赖性的抗增殖活性,而对受体阴性的小鼠胚胎成纤维细胞则无此作用。 PTP1通过细胞特异性抵抗癌细胞增殖是一种有效的治疗癌症的方法。 该工作首次将聚合物合成技术应用到抗肿瘤细胞增殖前药的设计,为癌症诊断治疗药物的设计提供新的视角。
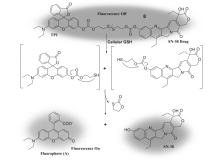 | 图9 GSH诱导前药8形成被激活的SN-38和荧光素(A)的过程[37]Fig.9 The process of GSH-induced of prodrug 8 formation of active SN-38 and fluorophore(A)[37] |
最近,Han等[38]报道了一种含有偶氮结构的SN-38抗肿瘤前药9(图10)。 其在发射波长560 nm下显示荧光增强。 在不同的癌症细胞系中对前药9的细胞毒性进行检测发现,在缺氧条件下,其表现出抗癌活性,进而释放抗癌药物,并在 λem=560 nm处伴随着荧光增强,可以起到监测药物活化和示踪的作用。 其原因可以认为是低氧诱导因子(HIF-1 α)在固体肿瘤中过表达,前药9被激活且释放抗癌药物SN-38。
Jo等[39]报道了一种在体内对GSH高度敏感并显示荧光淬灭的双功能SN-38前药9(图11)。 该前药是由2,4-二硝基苯磺酰作为GSH触发器与SN-38中10号位上的—OH偶联形成。 荧光的淬灭源于电子供体激发的光诱导电子转移(d-PeT)过程。 由于肿瘤细胞中具有高浓度的GSH,使得该前药被特异性激活,释放抗癌药物SN-38。 通过研究其癌细胞活化性能和细胞毒性作用,结果表明,其具有高效的被激活性能,并能实时监测药物的分布。 前药9只需要一步反应合成,具有合成简单的显著优势。 该体系作为有效的化学治疗剂在未来具有潜在的应用价值。
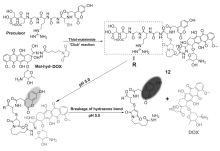
阿霉素是一种临床上常用的蒽环类抗肿瘤药物,目前已被广泛应用于血液系统中治疗肿瘤的药物[40]。其抗肿瘤机理主要是前药作用于DNA结构,抑制DNA和RNA的合成,且对RNA具有较强的抑制作用。 然而,阿霉素具有一定的毒副作用,如心脏毒性、骨髓生长抑制等。 近些年研究发现,阿霉素在体内的毒副作用主要来自代谢过程中诱导活性氧自由基的产生,从而引起心肌细胞凋亡和坏死。 因此,关于阿霉素药物释放体系的研究被人们广泛关注。 阿霉素荧光小分子抗癌药物释放体系,目前报道的大多是在特定pH下荧光团和药物结构部分分离,抗癌药物释放,其连接基团中包含易于水解的—C=N—结构。 2015年,Kim等[41]基于pH响应设计合成了一种新型的生物素抗癌药物释放体系前药10(图12)。 其结构由靶向官能团生物素、硝基苯和抗癌药物阿霉素组成。 该体系药物释放过程是通过改变体系pH导致腙键断裂来调控实现的。 抗癌药物阿霉素10a的荧光强度较前药10有所增强。 他们通过细胞毒性试验研究发现,生物素受体阳性的人肝癌细胞(HepG2)敏感性高于生物素受体阴性的人胚胎肺成纤维细胞(WI-38)。 通过荧光共聚焦显微试验和MTT试验研究人胚胎肺成纤维细胞系上的人肝癌细胞的细胞摄取和抗癌活性,说明前药10对肿瘤细胞具有选择性。 在肿瘤治疗和影像学应用研究方面,前药10作为选择性的肿瘤靶向药物释放体系应用于癌症治疗和诊断的工具是一个有前景的候选者。
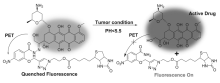 | 图12 酸引发的肿瘤靶向前药10在肿瘤部位的作用机理[41]Fig.12 Illustration of the functioning mechanism of acid-activated tumor-targeted prodrug 10 at the tumor site[41] |
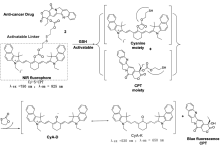
2018年,Lin 等[42]报道了一种双重荧光信号的药物释放体系11,该体系能够在生命体系中实时监控抗癌药物释放的动力学过程(图13)。 其结构包括抗癌药物阿霉素和荧光染料香豆素,由pH响应的可裂解连接器连接组成。 由于C=N异构化和N—N键的自由旋转作用,导致药物释放体系11几乎没有荧光。 然而,在酸性条件下,该体系被水解激活产生抗癌药物阿霉素和荧光染料分子,在发射波长为595和484 nm处产生发射峰信号。 他们研究发现,药物释放系统的水解速率受到阿霉素和荧光染料基团的位阻效应限制。 通过细胞毒性试验发现,体系11相对于简单的抗癌药物阿霉素具有较低的细胞毒性,对肿瘤细胞的抑制率高于正常细胞。 该技术利用不同波长的荧光发射信号,可实时监测人肝癌细胞和人乳腺癌细胞中抗癌药物阿霉素的释放过程。
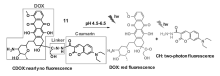 | 图13 基于阿霉素-香豆素的药物控释系统图示[42]Fig.13 Illustration of the DOX-coumarin-based controlled drug release system(CDOX)[42] |
研究发现,丝氨酸多肽类似物结构具有良好的肿瘤靶向功能。 Zhang等[43]基于pH响应的理念,成功设计合成了一种新颖的pH响应肿瘤靶向前药12(图14)。 前药结构是由阿霉素腙衍生物通过硫醇-马来酰亚胺的“Click”反应与香豆素修饰的肽骨架发生偶联反应得到。 由于癌细胞中富含 αv β3整合素,而前药12中所含有的丝氨酸多肽(GRGDS)会促进其在癌细胞中的吸收。 其作用机理为前药结构中含有对酸敏感的腙键,使抗癌药物在细胞内快速释放,从而诱导细胞凋亡。
香豆素类衍生物是良好的双光子荧光团,具有光损伤小、组织穿透深等优点,因此被广泛用于荧光小分子的设计合成。该工作首次将丝氨酸多肽引入抗癌分子前药为开发性能更加智能的药物释放体系打开一扇新的窗口。
2015年,Liang等[44]受到荧光探针广泛用途启发,设计合成了一种在活细胞中可追踪抗癌药物的纳米前药13(图15)。 该前药13结构包含一个具有聚集诱导发光的四苯乙烯(TPE)分子和一个发荧光的抗癌药物阿霉素结构,二者由pH响应连接器连接而成。 当前药处于低pH环境时,会发生能量传递转移(ETR),使两部分结构不显荧光。 作者通过细胞双色荧光成像试验研究,得到活细胞中药物释放的动力学过程。 由于分离的四苯乙烯和阿霉素都是荧光分子,但荧光发射位置不同。通过检测四苯乙烯和阿霉素的时间和空间模式,在亚细胞水平上准确地揭示药物的释放位点、释放时间、载体到达的位置和药物的执行部位。 前药13具有很好的细胞膜渗透性,可以实现阿霉素药物在活细胞中的释放。 这是首次利用荧光小分子纳米前药释放抗癌药物的报道。 该研究结果为设计更复杂的药物传输系统和提高药物靶向病理位点的效率提供了细胞内药物释放动力学的详细信息。
 | 图15 探针启发的前药13的设计图示[44]Fig.15 Schematic illustration of the design of the probe-inspired nano-prodrug 13[44] |
最近,Liu等[45]再次构筑了具有AIE效应的阿霉素(DOX)抗癌药物释放前药14(图16)。 该药物传递系统利用了对活性氧敏感的官能团苄基硼酸酯和2,4-二硝基苯磺酰作为触发器,羧基化的四苯乙烯作为AIE发光基团,阿霉素作为抗癌前药组成。 细胞活性氧在触发该前体药物的过程中能够被实时监测。 该体系实现了由细胞内物质引发的药物释放、细胞成像和药物递送跟踪的作用。 该工作是少见的将细胞内的活性氧物质ROS作内部药剂来触发荧光开启机制药物释放的例子。
吉西他滨是一种能够破坏细胞复制的二氟核苷类抗癌药物,同时也是核糖核苷酸还原酶的替代物。 2013年,Kim等[46]报道了一种由近红外氟硼二吡咯荧光团与癌细胞靶向生物素偶联的抗癌前药15(图17)。 此前药分子结构包含氟硼二吡咯荧光团、抗癌药物吉西他滨和二硫键连接器,采用“Click”反应接入靶向功能分子生物素。 研究发现,细胞内的硫醇可以使前药结构中的二硫键断裂,抗癌药物被释放,前药分子表现出强的荧光。 利用市售溶酶体选择性染料和内质网选择性染料进行共定位试验研究发现,此前药能够监测抗癌药物的传递过程和癌细胞成像,同时可以通过受体介导的内吞作用定位到内质网。 此外,与生物素受体阴性的人胚肺成纤维细胞(WI38)相比,该前药只进入生物素受体阳性的肺癌细胞(A549)中。 与其它荧光小分子抗癌药物释放体系相比较,该前药的发射波长最长( λem,720 nm),更有利于肿瘤组织成像。该研究结果为特定的肿瘤靶向药物递送和无创细胞成像提供一种新策略。
2017年,Zhang等[47]报道了一种用于化学光动力学癌症治疗的线粒体靶向近红外前药16(图18)。 其结构包含近红外光敏剂NPS和抗癌药物5'-脱氧-5-氟脲嘧啶腺苷(5'-DFUR),这两部分之间通过双硼酸盐连接。 前药结构自身表现出无荧光发射和低毒性,当H2O2存在的情况下,双硼酸盐基团被破坏,导致用于近红外光动力治疗的光敏剂NPS被激活,化学治疗药物5'-DFUR被释放。 因癌细胞中存在高浓度的H2O2,因此被激活的NPS能够为线粒体靶向成像提供近红外荧光信号。 研究发现前药16对癌细胞比正常细胞表现出高的细胞毒性和低的副作用。 除此之外,其表现出良好的肿瘤线粒体环境被激活现象,可以静脉注射到负载肿瘤的小鼠进行荧光成像。 该工作为肿瘤线粒体环境的药物激活释放,近红外发光的协同治疗的药物释放打开新的方向。
Zhu等[48]报道了一种用于生物评价性的近红外荧光前药17(图19),其能够被两亲性的共聚物包裹成纳米颗粒作为癌症治疗药物释放体系。 前药17的结构中,足叶草毒素(PPT)作为抗癌药物部分,二氰亚甲基-4 H-吡喃衍生物作为近红外荧光团,二硫键作为连接基团。 作者通过体外试验研究表明,前药分子17表现出低的毒性,且GSH能够激活前药分子,导致抗癌药物PPT释放,伴随着发射波长在665 nm处的近红外荧光信号明显增强。将其通过静脉注射到负载肿瘤的小鼠,其表现出极好的被肿瘤细胞激活现象。 此外,被前药17标记的癌细胞表现出好的肿瘤靶向性能和滞留效果。 该研究结果为治疗诊断学的药物释放系统设计提供了一种新的范例。
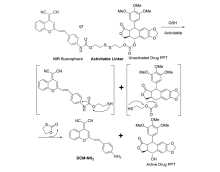 | 图19 被GSH激活的前药的抗癌药物PPT释放机理[48]Fig.19 Proposed PPT release mechanism of the activated prodrug by treatment of GSH[48] |
2015年,Wang等[49]报道了一种新的治疗方法,用于选择性递送和实时监测DNA烷化剂氮芥,设计并合成了一种由光致变性的硝基苯乙基基团、脱氧核糖核酸烷基化甲基氯胺和香豆素荧光团组成的光致反应前药18(图20)。 他们采用对光不稳定的硝基苯乙基官能团,DNA烷基化氮芥和香豆素荧光团设计合成光响应前体药物。在光照下,具有活性的氮芥被释放并诱导有效的DNA交联,并伴随着荧光增强(152倍),药物的释放过程和移动可以通过荧光光谱方便监测。 进一步通过体外的肿瘤研究发现,DNA的交联活性源于抗癌药物的释放和转变。 该研究结果提供了一种新的用于治疗癌症的策略。
我们总结了近年来荧光小分子化合物在抗癌药物释放体系方面的研究进展,荧光小分子药物释放体系中荧光团和抗癌药物之间的连接基团对于药物的特异性释放具有密切关系,二硫键连接基团在前药的设计中扮演着重要角色。 本文根据不同的抗癌药物分子进行了分类:喜树碱,SN-38,阿霉素和其它类型,分别采用各种荧光基团如花菁、香豆素、萘酰亚胺和四苯乙烯基团等,对于不同荧光基团和药物的抗癌药物释放体系,各具优势。 具有荧光效应小分子药物释放体系具有低毒、特异性强的特点,可以促使抗癌药物在不损伤正常细胞的情况下进入癌细胞,并产生荧光基团能够在亚细胞水平上实时示踪抗癌药物的释放位置和释放过程,从而实现癌症治疗。 虽然该研究方向成果报道还比较少,但荧光小分子化合物抗癌药物释放体系为癌症的治疗开辟了新的途径。 因此,该技术在今后的几十年里仍然是研究的热点。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|