构建了一种电势稳定性好的全固态钙离子选择电极(Ca2+-ISE),采用碳纳米管(CNT)/Ag/MoS2为转导层,自制的三脚架化合物作为钙离子载体,制备固体接触式Ca2+-ISE。 系统分析了全固态Ca2+-ISE的稳定性、能斯特斜率、响应范围、选择性系数等主要性能,发现制备的固体接触式Ca2+-ISE在钙离子浓度为1×10-6~1×10-1 mol/L范围内呈现线性能斯特响应,响应斜率为28.1 mV/decade。 CNT/Ag/MoS2的引入有利于提高固体接触式Ca2+-ISE的离子浓度线性响应范围,缩短电势平衡时间,降低测试能斯特斜率与理论值差,对于Ca2+-ISE的长期在线检测有重要研究意义。
An all-solid-state Ca2+ ion selective electrode(Ca2+-ISE) was prepared with carbon nanotube(CNT)/Ag/MoS2 as the ion-to-electron transducer and tripodal compound as the calcium ionophore. The stability, slope, response range, selectivity coefficient, etc. of the electrode were investigated. It is revealed that the electrode exhibits a 28.1 mV/decade Nernst slope in the range of 1×10-6~1×10-1 mol/L Ca2+ concentration. The transducer is helpful in enlarging the linear response range of the Ca2+ concentration, shortening the potential balance time and reducing the difference of the Nernst slope. All of these results are important for long-term online detection of calcium ions for the solid electrode.
水体中化学元素组分的定量分析是水资源化学研究的一个重要课题[1]。 海水中钙离子不仅参与水生物循环及矿物形成过程[2],还能与水中的二氧化碳反应生成CaCO3,参与海水中H2CO3的分解平衡,具有控制海水的pH以及保证海水的缓冲能力作用[3],所以海水中钙元素检测具有重要意义。 目前,测定水中钙离子的常用方法有等离子色谱法、火焰原子吸收分光光度法、常规滴定法及离子选择性电极(Ion Selective Electrode,ISE)等[4]。 在这些测试方法中,ISE作为存在时间较早的一类电势型化学传感器,具有灵敏度高、响应速度快、选择性好、连续快速测定等优点,被广泛应用于化工、农业、地质、医药等部门的样品分析和现场检测中[5]。
液体接触式ISE(图1A)由聚合物离子选择性膜、内充液以及内参比电极所构成,其与传统离子选择性电极检测体系(外接双液接盐桥的外参比电极、体积大、保养冗赘并且不易携带)相比,具有相当大的优势。 所以开发固态ISE检测体系成为电势型传感器的研究热点。 研究开发最早的固态ISE为涂丝电极[6],涂丝电极(图1B)中离子载体直接负载于固态导电基底上成膜[7,8,9,10],摒弃了传统聚合物膜ISE中内充液及内参比电极的使用,明显简化了ISE的检测装置。 然而,虽然涂丝电极在制作及使用中具有操作简便的优点,但涂丝电极在后续的使用过程中存在电势响应不稳定的现象,且这一现象在长期在线监测中尤为明显[11]。
 | 图1 液体接触式(A)和涂丝式(B)离子选择电极结构示意图Fig.1 Schematic Structural diagrams of liquid contact(A) and coated wire(B) ion selective electrodes |
涂丝电极等全固态ISE,其离子选择性膜和固体导电基底之间缺少电荷转移物质,无法形成稳定的界面电势,从而易导致测试电势不稳定[11]。 而且,在聚合物离子选择性膜与固体导电基底之间存在微水层,会发生伴有氧气形成的不可逆半电池反应[12,13]。 因此,科研人员提出在聚合物离子选择性膜和固体导电基底之间引入可实现离子-电子转导的固体接触层[14],开发出了基于不同转导材料的新型固体接触式ISE。 该类电极具有在使用过程中电势性能稳定、重现性好、免校正等优势,成为当前固态ISE种类中的研究热点。
聚合物离子选择性膜与固体导电基底之间引入的离子-电子转导层,其作用机理主要有两种[15]:1)通过在聚合物离子选择性膜与固态导电基底之间发生氧化还原反应实现离子-电子转导,即氧化还原电容转导机理[16,17,18];2)通过在聚合物离子选择性膜与固体导电基底之间引入具有大的双电层电容的离子-电子转导层,加快聚合物膜与导电基底之间的离子-电子转换速率,即双电层电容转导机理[19,20]。 由于在全固态ISE中,离子-电子的转化就发生在固体转导层与聚合物膜界面上,该界面以非对称性双电层电容器的形式存在,因此基于双电层电容转导机理的固体接触式ISE,由于构成双电层电容的电容器材料导电性好、比表面积大,离子-电子转化效率高,导致相应的固体ISE的离子选择性好,且电极性能稳定[19,20]。
本文在前人研究的基础上[17,18,19,20],综合了双电层电容转导机理的固体离子-电子转导层材料特点,选择具有优良超级电容器性能的碳纳米管(CNT)、MoS2等材料,制备了CNT/Ag/MoS2新型离子-电子转导层,提高了聚合物选择膜与导电基底之间的离子-电子转换速率,并将新型固体接触式ISE用于水中钙离子的检测分析。 系统分析了电极的稳定性、响应斜率、响应范围、选择性系数等性能,取得了较好的检测结果。
氯乙酰氯、三羟甲基丙烷、氢化钠(NaH)、碳纳米管(CNT)、硼氢化钠(NaBH4)、二硫化钼(MoS2)、硝酸银、碳酸氢钠、无水硫酸钠、 N-甲基苯胺、Nafion-乙醇溶液、邻苯二甲酸二异辛脂(DOP)、聚氯乙烯(PVC)、邻硝基苯辛醚以及浓硫酸、浓硝酸、稀盐酸、苯、吡啶、石油醚、乙酸乙酯均为分析纯试剂,购自阿拉丁试剂有限公司。 紫铜电极头由昆山安诺伊精密模具有限公司生产。
采用TENSOR27型傅里叶红外光谱仪(FTIR,美国布鲁克公司)测试红外光谱,将钙离子载体溶于乙醇,在两个圆形的盐片间滴1、2滴样品溶液,形成一层薄膜,然后直接放入光路检测。 采用NMRSpectrometer AVANCE Ⅲ HD600MHz型固体核磁共振波谱仪(NMR,美国布鲁克公司)检测核磁共振氢谱,测试前使用氘代氯仿溶解样品。 采用德国卡尔蔡司公司生产的Sigma500型场发射扫描电子显微镜(SEM)和Tecnai G2 F30型透射电子显微镜(TEM)分别进行全固态钙离子选择性电极(Ca2+-ISE)表面和 CNT/Ag/MoS2离子-电子转导材料形貌测试。 采用CHI852D型电化学工作站(上海辰华公司),测试全固态Ca2+-ISE的电极性能。
1.2.1 离子-电子转导材料的制备
将0.1 g CNT经空气氧化纯化后,于浓硝酸中回流24 h,用去离子水洗涤、过滤,然后在80 ℃真空干燥2 h。 产物再经浓硫酸、硝酸等表面羟基化处理后,超声分散在50 mL 0.1 mmol/L AgNO3溶液中,加入4 mg NaBH4,超声30 min,随后加入10 mg MoS2,继续超声2 h,离心分离,去离子水洗涤,60 ℃真空干燥,即可获得CNT/Ag/MoS2离子-电子转导材料。
1.2.2 钙离子载体的合成
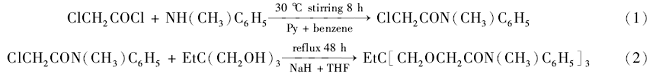
将11.3 g氯乙酰氯溶于100 mL苯中,向此溶液中缓慢加入由15.8 g吡啶和30 mL苯组成的溶液,边加边搅拌,并使体系温度保持在30 ℃下,搅拌10 min后,再缓缓加入由10.7 g N-甲基苯胺和30 mL苯组成的溶液。 反应过程中保持反应液温度在30 ℃以下。 室温下搅拌8 h后用稀盐酸酸化分离,分出的有机相,依次用稀盐酸、NaOH水溶液和水洗涤,然后用无水硫酸钠干燥过夜。 干燥后的有机相在水浴上蒸发出苯,残液从石油醚中重结晶得白色固体。 向30 mL的四氢呋喃中加入0.597 g三羟甲基丙烷、60%的氢化钠-矿物油混合粉末0.6 g。搅拌30 min。 冷却后,向体系中加入3.637 g已获得的白色固体和10 mL无水四氢呋喃组成的溶液。搅拌下加热回流48 h。 冷却后,水浴蒸干溶剂,残留物过硅胶柱,先用石油醚洗脱,再用乙酸乙酯洗脱,得黄褐色油状钙离子载体。 具体反应式如(1)和(2)所示:
1.2.3 全固态Ca2+-ISE的组装
全固态Ca2+-ISE由导电单元(紫铜电极头)、离子选择性薄膜、离子-电子转导薄膜和一个起保护作用的电极管套腔体组成(图2)。
取100 mg CNT/Ag/MoS2离子-电子转导材料,5 mg DOP,加入到1 mL 0.5%Nafion乙醇溶液中,并于室温条件下搅拌处理2 h,即得浓度均一的离子-电子转导膜溶液。 取1.234 g自制的钙离子载体,0.381 g聚合物基底PVC粉末,0.945 g增塑剂邻硝基苯辛醚溶于20 mL去水四氢呋喃中,搅拌2 h,即得浓度均一的钙离子选择性膜溶液。
紫铜电极头使用之前,先用丙酮超声清洗10 min,再用0.1 mol/L稀盐酸溶液超声清洗10 min,最后用去离子水超声清洗10 min,烘干备用。 将处理好的紫铜电极头一端蘸取离子-电子转导膜溶液,使膜溶液均匀沾附。 取出,风干。反复蘸取几次,直到铜棒上形成一层厚度约为50 μm的离子-电子转导膜。 再将覆盖有离子-电子转导膜的紫铜电极头端放入钙离子选择性膜溶液中,蘸取钙离子选择性膜溶液,自然风干成膜,使之覆盖离子-电子转导膜。 反复此操作,直到形成厚度约为1 mm均匀光亮的钙离子选择性膜。 最后将覆盖有钙离子选择性膜的紫铜电极用导线连接,电极管套腔体封装,即可获得CNT/Ag/MoS2离子-电子转导Ca2+-ISE(图2)。 省略离子-电子转导膜涂覆过程,直接用紫铜电极头蘸取钙离子选择性膜溶液,即可获得无离子-电子转导层的钙离子电极(简称无转导Ca2+-ISE)。
图3A为CNT/Ag/MoS2离子-电子转导材料TEM照片,图3B为全固态Ca2+-ISE的SEM形貌图。 从图3A可以看出,MoS2在超声波的作用下层片间隔显著扩大,整体结构厚度不均,有透明且薄的类单片层MoS2出现。 还可以看出CNT的存在,直径~41 nm,壁厚~17 nm,晶面间距约0.34 nm。 类单片层MoS2晶面间距约为0.27 nm。 单质银主要以纳米颗粒的形式(直径为6~9 nm)分布在CNT和MoS2表面。 而涂覆有CNT/Ag/MoS2离子-电子转导层的全固态Ca2+-ISE,通过SEM照片(图3B)可以看出,在电极表面膜分布均匀,覆盖完整,但在电极表面有形状不规则的凸起,凸起上有白色的圆形小颗粒。 推测白色点状物质是PVC粉末,凸起物中是没有挥发完全的THF与溶解的钙离子载体。 对比图3B与未引入离子-电子转导层的Ca2+-ISE表面形貌(图3B插图)可知,转导层的引入,并未对电极表面形貌造成很大的影响。
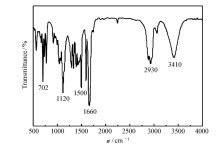
对自制的钙离子载体进行红外光谱表征,如图4所示,钙离子载体在1660、1290、1120和1040 cm-1处有4个强吸收峰,其中,1660 cm-1为—CON—的吸收峰,1290 cm-1为—CH3的伸缩振动峰,1120与1040 cm-1均属于醚键的吸收峰[21]。 此外,钙离子载体在1500和702 cm-1处吸峰强度较强,为苯环的伸缩振动峰。自制钙离子载体的1H NMR谱结果显示,在0.8、1.22、3.25、3.31、3.77和7.16~7.44范围内,均有较大面积的峰出现。 结合自制钙离子载体的红外光谱,推测钙离子载体为EtC[CH2OCH2CON(CH3)C6H5]3。
基于CNT/Ag/MoS2离子-电子转导层的固体接触式Ca2+-ISE及无转导层Ca2+-ISE作为工作电极,使用开路电压法在10 mL浓度分别为1.0×10-6、1.0×10-5、1.0×10-4、1.0×10-3、1.0×10-2和1.0×10-1 mol/L的CaCl2溶液中测试电极的电势响应。 为避免更换CaCl2溶液引起测试误差,本文从1.0×10-6 mol/L CaCl2溶液开始测量,在搅拌状态下等待100 s测试时间之后,向测试液中用移液枪移加5 mol/L的CaCl2溶液使其浓度逐渐增大至设定浓度。 如图5A是全固态Ca2+-ISE的动态电势响应曲线,插图为对应的校准曲线。 从图5A可以看出,具有CNT/Ag/MoS2离子-电子转导层的电极响应速度快,在不同浓度钙离子溶液中达到电势平衡的时间小于3 s,且对高浓度钙离子溶液的电势响应稳定。 延长Ca2+-ISE检测钙离子浓度范围至1×10-8~3.4×10-1 mol/L(见图5A插图),发现固体接触式钙离子选择性电极在钙离子浓度为1.0×10-6~1.0×10-1 mol/L的范围内呈现线性响应,响应斜率为 28.1 mV/decade,符合能斯特响应特征。 电极搁置7、14和30 d后,重新进行动态电势响应曲线测试,测试结果的相应校准曲线,斜率分别为28.0、27.8和27.5 mV/decade,基本符合能斯特响应特征。
对比采用相同工艺参数制备的无转导Ca2+-ISE(图5B),电极的响应速度虽然也十分快,但获得电势平衡所需时间较长,在100 s内,不能获得稳定的电势“平台”,电势值均呈逐渐下降趋势,且在1.0×10-5~1.0×10-4 mol/L浓度附近存在波动,电极仅在1.0×10-4~1.0×10-2 mol/L浓度范围内近似呈能斯特响应规律,响应斜率为23.9 mV/decade。 这说明CNT/Ag/MoS2离子-电子转导层的引入有利于提高Ca2+-ISE的离子浓度线性响应范围,缩短电势平衡时间。 这可能是因为转导层中的CNT与MoS2均为优良的超级电容器材料,而Ag纳米颗粒有利于提高材料的导电性,从而加快钙离子载体膜与铜基底之间的离子-电子转换速率。
将电极直接插入1.0×10-4、1.0×10-3、1.0×10-2 mol/L的氯化钙标准溶液中,每20 s记录一次电势值,记录200 s内的电势变化。 结果如图6A所示。 由图6A可知,电极在200 s内,电势漂移很小,仅为2 mV左右。 延长电极测试时间至3 h、1 d、7 d、20 d及30 d,电势漂移约为4~6 mV,说明依照本论文工艺制备的固体接触式Ca2+-ISE的稳定性良好。 在相同测试条件下,对无转导层Ca2+-ISE进行稳定性评价(图6B)。 与具有离子-电子转导层的电极相同,在200 s内电极的电势漂移很小,约为2 mV。 延长电极测试时间分别至3 h、1 d、7 d、20 d和30 d,电势漂移约为5~10 mV,比具有离子-电子转导层的Ca2+-ISE的电势漂移大,说明离子-电子转导层的引入有利于提高固态Ca2+-ISE的长期稳定性。
 | 图6 固体接触式钙离子选择性电极的时间稳定性Fig.6 Time stability of the solid-state ion-selective electrodeA.with CNT/Ag/MoS2 layer; B.without CNT/Ag/MoS2 layer |
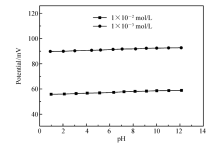
电极分别插入1.0×10-3、1.0×10-2 mol/L CaCl2标准溶液中,使用2 mol/L HCl溶液调节CaCl2标准溶液pH值至1.0、2.0、3.0、4.0、5.0和6.0左右,采用5 mol/L KOH溶液调节标准液pH值至8.0、9.0、10.0、11.0和12.0左右,测试电极电势。 由于本文采用的钙离子载体,对K+的选择性非常低[22],因此K+浓度对电极的影响可以忽略不计。 Ca2+-ISE电势随pH值变化如图7所示。 从图7可见,电极在酸性条件下的电势相对较低,在中性条件下的电势稳定,其原因可能是酸性时溶液中的H+与钙离子载体有一定的结合,干扰了载体与钙离子的结合,导致电势偏低,但均在能斯特线性范围内。 在1.0×10-3 mol/L钙离子浓度下,电极在pH值0.92~12.11的范围内电势漂移范围为2.9 mV,在1.0×10-2 mol/L钙离子浓度下为2.7 mV(pH值在0.99~12.13),说明电极具有良好的抗酸碱性能。 而引入转导层的Ca2+-ISE,当pH值从0.99升高至2.12时,电势漂移大于35 mV;而pH值在7~9范围内电势漂移小于5 mV。 由此可以看出,离子-电子转导层的引入有利于提高电极的抗酸碱能力。
由于所有的ISE均不是特定离子的专属电极,电极在使用过程中均会在不同程度上受到干扰离子的影响。 而电极的选择性主要是由敏感单元,即电极敏感膜的组成决定的。 由于本文采用的钙离子载体,对Li+、Na+、K+、N
基于碳纳米管(CNT)/Ag/MoS2离子-电子转导层制备的固态接触式钙离子选择性电极(Ca2+-ISE),通过对电极的检测范围,能斯特斜率,离子选择性,电极稳定性等进行测试分析发现,具有CNT/Ag/MoS2离子-电子转导层的固体接触式Ca2+-ISE,在1.0×10-6~1.0×10-1 mol/L的钙离子浓度范围内,能斯特斜率为28.1 mV/decade,且电极的离子选择性高、稳定性良好、抗酸碱能力优良,具有良好的应用前景和推广价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|