共同通讯联系人:胡继明,教授; Tel:027-68752439-8701; Fax:027-68752136; E-mail:jmhu@whu.edu.cn; 研究方向:表面增强拉曼光谱的设计和应用
多肽是 α-氨基酸以肽键连接在一起而形成的化合物,同时也是蛋白质水解的中间产物。 金纳米粒子具有良好的生物相容性和突出的表面等离子共振性质,基于多肽-金纳米粒子体系的独特光学特性的生物传感研究及应用已引起众多科学工作者的关注。 本文仅就近年来利用多肽-金纳米粒子复合物进行生物传感研究及应用加以评述,包括多肽和金纳米粒子的制备与特性、多肽-金纳米粒子复合物的组装以及其在生物传感中的应用等。
Co-corresponding author:HU Jiming, professor; Tel:027-68752439-8701; Fax:027-68752136; E-mail:jmhu@whu.edu.cn; Research interests:design and application of surface enhanced Raman spectroscopy
As the intermediate product of protein hydrolysis, peptides are synthesized through the polymerization of α-amino acids. Given the great biocompatibility and surface plasmon resonance(SPR) of gold nanoparticles(AuNPs), biosensors based on the peptide-AuNPs system have attracted the attention of many scientists. In this review, the biosensing research and application of the peptide-AuNPs complexes are summarized, including the preparation and properties of peptides and AuNPs, the synthesis of peptide-AuNPs and the application in biosensing.
金纳米粒子由于摩尔消光系数高、比表面积大、生物相容性好,光学性质与形状大小、距离分布有关等特点,使其成为了光学生物传感检测中的理想纳米材料[1,2,3,4]。 通常将金纳米粒子与生物分子(如核酸、蛋白质、多肽等)有机地结合在一起,构建出性能各异的复合物,再利用简单的仪器(如紫外可见分光光度计)就能够获得高灵敏度和高准确度的分析结果[5,6,7,8,9]。 这种复合材料不仅具有生物分子的独特性质,还兼备金纳米粒子的光学、电学、磁学和催化等特性。多肽是蛋白质的水解产物,其结构丰富,生物活性高,并且合成工艺成熟,非常适合作为功能材料与金纳米粒子进行复合,进而实现对目标物的分析与检测[10,11]。 本文将对多肽与金纳米粒子形成复合材料的制备方法及其生物传感应用的研究进展进行评述和展望。
1.1.1 多肽的概述
蛋白质为生物体最重要的生物大分子之一,被广泛应用于人类疾病的预防和治疗。 然而其提取纯化复杂、相对分子质量大和特异的抗原性质,极大地阻碍了它们在生物传感、药物靶向中的发展[12]。 随着研究的不断推进,人们发现那些在生命活动中起决定性作用的并非结构复杂、相对分子质量大的蛋白质,而是那些相对简单的多肽小分子。 多肽既是蛋白质水解的中间产物,同样也是组成蛋白质的结构基元。 在生物体内存在许多具有特定生物活性的肽段,如免疫活性肽、神经活性肽等,它们在生物体的生长发育、新陈代谢、免疫调节中发挥着至关重要的作用[13,14,15]。 因此,科研工作者开始利用小分子多肽代替大分子蛋白质,并从中寻找出活性中心,为后期的实际应用提供了一种更高效的手段。 20世纪初,Fischer首次合成出了特定序列的多肽[16]。 随后,Merrifield[17]以树脂为固相载体,开创了多肽的固相合成方法,将多肽的合成研究推向了高潮。 此后,日益完善的实验条件以及多肽高效液相色谱分析、纯化等技术的发展,使合成大量的多肽分子成为了可能。 而Mitchell[18]于2008年提出的标准固相合成方法(SPSS),更是成功地实现了对任意序列多肽的合成。 SPPS的原理是将多肽C端的首个氨基酸通过酯化反应固定在不溶性的树脂上,然后以此氨基酸作为氨基组分形成肽键,后经过反复的偶联-清洗-去保护-清洗,从而获得所需长度的肽链。 该方法的优点是可以在多肽的两端或者特定氨基酸残基上修饰其他功能基团,修饰后的多肽仍保留对目标分析物的高亲和性和高选择性。 随着自组装多肽纳米材料在组织工程、药物输送、催化材料、生物传感以及纳米器件等领域的大量研究,更是将多肽研究推向了高潮。
1.1.2 多肽的应用
1)基于多肽-纳米材料复合材料的研究。 纳米材料具有独特的光学、电学、磁性和催化性质,因此常作为信号发生器参与生物分析和化学研究[19,20,21,22,23]。 由于多肽具有良好的生物相容性及易修饰性,因此成为在纳米材料表面修饰和改性的主要手段。 研究人员通过共价或非共价结合的方式使多肽或多肽衍生物修饰在材料表面,既能改变纳米材料的固有属性,也能产生目标物的特异性识别位点,进而实现生物传感、药物输送及细胞靶向[24]。 例如,五肽CALNN可通过半胱氨酸中的巯基实现在金纳米粒子上的自组装,其另一端的两个天冬酰胺能够提供更多的负电荷增强金纳米粒子在复杂环境的稳定性[25]。 这种多肽用于制备特异性的多肽-金纳米粒子探针,并广泛地用于细胞等复杂体系中。
2)基于多肽的分子自组装。 分子自组装是指单个或多个分子通过分子间作用力组装成纳米或者微米尺度的有序结构。 自组装多肽是指多肽单体之间能通过静电相互作用、氢键作用力、亲水疏水作用等非共价键自发形成稳定的多聚体,而得到具有不同结构和功能的多肽纳米材料的多肽分子[26,27,28,29]。 根据其特征和功能的区别,可分类为:分子涂料[30]、分子胶囊[31]、纳米微管、分子开关[32]和分子积木[33]等。 自组装多肽纳米材料以其固有的特点和优势,在组织工程、药物载体、催化材料、纳米器件和生物传感等研究领域都表现出了巨大的应用前景。
1.2.1 金纳米粒子的概述
纳米材料是指在三维空间中至少有一维处于纳米尺寸(0.1~100 nm)或者由它们作为基本单元构成的材料。 由于其比表面积大、尺寸效应小和生物相容性好等特点,纳米材料具有许多不同于传统材料的独特性能,包括光学、热学、磁性和电学性能。 金纳米粒子作为纳米材料领域最重要的分支,在比色传感、拉曼研究、表面催化和细胞成像等方面有着广泛的应用[34,35,36]。 基于金纳米粒子的光学性质,可以构建肉眼可见的比色传感器。 随着金纳米粒子的粒径增大,其表面等离子体共振吸收峰渐渐红移,因而,其溶液的颜色依次呈现出橙黄色、葡萄酒红色、深红色和蓝紫色。 利用反应前后颜色变化和红移现象,快速检测目标物[37]。 而大粒径的金纳米粒子具有强大的荧光猝灭能力。 研究工作者通常利用其与荧光染料之间的距离效应,获取荧光信号的变化,从而实现目标物的定量分析[38,39]。 此外,金纳米粒子也具有表面等离子体共振效应,极大地增强了其表面分子的拉曼光谱强度,因此金纳米粒子常作为表面增强拉曼光谱(SERS)的增强基底,完成生物分析、细胞成像等研究工作[40]。 金纳米粒子还能催化化学反应,其表面可以选择性地氧化或还原物质,因此在燃料电池领域发挥重要的作用[19]。 如今,金纳米粒子可以通过多种方法合成,已成为了科研工作者的主要研究热点。
1.2.2 金纳米粒子的制备
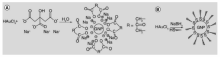
金纳米粒子制备的主要方法有3种:物理制备法、生物制备法和化学合成。 其中物理制备方法通常以大块固体为原料,将其以机械或者超声的方式进行粉碎、细化,从而得到不同尺寸的金纳米粒子。 生物制备方法则是将微生物作为合成金纳米粒子的生物模板,例如将天竺葵提取液中的内生真菌作为模板,与氯金酸混合,进而实现纳米粒子的制备[41]。 化学合成法,即利用化学反应生成金属原子并使其聚集成金属纳米粒子。 最常见的方法是水相中的化学还原(图1)。 通过向氯金酸中加入不同浓度的还原剂柠檬酸钠,将其还原成金原子,然后在剧烈的搅拌下制得不同粒径的金纳米粒子[42]。 而金纳米粒子的粒径与还原剂加入的浓度密切相关,即还原剂的浓度越高,所得到的金纳米粒子粒径越小,其稳定性越高。 反之,还原剂的浓度越低,金纳米粒子的粒径越大且越不稳定。 在此方法中,柠檬酸钠不仅作为还原剂参与了合成过程,而且在合成完成后还能以酸根离子的形式包覆在金纳米粒子的表面,通过增强粒子之间的静电斥力使之保持稳定。 但柠檬酸根吸附能力较弱,以致其容易被其他功能基团取代。 再者,由于柠檬酸钠的还原能力并不强,因此利用此类方法合成的金纳米粒子,其粒径很难低于10 nm。 为追求更小粒径的金纳米粒子,研究者选用硼氢化钠(NaBH4)作为还原剂进行水相化学合成(图1)[43]。 该反应在强还原剂的作用下,极大地缩短了反应所需的时间。 考虑到NaBH4合成的金纳米粒子表面缺少酸根离子的保护,需要额外添加保护剂,如十四烷基二甲基苄基氯化铵或十六烷基三甲基溴化铵,促使纳米粒子获得良好的稳定性和贮藏性[44]。 然而,稳定剂的加入却严重阻碍了金纳米粒子表面后续的配体交换以及功能化。 另外,还可使用植物萃取物作为还原剂,或利用脉冲辐射、超声波照射和微等离子体等方法制备金纳米粒子[45]。
由于金纳米粒子生物相容性高,同时具有良好的表面化学性质,因此将多肽修饰在金纳米粒子表面能够改变其表面的结构与状态,并赋予其新的功能,以便于后续的生物化学检测。 而多肽-金纳米粒子复合物的制备主要通过以下两种途径:共价结合和非共价结合。 研究人员可根据多肽的结构特性以及研究工作的实际需求,选择特定的结合方式[46]。
利用金纳米粒子独特的光学性质,科研人员可以通过调控其粒径大小或分散状态,实现在比色传感、拉曼检测,荧光传感等领域的应用。此外,由于金纳米粒子比表面积大,生物相容性好,越来越多的研究开始将金纳米粒子的特性和多肽的生物特性结合在一起,构建出多肽-金纳米粒子复合物,进一步应用于蛋白质、生物小分子和金属离子的检测。 而多肽在多肽-金纳米粒子体系主导的生物传感中发挥以下功能:1)作为传感器中的识别元件;2)用于金纳米粒子的稳定。
3.1.1 在蛋白酶检测中的应用
在疾病诊断及药物研究中建立一种能高灵敏、高专一地检测特定蛋白酶的方法十分重要。 研究人员利用多肽和蛋白酶之间的高度识别以及酶切过程,能够实现对蛋白酶的定量检测。 Dong等[52]通过将连接有金纳米粒子的特定多肽修饰在电极上,利用IV型胶原酶对多肽进行水解,从而释放金纳米粒子,并放大检测信号,实现了对IV型胶原酶的检测。 Pan等[53]设计了多肽GR-8对细胞凋亡酶的检测,这种多肽由于其等电点较低,修饰在金纳米粒子表面后不会使粒子发生聚集。 而当细胞凋亡酶 Caspase-3存在时,能特异性地识别多肽中的酶切位点,水解多肽并产生高等电点的碎片,从而促使金纳米粒子聚集。 根据上述原理,Pan等[53]将修饰有GR-8的金纳米粒子探针注入细胞内部,通过纳米粒子的聚集情况对细胞凋亡进行实时监测。 由于在细胞内金纳米粒子的分散状况至今依然存在争议,因此该方法有一定局限性。
Wu等[54]报道了一种基于酶切放大的“turn-off”型凝血酶表面增强拉曼光谱(SERS)传感器(图2)。 利用金纳米粒子的表面化学性质,设计出一种既能高度识别凝血酶又能使金纳米粒子聚集的多肽(RRRRRRRRR)。 通过调控凝血酶的酶切过程,以控制多肽的水解程度,进而实现对金纳米粒子聚集程度的控制。 随后结合SERS的高灵敏度,完成对凝血酶的定量检测。 这种策略简单快速,检出限为160 fmol/L,适用于低浓度检测,但其检测对象只能限定为凝血酶。 为了扩大检测范围,Wang等[55]设计了一种多肽P1(ALNNGGGGHAKRRLIFGGGC),使之同时具有胰蛋白酶、糜蛋白酶、蛋白分解酶、嗜热菌蛋白酶的酶切位点。 将修饰有荧光染料的多肽P1利用另一端的半胱氨酸固定在金纳米粒子表面,任意加入上述4种酶进行酶切反应,使荧光染料得到释放,从而捕获到增强的荧光信号并对蛋白酶进行定量。 但该方法的缺陷是,无法对这4种酶进行分辨。 为了进一步完善蛋白酶的检测方法,Guarise等[56]利用序列中含有凝血酶活性位点以及两端为半胱氨酸的多肽,触发金纳米粒子的聚集。 若该多肽先与凝血酶混合,被水解成多肽碎片后,则无法令纳米粒子聚集。 基于这个原理,可以实现凝血酶的定量检测,并且通过改变多肽序列中的酶切位点,可以设计出对目标蛋白酶具有特异性识别的多肽探针。 此外,Wu等[57]也提出了一种 “turn-on”型 SERS 蛋白酶检测策略。 通过设计一种等电点较低的多肽以提高金纳米粒子的稳定性,然后利用该多肽对应的蛋白酶进行酶切水解,致使金纳米粒子聚集并产生高强度的SERS 信号。 将胰蛋白酶和凝血酶这两种常见蛋白酶作为目标物进行检测,并进一步证实了该方法的通用性。 其中,胰蛋白酶检出限为85 fmol/L,而凝血酶检出限为8.32 pmol/L。 结果显示,这种方法对目标分析物具有高灵敏、高选择的特点,并为蛋白酶传感器的构建开创了新的思路。 上述几种报道充分地说明了多肽-金纳米粒子复合材料在构建蛋白酶传感器上具有极大的潜力,为搭建一种高效简便,专一灵敏的检测方法提供了良好的平台。
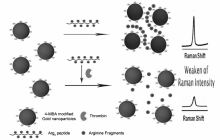 | 图2 基于酶切反应的凝血酶SERS传感器示意图[54]Fig.2 Strategy for fabrication of the SERS biosensor for thrombin based on enzymatic assays[54] |
3.1.2 在生物小分子检测中的应用
Qu等[58]建立了基于多肽的肝素SERS传感器。 他们在金纳米粒子表面修饰拉曼信号分子对巯基苯甲酸(4-mercaptobenzoic acid,MBA),并借助多肽 CALNN的保护能力使金纳米粒子体系更为稳定。 当体系中引入多肽RC-9时,金纳米粒子会由于CALNN和RC-9的配位作用发生聚集。 但当体系中同时引入多肽RC-9和肝素时,肝素与RC-9 能通过氢键、疏水作用和静电吸附等作用力牢固地结合在一起,致使金纳米粒子保持稳定分散状态。 利用这种原理可以对肝素进行定量检测,其检测限达到0.42 U/mL。 Wu等[59]将具有二维结构的二硫化钼与金纳米粒子组装在一起,促使纳米粒子附近的电磁场增强。 随后将能特异性识别三硝基甲苯(TNT)的多肽修饰在金纳米粒子上,通过对目标物TNT的高选择性捕获,从而实现定量检测(图3)。 另外,Wang等[60]利用多肽-金纳米粒子复合体系完成了对三磷酸腺苷(ATP)的传感检测。 他们将金纳米粒子修饰在金电极上,并在纳米粒子表面负载上ATP的适配体以及多肽,当加入目标物ATP时,适配体对其进行捕获并产生电信号,以快速灵敏的方式完成了对ATP的检测。 因此,合理地设计多肽的序列,能使多肽-金纳米粒子体系在生物小分子检测领域表现出高效的性能,促使其成为一种稳定的具有高选择性的传感材料。
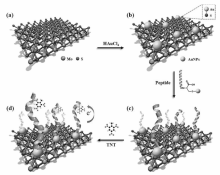 | 图3 基于纳米复合材料的爆炸物传感检测[59]Fig.3 The construction process of the biosensor based on the nanocomposites for explosive detection[59] |
3.1.3 在金属离子检测中的应用
基于多肽和金属离子之间的特异性作用,能实现多肽-金纳米粒子复合物对金属离子的定量检测。 Slocik等[61]设计了一段名为Flg-A3的多肽,其中A3段负责与金纳米粒子结合,而Flg段则作为识别序列用来捕获汞离子。 当修饰有Flg-A3的金纳米粒子体系中引入汞离子时,由于Flg-A3与汞离子之间的高度亲和使纳米粒子之间的距离变小,会产生聚集信号。 其后通过捕获体系的吸收光谱信号变化,实现对汞离子的高灵敏检测。 然而该方法对汞离子的选择性不高,尤其当铅离子存在时体系会受到明显的干扰。 Chai等[62]利用谷胱甘肽对铅离子的高亲和性以及半胱氨酸(Cys)对金纳米粒子的共价结合作用,通过促使谷胱甘肽-金纳米粒子复合体系在引入铅离子之后产生聚集现象,实现对金属离子的定量分析。 该策略快速灵敏,对铅离子的选择性高,其检出限可低至100 nmol/L。
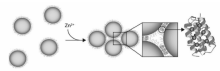
此外,Parnsubsakul等[63]设计了多肽EKEKEKPPPPC,并借助于该多肽与镍离子之间的高亲和性,构建了基于EKEKEKPPPPC-金纳米粒子复合物的镍离子比色传感器。 该策略完成了对镍离子快速、简单、高效的检测,其检出限为34 nmol/L,检测范围为60~160 nmol/L。Aili等[64]发现多肽(NAADLEKAIEALEKHLEAKGPVDAAQLEKQLEQAFEAFERAG)在锌离子的作用下,会形成四螺旋的特殊构象。 而这种构象上的卷曲和折叠是正是由于多肽和锌离子之间独特的相互作用。 根据上述现象,他们构建了基于锌离子诱导聚集的多肽-金纳米粒子体系的传感模型(如图4)。 首先利用半胱氨酸的巯基与金形成稳定的金-硫键实现多肽在金纳米粒子表面的修饰,后通过锌离子诱发的多肽折叠,使粒子表面性质发生改变,从而导致金纳米粒子的聚集。 该传感体系以锌离子介导的多肽构型折叠为基点,发展了一种快速、简单、高效检测锌离子的方法,也为此后基于多肽构型转变的生物传感奠定了一定的基础。 随后,Li等[65]建立了一种基于多肽RFPRGGD-金纳米粒子体系快速检测银离子的方法。 利用精氨酸与金纳米粒子之间的静电吸力实现多肽的修饰,而多肽另一端负电性的天冬氨酸则会由于与金纳米粒子之间的静电斥力促使整条肽段伸展在粒子表面,并起到静电保护的作用。 在银离子的存在下,精氨酸的氨基和天门冬氨酸的羧基会与其发生四配位。 于是,当向多肽-金纳米粒子体系中引入银离子时,由于银离子与肽段之间的配位作用使多肽在金纳米粒子表面的构象发生折叠,使粒子表面性质发生变化而诱发聚集,实现银离子的高效检测。 同时,此研究也为多肽和银离子之间的特异性作用提供了新思路。 根据上述研究,将具有特定序列的多肽作为金属离子的捕获器,并结合金纳米粒子独特的光学性质,能获得一种适用于金属离子检测的高效复合材料。 而这种多肽-金纳米粒子复合材料由于其低毒性、易制备、稳定性好等特点,使之在传感领域中获得快速的发展。
随着生物传感器的快速发展,研究人员不仅需要对金纳米粒子进行功能化,还需要在功能化之前实施必要的修饰及改性,而这种改性可能对金纳米粒子的稳定性及其后续功能化造成影响。 例如在SERS领域,需要在基底表面修饰具有SERS活性的拉曼染料,以提供可检测的拉曼信号[57,58]。 但这些拉曼染料往往会对金纳米粒子的稳定性造成不利影响,因此保持或提升金纳米粒子的稳定性是非常重要的。 而金纳米粒子的稳定可以通过十四烷基二甲基苄基氯化铵、十六烷基三甲基溴化铵、聚乙烯吡咯烷酮、聚乙二醇等表面活性剂的负载得以实现。 但这些方式会使金纳米粒子表面的配体交换和功能化更加困难。
多肽具有良好的生物相容性和较低的生物毒性,并且其易修饰,通用性高,序列设计灵活可控。 据文献[25,57]报道,通过合理地设计多肽序列,即能达到保护金纳米粒子的目的。 Levy等[25]设计并提出了一段多肽CALNN。 该多肽能通过其N端的半胱氨酸与金纳米粒子进行共价结合,同时其C端的两个天冬酰胺能提供较多的负电荷,以增强金纳米粒子之间的静电斥力,使粒子在高离子强度中保持稳定。 鉴于该多肽对金纳米粒子具有较强的结合能力和保护性能,常常作为锚定端参与多肽或DNA的修饰。 多肽CALNN已经被广泛地用于多肽-金纳米粒子体系,并被应用在细胞成像和药物输送等复杂环境中。 而在生物传感领域,CALNN则可保持金纳米粒子的稳定,从而提高信噪比以及降低探针的合成难度。 此外,Wu等[57]报道了一段多肽RCFRGGDD。 利用其N端带正电的精氨酸实现该多肽在金纳米粒子表面的负载,同时利用C端带负电的天冬氨酸以增强粒子之间的稳定性。 因此,在采用配体稳定金纳米粒子的体系中,多肽表现出极大的发展潜力和良好的发展前景。
Zhu等[66]研究了一种基于双配体(巯基嘌呤MP和多肽CALNN)修饰金纳米粒子的比色方法,用于快速、选择性地检测水溶液中的镉离子。 其中,CALNN配体用于提高体系的稳定性和选择性;MP作为功能配体通过N原子与镉离子发生配合作用,从而引起金纳米粒子聚集。 当体系中无镉离子时,溶液呈红色,随着镉离子浓度的增加,溶液颜色逐渐由红色变为蓝紫色,这种颜色变化可以通过光谱测定还可以用肉眼直接观察。 该方法利用多肽CALNN稳定的金纳米粒子复合体系,完成了高响应,高选择地检测镉离子,促进了后续基于双配体生物传感的快速发展。 Zhou等[67]利用CALNN的稳定性能将脱落酸稳定地负载在金纳米粒子上。 在脱落酸抗体与脱落酸的高亲和作用下,金纳米粒子发生团聚。 而当目标分析物脱落酸葡萄糖脂存在时,将率先与体系中的脱落酸抗体结合,从而使纳米粒子保持稳定。 通过紫外信号变化,能实现对脱落酸葡萄糖脂的定量分析。 该方法重现性好,灵敏度高,其检测范围为5 nmol/L~10 μmol/L,检出限为2.2 nmol/L。 Cortez等[68]建立了一种基于多肽稳定的酪氨酸酶-金纳米粒子生物纳米复合物的酚类传感检测。 将酪氨酸酶修饰在多肽CALNN稳定的金纳米粒子表面上,以提高其酶活力。 向体系中引入酚类物质,以捕获电化学信号的方式进行酚类物质的定量检测。 Hiroshi等[69]报道了一种基于多肽-金纳米粒子-糖类复合物的凝集素传感策略。 多肽CALNN有助于稳定金纳米粒子,以便于后续糖类的修饰。 通过目标分析物凝集素与糖类之间强大的结合能力,构建基于多肽稳定的糖类-金纳米粒子光学探针,实现凝集素的高灵敏传感检测。 该研究通过修饰糖类物质扩大了多肽-金纳米粒子复合体系的结构,为复合材料的后续发展提供了新的设计理念。
多肽也能作为锚定分子,在保持体系稳定分散的情况下,使待修饰分子固定在纳米粒子表面。 组氨酸能与重金属离子(Cd2+,Ni2+,Co2+)配合,但是其等电点高,带有大量正电荷,在修饰过程中容易导致带负电的金纳米粒子聚集。 为了使组氨酸与金纳米粒子能稳定地结合在一起,Zhang等[70]设计了含有CALNN 和多个组氨酸的多肽(CALNNHHHHHH)。 其中CALNN主要作为锚定分子,它不仅能使多个组氨酸组成的多肽(HHHHHH)修饰在粒子表面,还能保证多肽-金纳米粒子复合体系的稳定性,进而实现比色检测3种重金属离子(图5)。 而多肽FYSHSFHENWPS被发现能特异性识别心肌肌钙蛋白,但因其等电点高,无法稳定修饰在金纳米粒子表面。 于是,Liu等[71]设计了多肽CALNN-Peg4-FYSHSFHENWPS。 他们将CALNN作为锚定分子,使识别多肽(FYSHSFHENWPS)稳定地负载在金纳米粒子表面。 随后,利用识别多肽与目标分析物的高亲和性,引发金纳米粒子的聚集,进而完成对心肌肌钙蛋白的检测(图6)。 该检测方法简单快速,且耗时少,响应高,检出限可低至0.20 ng/mL。
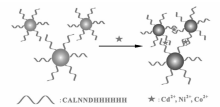 | 图5 基于多肽修饰的金纳米粒子体系检测金属离子[70]Fig.5 Schematic illustration of the colorimetric sensing Cd2+, Ni2+, or Co2+ using peptide-modified gold nanoparticles(P-AuNPs) as a color indicator[70] |
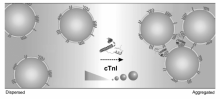 | 图6 基于金纳米粒子的cTnI检测示意图[71]Fig.6 Schematic illustration of the AuNP-based assay for detection of cTnI[71] |
在稳定金纳米粒子体系的同时,多肽CALNN还能作为传感模型中的识别元件,参与目标物的捕获与分析。 它能在传感前期使金纳米粒子保持稳定的分散,待引入目标物之后对其进行识别和捕获,进而引发响应信号。 Li等[72]利用CALNN维持金纳米粒子的稳定,随后利用铝离子与CALNN的高亲和性,诱导CALNN-金纳米粒子体系聚集,进而定量检测铝离子。 Huang等[73]建立了一种基于CALNN-金纳米粒子探针的溶菌酶传感模型。 首先利用CALNN使金纳米粒子体系具有良好的稳定性和分散性,随后向体系中引入高等电点的溶菌酶,以降低纳米粒子之间的静电斥力并促使其聚集,从而对人体血清中的溶菌酶进行检测。 其检出限能低至80 pg/mL,检测范围为1~25 ng/mL。
除了常见的五肽CALNN之外,研究人员开始着手于提出多功能的新型多肽,用于金纳米粒子体系的稳定。 Li等[74]提出了一段不含巯基的多肽RFPRGGDDDD,用以快速地稳定金纳米粒子。 他们利用精氨酸中的氨基与金之间强大的作用力实现多肽与金纳米粒子的复合,并通过另一端带负电的天冬氨酸大大地提高粒子的稳定性。 考虑到多肽-金纳米粒子体系良好的稳定性,他们通过一步加盐法实现了在纳米粒子表面快速、有效地负载巯基DNA,并利用三明治杂交引发DNA-金纳米粒子体系的聚集,完成了对目标DNA的传感检测。 此方法基于多肽-金纳米粒子复合物建立了一种新型的DNA负载方法,并拓展了该复合物在生物传感领域的应用。 上述研究表明,一些特定的多肽在改善金纳米粒子稳定性能的同时,还能为体系引入识别物质,从而有助于构建出简单高效,灵敏便捷且稳定可信的生物传感器。
多肽-金纳米粒子复合物巧妙地结合了金纳米材料的特性(如光学特性好,比表面积大,生物相容性高)和多肽独特的生物活性,因此广泛地受到研究人员的关注。 纵观近年来的发展,多肽-金纳米粒子复合物在生物传感领域显示出了良好的应用前景。 通过合理地设计多肽序列,可以将其作为识别元件对目标分析物进行高选择性捕获,以改变金纳米粒子的表面性质使其分散/聚集的状态发生变化,进而实现对目标物的定量检测。 当然,也可以将多肽设计成金纳米粒子的保护剂,使之在复杂环境中维持稳定,并为金纳米粒子在生物传感中的功能化和改性提供稳定的基础。 因此,将金纳米粒子的特性与多肽的生物学性质结合,在分析化学、生物医学等领域表现出极大的潜力,也为生化分析的发展提供了新的思路。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|