富勒烯官能化研究是富勒烯化学的重要组成部分。 近年来,随着富勒烯化学研究的深入发展,许多新颖富勒烯衍生物被陆续合成出来,并在生物医学和有机太阳能电池方面显示出良好的应用潜力。 与快速发展的富勒烯化学相比,富勒烯硫化反应研究进展较慢,近年来逐步引起广泛兴趣。 在此,我们结合本课题组开展的工作,对富勒烯硫化反应的最新进展进行总结。
Functionalization of fullerenes is an important part of fullerene chemistry. Many novel fullerene derivatives have been synthesized during recent years, and the compounds have exhibited promising potentials in biomedical chemistry and organic solar cells. Compared with the rapid development of fullerene chemistry, progress on the fullerene thiolation is slow, which has attracted more attention recently. Herein, the latest progress on the thiolation reactions of fullerenes is reviewed, which includes the recent result from our group.
以C60和C70为代表的富勒烯具有较高的电子亲和性[1]、良好的电子迁移率[2]和独特的电子结构[3],能够光催化产生活性氧物质(ROS)[4,5,6]、吞噬自由基[7,8,9],从而在有机太阳能电池[10,11,12,13]和生物医学[14,15,16,17,18,19]方面显示出良好的应用潜力。 近几十年来,富勒烯化学研究进展迅速,已发展出数目众多的富勒烯衍生化反应和富勒烯衍生化合物[20,21,22,23,24,25,26]。 与之相比,富勒烯硫化反应的研究进展比较缓慢。 尽管有机硫化合物是一类重要的有机化合物,具有许多重要性质,但由于C—S键不如C—C、C—O、C—N键等稳定,相应的富勒烯硫化反应研究相对较少。 早期报道的富勒烯硫化反应多涉及使用结构比较复杂的有机硫化物试剂,且反应条件较为苛刻。 探索使用常见的有机硫化合物试剂、使反应在温和条件下进行是目前富勒烯硫化反应的发展方向。 在此,我们结合本课题组开展的工作,对富勒烯硫化反应的研究进行总结。
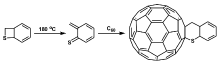
C60和C70是缺电子体系,可与富电双烯体分子进行Diels-Alder(D-A)反应,生成[6,6]-富勒烯加成化合物[20]。 受此启发,Eguchi等[27]报道了C60与 α, β-不饱和硫代羰基化合物发生杂D-A反应生成硫原子与C60直接相连的富勒烯硫化物。 如图1所示,异硫氰酸酯与乙烯基溴化镁反应生成硫代丙烯酰胺,
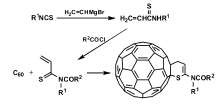 | 图1 C60与 α, β-不饱和硫代羰基化合物的杂D-A反应[27]Fig.1 Hetero-D-A reaction of C60 with α, β-unsaturated thiocarbonyl compound[27] |
硫代丙烯酰胺再与酰氯化合物反应生成 α, β-不饱和硫代羰基化合物,最后与C60发生杂D-A反应,生成C60二氢硫代吡喃衍生物。 该产物经质谱、氢、碳核磁等光谱方法进行了表征,确定了产物的结构,是第一个结构明确的硫原子与富勒烯直接成键相连的富勒烯硫化衍生物。
Eguchi等[28]进一步扩展了硫代双烯体底物范围,研究了原位生成的 o-thioquinonemethide与C60发生杂D-A反应。 如图2所示,该反应首先是将benzothiet加热至180 ℃原位生成 o-thioquinonemethide。 该双烯体中间体与C60反应生成C60苯并四氢硫代吡喃衍生物,其结构经质谱、氢、碳核磁等光谱方法进行了表征。
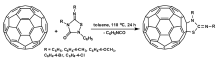
Niclas等[29]报道了噻二唑啉亚胺酮衍生物(5-imino-1,2,4-thiadiazolidine-3-ones)与C60反应得到C60噻唑啉亚胺衍生物(fullerene-fused 2-imino-1,3-thiazolidines)。 在Ar气保护下,C60与5-imino-1,2,4-thiadiazolidine-3-ones在110 ℃甲苯溶液中回流24 h,可生成C60噻唑啉亚胺衍生物,反应过程如图3所示。 反应考察了底物中R取代基范围,发现当R为C6H5、C6H4-4-CH3、C6H4-4-OCH3、C6H4-4-Br及C6H4-4-Cl时,反应均可进行。 获得的产物经由高分辨质谱,红外光谱、紫外可见光谱、氢谱和碳谱核磁表征确认。
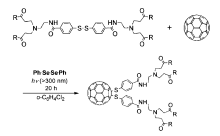
Takaguchi和Akasaka等[30]报道了光诱导的C60与树状二硫化物分子的加成反应,生成了C60二硫代树状分子衍生物。 如图4所示,在大过量二苯基二硒化物((PhSe)2:C60≈4940)存在时,C60和树状分子二硫化物在邻二氯苯中用高压汞灯( λ>300 nm)进行照射,在常温下N2气氛围中照射20 h得到了C60二硫化衍生物。 在相同的条件下,当没有二苯基二硒化物存在时,不能生成C60二硫化衍生物,表明二苯基二硒化物是光能量捕获剂,在反应中起到能量传递的作用。 C60二硫化树状分子产物的结构通过质谱、紫外可见光谱、氢谱和碳谱核磁进行了表征确认。
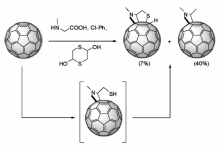
Martín等[31]报道了C60与 N-甲基甘氨酸和1,4-二噻烷-2,5-二醇在氯苯中回流,以极高的区域选择性生成了具有 cis-1结构的C60吡咯烷四氢噻吩并环产物,其反应过程如图5所示。 在反应过程中可能经历C60吡咯烷硫醇中间体,并由硫醇完成与C60的分子内亲核反应生成产物。 化学计算表明由于硫醇进攻C60时活化能较高,不利于反应发生,因此该反应的硫化产物产率较低。 此外,由于C60吡咯烷硫醇中间体容易脱除SH,而使C60吡咯烷化合物意外成为主要产物。 通过质谱、紫外可见光谱、红外、核磁氢谱和核磁碳谱对反应产物的结构进行了表征。
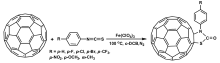
如上所述,早期的富勒烯硫化反应中硫化试剂多为结构复杂、难以获得的化合物分子。 随着研究的深入,一些常规试剂如异硫氰酸酯等被用来进行富勒烯的硫化研究。 北京大学的甘良兵课题组报道了富勒烯过氧化合物与芳基异硫氰酸酯的反应[32,33],生成了一系列具有环硫、噻唑啉酮、异硫氰酸酯等基团的富勒烯硫化衍生化合物(图6),并获得多种富勒烯硫化产物的单晶结构(图6)。 通过单晶结构,确定了C60异硫氰酸酯化合物分别有C60—SCN和C60—NCS两种不同成键方式的异构体产物。 由于该反应起始物为富勒烯过氧化物,而非C60分子,因此反应的应用范围受到一定限制。
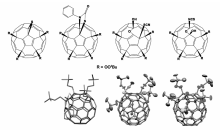 | 图6 富勒烯过氧化合物与芳基异硫氰酸酯的反应生成化合物结构示意图和对应的单晶结构图[32,33]Fig.6 Illustrated structures and single-crystal structures of the thiolated compounds obtained from the reaction of fullerene peroxides with aryl isothiocyanates[32,33] |
湖北大学的李法宝课题组报道了C60与芳基异硫氰酸酯的反应,生成了C60噻唑啉酮衍生物[34]。 如图7所示,在N2气保护下的100 ℃ o-DCB(邻二氯苯)溶液中,C60与包括苯基及 p-F、 p-Cl、 p-Br、 p-CF3、 p-NO2、 p-OCH3和 m-CH3取代的苯基异硫氰酸酯在高氯酸铁作用下,一步反应生成了一系列的C60噻唑啉酮衍生物。 结果表明,苯基上无论是带有吸电子基团还是给电子基团,芳基异硫氰酸酯均能和C60发生反应得到相应的C60噻唑啉酮衍生物。 产物结构通过高分辨质谱,红外光谱、紫外可见光谱、核磁氢谱和核磁碳谱进行了表征。 该反应由于直接使用C60分子做为起始物,具有更好的应用范围。 值得注意的是反应中使用的异硫氰酸酯仍为芳基异硫氰酸酯,与甘良兵课题组使用的试剂相同,表明芳基对于活化异硫氰酸酯可能具有一定的作用。
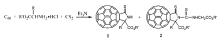
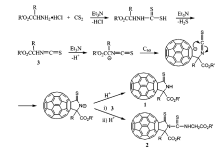
CS2由于性质稳定,常用作有机溶剂。 CS2对富勒烯有着非常好的溶解性,常被用作富勒烯的化学反应溶剂及核磁测试溶剂。 由于其廉价易得,若可用于富勒烯硫化反应,具有良好的应用前景。 中国科学技术大学的王官武课题组报道了使用CS2进行硫化富勒烯的研究工作[35,36]。 如图8所示,在N2气保护、室温及三乙胺存在条件下,二硫化碳与氨基酸酯和C60进行三元反应,得到两种C60硫代 γ-内酰胺产物。其中产物1为主要产物,化合物2为副产物[35]。 产物结构经质谱、紫外可见光谱、氢谱和碳谱核磁进行了表征,确定产物中未形成C60—S键。
反应机理如图9所示。 在碱作用下,氨基酸酯与CS2反应生成二硫代氨基甲酸酯。 其在三乙胺作用下失去H2S得到异硫氰酸酯,在碱作用下失去质子生成碳负离子中间体,与C60进行亲核反应并后续进行分子内成环、质子化反应得到产物1。 产物1前体与原位生成的异硫氰酸酯反应、经质子化后生成副产物2。
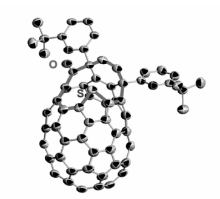
我们课题组最近报道了在铜催化氧气氧化条件下C60与一级脂肪胺和CS2的反应[37],得到了C60噻唑啉硫酮衍生物(图10)。 化合物结构由X射线单晶衍射确定(图11),同时还通过质谱、紫外可见光谱、氢谱和碳谱核磁进行了表征。
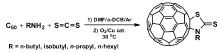 | 图10 C60与一级脂肪胺和CS2的反应[37]Fig.10 Reaction of C60 with aliphatic primary amines and C |
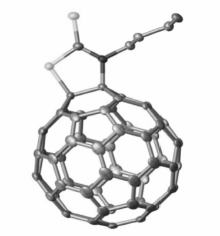 | 图11 C60噻唑啉硫酮衍生物(R=正丁基)的单晶结构图[37]Fig.11 Single-crystal structure of [60]fullerothiazolidinethione(R= n-butyl) with 50% thermal ellipsoids[37] |
现场可见近红外光谱分别在1074、1036、995和928 nm处出现了对应
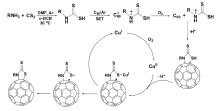 | 图12 合成C60噻唑啉硫酮衍生物的反应机理图[37]Fig.12 Proposed reaction mechanism for the formation of [60]fullerothiazolidinethione[37] |
值得注意的是,该工作与C60硫代内酰胺合成反应[35]相似,均涉及CS2和一级胺反应生成二硫代氨基甲酸酯这个中间体。 但是由于反应条件不同,原位生成的二硫代氨基甲酸酯发生了不同的后续反应,而导致后续与C60反应结果不同。
富勒烯硫化反应不仅可用于富勒烯衍生化,还可用于扩大开孔富勒烯孔径及制备碳笼骨架含有硫原子的硫杂富勒烯 (thiafullerenes)化合物。 Murata等[39]报道了具有16-元环开口C60羰基衍生物与单质硫在四(二甲氨基)乙烯 (TDAE)作用下的反应。 通过控制TDAE的用量,可获得两种具有更大开孔的硫化C60衍生物,开环大小分别为17-元环和18-元环,孔径达到0.6804和0.7101 nm。 同时,通过改变TDAE的用量,还可以消除C60骨架上的一个碳原子,并将硫原子引入到碳笼骨架上,生成具有17-元环开口的C59S开孔硫杂C60衍生物,开孔尺寸进一步扩大,达到0.7165 nm。 由于具有较大的开口,这3种衍生物均易在富勒烯笼内捕获一个H2O分子,结构经X射线单晶衍射(图13)和1H NMR确认。 以具有13-元环开口的C70羰基衍生物进行这一反应发现,与C60类似物不同,该硫化反应生成了具有12-元环开口的C69S开孔硫杂富勒烯衍生物,其结构获得X射线单晶衍射表征确认(图14)[40]。
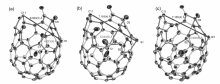 | 图13 (a)具有17-元环开口和(b)具有18-元环开口的开孔C60硫化衍生物单晶结构图[39]。(c)具有17-元环开口的开孔硫杂富勒烯C59S单晶结构图[40]Fig.13 Single-crystal structures of (a)an open-cage C60 derivative with the 17-membered ring opening, (b)an open-cage C60 derivative with the 18-membered ring opening, and (c)an open-cage thiafullerene C59S derivative with the 17-membered ring opening[39] |
硫醇是一种常见的硫化试剂,但目前尚未有硫醇与富勒烯直接反应进行硫化的报道,而只有硫醇与卤化富勒烯反应进行硫化的报道。 Troshin等[41,42]报道了多加成富勒烯衍生物C60Cl6和C70Cl10与硫醇在有机碱作用下发生反应,
生成C60[SR]5H和C70[SR]5H的反应。化合物C60[SR]5H的结构经X射线单晶衍射确认(图15),其中SR基团和H的位置与C60Cl6中Cl原子的位置完全相同,反应结果类似于取代反应[41]。 C70[SR]5H的结构则依赖于核磁表征和化学计算确定。 与C60[SR]5H的情况不同,C70[SR]5H中的SH和H的位置与C70Cl10中Cl原子的位置完全不同,加成基团的位置从C70Cl10中赤道的位置变换为C70[SR]5H中在C70的一个顶点的位置(图16)[42],显示出C70与C60不同的反应性质。
本文综述了富勒烯与有机硫化合物的反应的研究进展,回顾了富勒烯与原位生成的硫代双烯化合物、噻唑啉衍生物、二硫化物、芳基异硫氰酸酯、CS2等试剂进行的反应,硫化反应在扩大开孔富勒烯孔径及制备硫杂富勒烯的应用,以及硫醇与多卤化富勒烯反应制备多硫化富勒烯化合物。 早期的富勒烯硫化反应经常采用结构复杂且不易获得的硫化试剂。 随着研究工作的不断发展,简单常见的有机硫化合物如异硫氰酸酯和CS2等逐渐用于富勒烯硫化反应。 富勒烯硫化学是富勒烯化学的重要组成部分,相对于发展比较成熟的众多富勒烯领域,富勒烯硫化学仍处于初步的发展阶段,具有广阔的研究前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|