为了发展有效合成 α-腺嘌呤阿拉伯糖苷的方法,以1,2,3,5-四- O-乙酰基- β-D-阿拉伯糖和6-氯嘌呤为原料,在微波辐射和无溶剂、无催化剂条件下反应得到中间体9- α-D-(2',3',5'-三- O-乙酰基)阿拉伯呋喃糖基-6-氯嘌呤,收率85%。 该中间体物在Na2CO3催化下脱除乙酰基,然后“一锅”加入饱和的NH3/CH3OH溶液氨解,以90%的收率得到 α-腺嘌呤阿拉伯糖苷。 关键中间体9- α-D-(2 ',3 ',5 '-三 -O-乙酰基)阿拉伯呋喃糖基-6-氯嘌呤的合成反应规模可以扩大到100 g。 类似地合成 α-2-氟腺嘌呤阿拉伯糖苷和 α-2-氨基腺嘌呤阿拉伯糖苷。
In order to develop the efficient synthesis of α-adenine arabinoside, the key intermediate 9- α-D-(2',3',5'-tri- O-acetyl)-6-chloropurineside was obtained in 85% yield from the condensation of 6-chloropurine and 1,2,3,5-tetra- O-acetatyl- β-D-arabinose under solvent- and catalyst-free conditions with microwave irradiation. α-Adenine arabinoside was synthesized from the intermediate via deacetylation catalyzed by Na2CO3, followed by aminolysis in saturated NH3/CH3OH in one pot. The intermediate was obtained in consist yield even on a 100 g scale. The analogues α-2-fluoroadenine arabinoside and α-2-aminoadenine arabinoside were obtained via similar method.
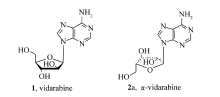
核苷碱基的阿拉伯糖苷具有广泛的生理和药理活性,如阿拉伯糖腺苷(vidarabine,9- β-D-阿拉伯呋喃糖基腺嘌呤)广泛用于治疗疱疹病毒、巨细胞病毒、乙型肝炎病毒引起的疾病以及急性白血病[1]。 从结构上来看,这些物质均为 β构型,其差向异构体 α-阿拉伯糖苷也是一类重要的活性物质。 如 α-阿拉伯糖腺苷(2a)是较好的抑制肿瘤细胞的先导药物(Scheme 1),具有和vidatabine类似的抗病毒活性[2]。 α-构型核苷的结构存在于维生素B12及其同族维生素中[3]。其独特的结构特点也产生了独特的生物学性质[4]。但迄今为止, α-阿拉伯糖苷一直作为合成 β构型的副产物,收率一般在5%以下[5]。 α-阿拉伯糖苷的单一构型合成并未引起合成工作者的关注。
传统方法中糖苷键的生成均是在有机溶剂中,需要路易斯酸催化[6]。 微波辅助的无溶剂、无催化剂条件具有操作简便、环境友好的优点,得到了有机化学工作者的密切关注,但是在糖苷键生成反应上的应用仅有一例非环核苷的报道[7]。
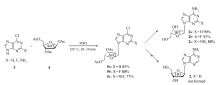
本文以廉价易得的卤代嘌呤(3)和1,2,3,5-四- O-乙酰基- β-D-阿拉伯糖(4)为原料,在无溶剂、无催化剂条件下,加热熔融反应,即可生成糖苷键,得到缩合物,然后经脱除乙酰基、氨解等步骤,高选择性地得到 α-腺嘌呤阿拉伯糖苷及其类似物,无 β-异构体的产生(Scheme 2)。
6-氯嘌呤(≥98%)、2-氟-6-氯嘌呤(≥98%)、2-氨基-6-氯嘌呤(≥98%)、1,2,3,5-四- O-乙酰基- β-D-阿拉伯糖(≥98%)购自新乡拓新医药股份有限公司;SnCl4、对甲苯磺酸(TsOH)、Triflic acid和其他常规溶剂购自上海阿拉丁生化科技股份有限公司,均为分析纯试剂;所用溶剂未经进一步处理。
AC 400型核磁共振仪(NMR,德国Bruker公司),DMSO- d6或CDCl3为溶剂,四甲基硅烷(TMS)为内标;UPLC-QTOFMS型高分辨质谱(HRMS,美国Waters公司);XRC-1型显微熔点仪(四川大学科仪厂,温度计未校正);MAS-I型微波合成仪(上海新仪微波化学科技有限公司)。
1.2.1 9- α-D-(2',3',5'-三- O-乙酰基)阿拉伯糖基-6-氯嘌呤(5a)的合成
6-氯嘌呤(0.308 g,2 mmol),1,2,3,5-四- O-乙酰基- β-D-阿拉伯糖(0.763 g,2.4 mmol)加入到反应瓶中,混合均匀,置于微波反应器内,设定最高功率为200 W,温度120 ℃,反应20 min,降至室温,TLC检测原料基本消失,加入无水乙醇(50 mL),加热至溶解,加入活性炭(0.2 g)脱色,趁热过滤,滤液真空浓缩,得淡黄色油状物0.759 g,收率85%。
1H NMR(CDCl3,400 MHz), δ:9.03(s,1H),8.41(s,1H),6.67(d, J=4.4 Hz,1H),5.49(t, J=4.0 Hz,1H),5.40(t, J=3.2 Hz,1H),4.44~4.36(m,2H),4.27~4.24(m,1H),2.09(s,3H),2.04(s,3H),1.79(s,3H);13C NMR(CDCl3,100 MHz), δ:170.3,169.6,169.4,152.8,151.0,149.0,143.8,134.6,86.5,80.4,73.1,70.5,63.0,20.8,20.6,20.4;HRMS计算值C16H17ClN4NaO7[M+Na]+ 435.0678,实测值435.0678。
1.2.2 9- α-D-(2',3',5'-三- O-乙酰基)阿拉伯糖基-2-氟-6-氯嘌呤(5b)的合成
2-氟-6-氯嘌呤(0.346 g,2 mmol),1,2,3,5-四- O-乙酰基- β-D-阿拉伯糖(0.763 g,2.4 mmol)加入到反应瓶中,混合均匀,置于微波反应器内,设定最高功率为200 W,温度120 ℃,反应25 min,降至室温,TLC检测原料基本消失,加入无水乙醇(50 mL),加热至溶解,加入活性炭(0.2 g)脱色,趁热过滤,滤液真空浓缩,得淡黄色油状物0.689 g,收率80%。
1H NMR(CDCl3,400 MHz), δ:8.27(s,1H),6.48(d, J=4.4 Hz,1H),5.47~5.45(m,1H),5.34(t, J=3.6 Hz,1H),4.46~4.38(m,2H),4.27~4.23(m,1H),2.12(s,3H),2.08(s,3H),1.86(s,3H);13C NMR(CDCl3,100 MHz), δ:170.3,169.4,168.4,159.8(d, JC—F=215.6 Hz),153.1(d, JC—F=16.2 Hz),151.0(d, JC—F=15.5 Hz),144.8(d, JC—F=2.8 Hz),132.4(d, JC—F=4.2 Hz),83.0,80.2,75.5,74.6,62.5,20.6,20.5,20.1. HRMS计算值C16H16ClFN4NaO7[M+Na]+ 453.0584,实测值453.0586。
1.2.3 9- α-D-(2',3',5'-三- O-乙酰基)阿拉伯糖基-2-氨基-6-氯嘌呤(5c)的合成
2-氨基-6-氯嘌呤(0.338 g,2 mmol),1,2,3,5-四- O-乙酰基- β-D-阿拉伯糖(0.763 g,2.4 mmol)加入到反应瓶中,混合均匀,置于微波反应器内,设定最高功率为200 W,温度120℃,反应30 min,降至室温,TLC检测原料基本消失,加入无水乙醇(50 mL),加热至溶解,加入活性炭(0.2 g)脱色,趁热过滤,滤液真空浓缩,得淡黄色油状物0.657 g,收率77%。
1H NMR(CDCl3,400 MHz), δ:8.40(s,1H),6.66(d, J=4.4 Hz,1H),5.48(t, J=6.8 Hz,1H),5.39(t, J=3.2 Hz,1H),4.43~4.35(m,2H),4.26~4.23(m,1H),2.08(s,3H),2.03(s,3H),1.78(s,3H);13C NMR(CDCl3,100 MHz), δ:170.3,169.5,169.3,152.7,150.9,148.9,143.7,134.6,86.4,80.3,73.0,70.5,62.9,20.7,20.5,20.3;HRMS计算值C16H18ClN5NaO7[M+Na]+ 450.0787,实测值450.0789。
1.2.4 α-阿拉伯糖腺苷(2a)的合成
NH3/MeOH氨解法 上述化合物5a加入到高压反应罐中,加入饱和NH3/MeOH溶液(100 mL),密封,100 ℃反应10 h(反应罐压力:0.2 MPa),冷却至室温,缓慢释放压力,反应液减压浓缩,得到淡黄色油状物,加入无水乙醇(20 mL),加热溶解,加入活性炭(0.1 g)脱色,趁热过滤,滤液减压浓缩,得到白色固体2a 0.95 g,收率79%。
一锅法 上述化合物5a加入到高压反应罐中,用MeOH(50 mL)溶解,加入Na2CO3(5.3 mg),室温搅拌1 h,TLC检测原料5a消失,再加入饱和NH3/MeOH溶液(50 mL),密封,100 ℃反应10 h(反应罐压力:0.1 MPa),冷却至室温,缓慢释放压力,反应液减压浓缩,得到淡黄色固体,加入无水乙醇(20 mL),加热溶解,加入活性炭(0.1 g)脱色,趁热过滤,滤液减压浓缩,得到白色固体2a 1.2 g,收率92%。 纯度>98%[HPLC归一化法:色谱柱Kromasil C18柱(4.6 mm×150 mm,5 μm);流动相( V(水): V(乙腈)=1:1);检测波长254 nm;流速1 mL/min;进样量10 μL]。
白色固体,mp 212~214 ℃(文献[8] mp 213 ℃)。1H NMR(DMSO- d6,400 MHz), δ:8.35(s,1H),8.14(s,1H),7.37(brs,2H),6.02(d, J=4.4 Hz,1H),5.48(t, J=6.0 Hz,2H),5.23(d, J=4.4 Hz,1H),4.64~4.59(m,1H),4.16~4.13(m,1H) ,3.98~3.96(m,1H),3.70~3.53(m,2H);13C NMR(DMSO- d6,100 MHz), δ:155.9,152.4,149.4,140.3,118.2,84.0,83.6,75.6,74.9,60.8;HRMS计算值C10H14N5O4[M+H]+ 268.1040,实测值268.1046。
类似方法合成化合物2b和2c。
α-2-氟腺嘌呤阿拉伯糖苷(2b) 白色固体,mp 223~225 ℃。1H NMR(DMSO- d6,400 MHz), δ:8.17(s,1H),7.75(brs,2H),6.06(d, J=4.4 Hz,1H),5.66(d, J=5.6 Hz,1H),5.57(d, J=4.8 Hz,1H),5.12(d, J=5.2 Hz,1H),4.18~4.09(m,2H),3.79~3.76(m,1H),3.68~3.49(m,2H);13C NMR(DMSO- d6,100 MHz), δ:159.6(d, JC—F =230 Hz),157.6(d, JC—F=3.1 Hz),150.8(d, JC—F=20 Hz),140.6,116.6(d, JC—F=4 Hz),84.1,83.8,75.6,74.8,60.8;HRMS计算值C10H13FN5O4[M+H]+ 286.0946,实测值286.0948。
α-2-氨基腺嘌呤阿拉伯糖苷(2c) 白色固体,mp 246~248 ℃。1H NMR(DMSO- d6,400 MHz), δ:7.79(s,1H),6.66(brs,2H),6.13(d, J=4.4 Hz,1H),5.76(brs,2H),5.64(d, J=5.6 Hz,1H),5.52(d, J=4.4 Hz,1H),5.13(t, J=5.2 Hz,1H),4.09~4.03(m,2H),3.74(t, J=4.4 Hz,1H),3.66~3.46(m,2H);13C NMR(DMSO- d6,100 MHz), δ:160.2,156.0,151.6,137.1,112.4,84.1,83.3,75.6,61.1;HRMS计算值C10H15N6O4[M+H]+ 283.1149,实测值283.1153。
以6-氯嘌呤和1,2,3,5-四- O-乙酰基- β-D-阿拉伯糖的缩合为模板反应,考查溶剂、催化剂、投料比、反应时间、反应温度及反应规模对缩合产物收率的影响。 结果见表1。
| 表1 反应条件优化 a Table 1 Optimization of reaction conditions a |
由表1可知, n(3): n(4)=1:1,以二氯乙烷为溶剂,80 ℃反应2 h,以0.2倍化学计量的SnCl4为催化剂,收率为32%。 催化剂改变为TsOH时,收率相当。当催化剂改变为Triflic acid时,收率提高到42%。 再进一步筛选溶剂,发现乙腈和氯苯均不能很好反应。 令人高兴的是,当不使用溶剂,直接将原料混合熔融反应,收率可以提高到57%。 如果不加入催化剂,收率稍有增加,达62%。 于是在无催化剂和无溶剂条件下继续优化反应条件。 反应温度升高可以促进反应的发生。 当反应温度为120 ℃时,收率达70%。 继续升高温度,会使原料变黑碳化,同时会造成操作不便,未进一步升高温度。 进一步地,增加原料4的比例至1.2倍化学计量,收率提高到75%,继续增加至1.5倍化学计量,收率基本不再增加,所以以 n(3): n(4)=1:1.2为最优。 进一步,尝试在微波辐射下进行该反应,20 min时收率即可以得到85%,显示出微波对反应有较好的促进作用,继续延长反应时间,收率不再增加,所以以微波辐射下120 ℃的反应为最优。 综上,最优的反应条件为: n(3): n(4)=1:1.2,微波辐射,120 ℃,20 min,收率85%。
参考文献[9],缩合物5a在饱和NH3/MeOH溶液中高压反应,在脱除糖环上的乙酰基的同时,使6-Cl氨解。 但是在反应的同时产生3倍化学计量的乙酰胺,乙酰胺溶解在溶剂中,使产物难以析出。 为了解决这个问题,先加入相对于缩合物5a摩尔分数为5%的Na2CO3固体,室温搅拌1 h,酯交换脱除乙酰基,然后不需要分离,直接加入饱和NH3/MeOH溶液,高压氨解,得到产物2a,这样避免了产生过量的乙酰胺,产物2a很容易从反应体系中析出,不需要柱层析(Scheme 3)。
tri-O-acetyl)-6-chloropurineside'>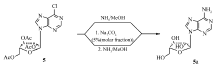 | Scheme 3 Deacetylation step of 9- α-D-(2',3',5'- tri-O-acetyl)-6-chloropurineside |
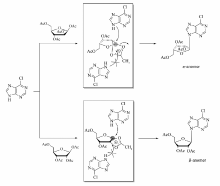
得到的产品均是 α-构型,糖基1'位氢与2'位氢偶合常数 J≈4.0 Hz。因为1,2,3,5-四- O-乙酰基 -β-D-核糖与6-氯嘌呤缩合,得到的是单一的 β构型产物,而1,2,3,5-四- O-乙酰基- β-D-阿拉伯糖与6-氯嘌呤缩合,得到的是单一的 α构型产物。 因此,可能的反应机理是:1,2,3,5-四- O-乙酰基 -β-D-阿拉伯糖在加热后,生成环鎓离子,由于2位羟基的位阻效应,6-氯嘌呤单一性地从 α位进攻端头碳,得到 α-构型产物(Scheme 4)。 原料3中吸电子基团Cl或F原子对于缩合反应非常关键,带有给电子基团氨基或甲氧基等,反应不能发生。
发展了一种在无溶剂、无催化剂条件下有效合成 α-腺嘌呤阿拉伯糖苷及其类似物的方法。以卤代嘌呤和1,2,3,5-四- O-乙酰基 -β-D-阿拉伯糖为原料,在微波辐射下,无溶剂、无催化剂地在熔融状态发生缩合反应,得到缩合物;缩合物在Na2CO3催化下脱除乙酰基,“一锅”加入饱和NH3/CH3OH溶液氨解,以2步和76%的总收率得到 α-腺嘌呤阿拉伯糖苷。 缩合反应可以扩大到100 g的反应规模,收率没有降低。 2-氟-6-氯嘌呤、2-氨基-6-氯嘌呤也能很好地反应。 推测的反应机理显示,碱基从位阻较小的 α位进攻环鎓离子,从而单一性地得到 α构型产物。 对比传统方法,该方法避免使用重金属催化剂和有机溶剂,操作简便,中间体及产物可以通过结晶的方法纯化得到,为 α-腺嘌呤阿拉伯糖苷及其类似物的合成及活性研究提供了有益的参考,同时显示出潜在的应用价值。
辅助材料(Supporting Information)[产物及中间体的1H NMR和13C NMR图谱]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|