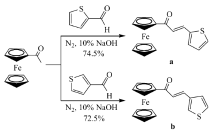
二茂铁是合成新颖有机功能材料的基本单元之一。 本文设计并合成了两个基于二茂铁的同分异构查尔酮衍生物:1-二茂铁基-3-(噻吩-2-基)丙烯酮(a)和1-二茂铁基-3-(噻吩-3-基)丙烯酮(b)。 采用超快激光Z-扫描技术(脉宽180 fs,波长532 nm)测定了化合物a和b的三阶非线性光学性质。 结果表明,化合物a吸收系数 β=-2.1×10-12 m/W,折射率 n2=1.9×10-19 m2/W,分子超极化率 γ=5.37×10-32 esu;化合物b: β=-1.2×10-13 m/W, n2=2.0×10-19 m2/W, γ=4.48×10-32 esu。 说明在飞秒激光激发下,电荷转移能够在化合物a和b分子内部快速进行,二者均具有优异的超快三阶非线性光学响应。 在B3LYP/6-311+G(d,p)理论水平下,计算了化合物a和b分子轨道能量、极化率和各基团在前线分子轨道中的占有率。 理论计算结果显示,二茂铁基团在化合物a和b前线分子轨道中占有率分别为97%和98%,对两化合物的非线性光学性能起主导作用。
Two ferrocene-based isomeric chalcone derivatives 1-ferrocenly-3-(thiophen-2-yl) prop-2-en-1-one(a) and 1-(ferrocenly)-3-(thiophen-3-yl) prop-2-en-1-one(b) were synthesized. Their third-order nonlinear optical properties were measured by Z-scan technique with ultrafast laser operating at 532 nm laser in 180 fs pulse, respectively. The relevant parameters were given as follows: the nonlinear absorption coefficient β=-2.1×10-12 m/W, the nonlinear refractive index n2=1.9×10-19 m2/W and the third-order nonlinear hyperpolarizability γ=5.37×10-32 esu for compound a; β=-1.2×10-13 m/W, n2=2.0×10-19 m2/W and γ=4.48×10-32 esu for compound b. The results indicate that the excitation of femtosecond laser enables intramolecular charge transfer to occur quickly. Thus two compounds can exhibit ultrafast third-order nonlinear optical response. The orbital energies, polarizabilities and possession ratios of different groups in frontier molecular orbitals of compounds a and b were calculated by B3LYP/6-311+G(d,p) level. The percentage of ferrocene group in the frontier molecular orbitals of compounds a and b is 97% and 98%, respectively, which indicates that ferrocene group plays a leading role in the nonlinear optical properties of two compounds.
具有三阶非线性光学(NLO)性质的有机材料在光子技术中起着重要的作用[1,2,3,4]。 与无机材料相比,有机NLO材料具有更多的优势,例如更大的NLO吸收系数,更大的分子超极化率,更快的响应时间,更易加工,成本更低等[5,6,7]。 因此,在过去的十几年中,为了提高光子器件的性能和效率,科学家们一直在努力寻求具有优异三阶NLO特性的有机材料[3,4,5,6,7,8,9,10]。 有机非线性光学材料的基本结构是基于 π-键的共轭体系, π轨道的共轭作用扩大了电荷分布范围,提高了电子的高流动性,致使其呈现出良好的NLO性质[11]。 一般而言,在高强度激光条件下,材料的NLO性质分为非线性吸收(NLA)和非线性折射(NLR)的变化。 在激光诱导作用下,大多数有机材料的吸收值可以显示出变化[12,13,14]。 近年来,出现了碳纳米管、石墨烯等不同类型的NLO材料[15,16]。 作为一种有机材料,查尔酮及其衍生物的分子结构设计和合成简单易行,许多查尔酮衍生物具有良好的非线性光学响应而受到高度关注[17,18,19,20,21]。 二茂铁是构建非线性功能的最有潜力的基元之一,且二茂铁基和噻吩基均是拥有较强给电子能力的芳香基团,二者在光学材料中备受瞩目[22,23,24,25,26,27,28]。 将这两个基团同时引入查尔酮结构中,有利于提高分子内电荷转移效应从而调整三阶NLA和NLR性质并增大三阶非线性超极化率,有可能得到优良的NLO材料。
本文设计和合成了两个同时含有二茂铁基和噻吩基的同分异构查尔酮衍生物1-二茂铁基-3-(噻吩-2-基)丙烯酮(a)和1-二茂铁基-3-(噻吩-3-基)丙烯酮(b)(合成路线如Scheme 1所示),采用量子化学方法计算了两分子中二茂铁基团在前线分子轨道上的占有率、两分子的轨道能量和极化率,测定并模拟了它们在二氯甲烷溶液中的紫外-可见吸收光谱,在此基础上考察了两个化合物的三阶NLO性质。
WRS-1B型数字熔点仪(中国上海精密科学仪器有限公司),温度未校正;Bruker Advanced III型核磁共振仪(NMR,瑞士Bruker Biospin公司);Thermo Q Exactive型台式四极杆-轨道阱高分辨质谱仪(HRMS,德国Thermo Fisher scientific公司),ESI离子源;UV-2550型紫外可见分光光度计(UV-Vis,日本岛津公司);NETZSCH STA 449F3型综合热分析仪(TGA,德国Netzsch公司);Nd:YAG(NT 342B)型可调谐激光器(立陶宛EKSPLA公司,波长532 nm,脉冲宽度180 fs)。
乙酰基二茂铁、噻吩-2-甲醛、噻吩-3-甲醛均购自北京百灵威科技有限公司,纯度≥98%。
在250 mL三口瓶中,依次加入3 mmol(0.68 g)乙酰基二茂铁、3 mmol(0.34 g)噻吩-2-甲醛或噻吩-3-甲醛、40 mL无水甲醇,磁力搅拌10 min后加入3 mL质量分数为10%的NaOH溶液,N2气保护条件下室温搅拌反应20 h(期间薄层色谱TLC跟踪检测反应进程, V(乙酸乙酯): V(石油醚)=1:4),控温50~60 ℃,反应2 h,自然冷却到室温,抽滤,用甲醇洗涤滤饼2次,抽干,真空干燥得产物。
化合物a 0.72 g,产率74.5%;mp 95.0~95.6 ℃。1H NMR(600 MHz,DMSO- d), δ:7.80~7.77(d,1H, J=15.6 Hz,olefin-H),7.74~7.73(d,1H, J=4.2 Hz,thiophen-H),7.64(s,1H,thiophen-H),7.18(s,1H,thiophen-H),7.11~7.08(d,1H, J=15.6 Hz,olefin-H),4.99(s,2H,mau-H),4.67(s,2H,mau-H),4.22(s,5H,mau-H);13C NMR(150 MHz,DMSO- d), δ:192.04,140.32,133.03,132.36,129.89,129.15,122.60,80.95,79.58,73.25,70.30,70.04;HR-MS(ESI) m/z:实测值323.01910;计算值C17H15FeOS([M+H]+):323.01875。
化合物b 0.70 g,产率72.5%;mp 153.0~153.5 ℃。1H NMR(600 MHz,DMSO- d), δ:8.051(s,1H,thiophen-H),7.76(s,1H),7.67~7.64(d,2H, J=16.2Hz),7.28~7.26(d,1H, J=15.6 Hz),5.03(s,2H),4.66(s,2H),4.22(s,5H);13C NMR(150 MHz,DMSO- d), δ:192.71,138.80,134.11,129.94,128.00,126.69,123.76,81.20,73.08,70.24,70.07;HR-MS(ESI) m/z:实测值323.01905;计算值C17H15FeOS([M+H]+):323.01875。
有关各化合物结构表征图谱参见辅助材料。
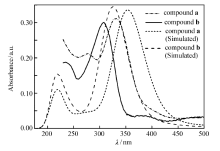
分别配制化合物a、b的二氯甲烷溶液,浓度均为1.0×10-5 mol/L,测定了这两种异构体的紫外-可见吸收光谱;同时在相同条件下,采用Gaussian 09程序[29]模拟了化合物a和b的紫外-可见吸收光谱(图1),与实验结果进行直观比较。
由图1可知,化合物a和b的最大吸收波长和吸光度,并计算了该两化合物的摩尔消光系数,如表1所示。
| 表1 化合物a和b的实验与模拟紫外-可见光谱数据 Table 1 Experimental and simulated UV-Vis spectral data of compounds a and b |
由图1和表1可见,实验测试和理论模拟均显示,化合物a的最大吸收波长比化合物b的稍大,只是理论模拟显示前者比后者增大了28 nm,而实验测试显示前者比后者增大了22 nm,这与理论模拟所得的化合物a的能隙(3.37 eV)稍小于化合物b的能隙(3.60 eV)相一致(表2)。 从构效关系上看,噻吩环的2-位连接所形成的查尔酮衍生物a比3-位连接时的化合物b共轭效应要强一些,原因在于噻吩环的2-位电子云密度比3-位更大,更有利于进行分子内电荷转移而减小能隙,据此可以预测化合物a的三阶NLO性能优于化合物b,因为能隙越小越有利于分子由基态跃迁到激发态而引发分子内电荷转移。 另外,理论模拟显示,化合物a与b的摩尔消光系数相近且前者稍小于后者,由图1和表1可见实验测试和理论模拟基本一致。 从整体上看,实验测试和理论模拟基本相符,证明所采用的密度泛函计算方法合理,在一定程度上也说明了理论模拟的前瞻性和重要性。
| 表2 化合物a和b的分子轨道能量与极化率 Table 2 Molecular orbital energy and polarization of compounds a and b |
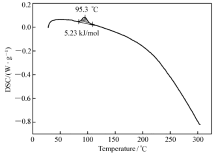
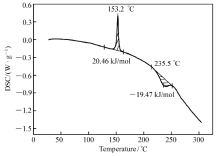
通过差示扫描量热法(DSC)首先测定了化合物a和b的DSC曲线,温度范围为30~300 ℃,升温速率为2 ℃/min(图2和图3)。
由图2可知,化合物a的吸热熔融峰的中心点温度为95.3 ℃,与其熔点95.0~95.6 ℃相一致,其熔融焓为5.23 kJ/mol,继续升温到300 ℃未见分解现象;化
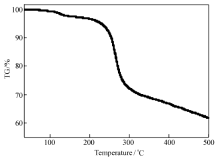
合物b的吸热熔融峰的中心点温度为153.2 ℃,与其熔点153.0~153.5 ℃相一致,其熔融焓为20.46 kJ/mol,升温到235.5 ℃左右出现一疑似放热分解峰,其焓为-19.47 kJ/mol。 为进一步证实这一假设,补测了化合物b的热重(TG)曲线图,见图4(温度范围为35~500 ℃,升温速率为2 ℃/min)。图4显示,化合物b低于220 ℃基本无失重现象,显示出该化合物具有良好的热稳定性。 温度由220 ℃升至280 ℃的过程中渐渐分解失去噻吩环,在280 ℃时失重24.60%,与理论上噻吩环的失重率25.69%基本吻合。 由此证明,图3中化合物b的DSC曲线上235.5 ℃左右出现的峰确实是放热分解峰,因为在快速失重区出现一个放热峰或吸热峰往往是化合物分解的标志[30,31,32]。
从整体上看,化合物a升温到300 ℃未见分解现象,化合物b被加热到220 ℃以上才开始快速失重并分解,说明这两个同分异构体表现出较好的热稳定性,可以满足制作NLO器件的一般要求。
为了改善有机材料的光学性能,需要了解有机化合物的分子结构、电子结构和NLO性质之间的关系。 考虑到二茂铁基和噻吩基均具有较强的给电子能力,前者的 π-轨道和后者噻吩环上参与共轭的硫原子的 p-轨道电子云的离域共轭对有机材料的NLO性质均有重要贡献,在B3LYP/6-311+G(d, p)[33,34]理论水平上优化并计算了化合物a和b的自然轨道(NBO)、最高占据轨道(HOMO)和最低空轨道(LUMO)的电子云图(图5),所有计算均在Gaussian 09程序[29]上完成。
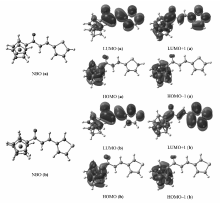 | 图5 化合物a和b的自然轨道与前线分子轨道Fig.5 Natural bond orbitals(NBOs) and frontier molecular orbitals of compounds a and b |
通过计算分析,获得了化合物a和b的分子轨道能量和共轭电子体系的极化率(表2)。
同时,为了进一步更准确地分析非线性光学响应,用GaussSum程序[35]计算了化合物a和b的分子轨道能量以及两分子中各组分在分子轨道的能量占有率(计算中考虑了DMSO溶剂化效应,Fc表示二茂铁, C=O表示羰基,占有率精确到1%,表3)。
| 表3 化合物a和b分子前线轨道中各基团的占比 Table 3 Possession percentage of each component occupied in frontier orbitals of compounds a and b |
由表3可知,化合物a与b在基态时的HOMO能量相等且a分子的LUMO与HOMO之间的能隙更小,这说明化合物a分子中π电子更易于被极化而由基态变为激发态,化合物a的极化率比化合物b的大正好说明这一点。 由图5和表3可见,二茂铁基团上的电荷在两分子内的占比最大,这反映了二茂铁基团中两个茂环和Fe2+离子形成的特有的夹心型芳香结构对两分子中电荷转移的贡献最大。 另外,极化率数据表明,噻吩环2-位连接比3-位连接 π电子更易于被极化,相应的NLO性质也更好,这一点可由实验测定的三阶非线性分子超极化率( γ)进一步证实,并且与之前的预测相一致。
一般来说,在HOMO或HOMO-1中的电子被光激发后跃迁到LUMO或LUMO+1。图5和表3显示,化合物a和b分子中的二茂铁基是进行跃迁的最主要的电子给体。因此,对NLO性质的主要贡献应归功于二茂铁基团。 在分子a和b中,环外C=C双键(或乙烯基)分别与噻吩环的2-位和3-位相连,共轭体系由二茂铁基和噻吩基通过丙烯酮不饱和链桥联而成。 相比较而言,化合物a比b具有更高的二茂铁基平均分子轨道占有率[其中化合物a中为(58%+12%+97%+99%)/4=66.50%,化合物b中为(39%+16%+98%+100%)/4=63.25%],这表明化合物a应该比化合物b具有更强的NLO效应。值得注意的是,在化合物a中,HOMO和LUMO中噻吩基的占有率分别为1%和30%,而在化合物b中的占有率分别为1%和20%。 这说明化合物a分子中的电子更易由HOMO跃迁到LUMO,反映了化合物a的分子内电荷转移效应更强,这与紫外-可见吸收光谱中化合物a分子HOMO与LUMO之间能隙较小而易于发生跃迁相一致。 其余分子轨道图等见辅助材料。
采用Z-扫描技术方法[36]测定化合物a和b的三阶非线性光学性质。 实验用Nd:YAG(NT 342B)可调谐激光器作为光源,激光波长532 nm,脉冲宽度180 fs。 输出的激光光束在时间和空间上均近似为高斯分布,实验重复频率为10 Hz。首先对纯二甲基亚砜(DMSO)进行扫描实验,排除了来自溶剂在30 nJ能量下的开孔(k)/闭孔(b)Z-扫描的非线性光学效应,然后在相同的实验条件下进行两种样品的开孔(k)/闭孔(b)Z-扫描实验(化合物a和b两种样品的浓度分别为1.62和1.64 mmol/L),结果如图6所示(正方形数据点表示实验数据,实线是理论拟合结果)。
 | 图6 180 fs时化合物a和b的开孔/闭孔Z-扫描曲线Fig.6 Open/Closed-aperture Z-scan curves at 180 fs for compounds a and b k.Open-aperture; b.Closed-aperture |
由图6可知,化合物a和b的开孔曲线均显示出一个对称性良好的高峰,这说明样品具有良好的非线性吸收行为。 闭孔曲线显示,峰和谷高低基本一致,且均呈对称性良好的状态,说明化合物a和b具有非线性饱和吸收特性。 同时,先谷后锋的两条曲线显示出化合物a和b均表现出正的非线性折射特征[37,38],表明化合物a和b均具有自聚焦的NLO性质。
通过数值拟合获得样品a和b的非线性折射率 n2、非线性吸收系数 β和非线性分子超极化率 γ数值(表4)。 由表4可知,化合物a和b均表现出自聚焦( n2>0)和非线性饱和吸收( β<0)特性。 另外,数据显示化合物a的三阶非线性分子超极化率比化合物b的大,反映了化合物a的三阶非线性光学性能优于化合物b。 三阶非线性光学材料折射率大小取决于材料分子的极化程度。 理论计算和实验测定均表明,环外C=C双键与噻吩2-位相连时更有利于增大分子极化程度,从而增强分子内电荷转移效应,表现出超快三阶NLO响应。
| 表4 化合物a和b的三阶NLO参数 Table 4 Third-order NLO parameters of compounds a and b |
设计并合成了两个基于二茂铁的查尔酮衍生物a和b,二者系同分异构体,它们均属于较大的含有多芳香环共轭体系结构;非线性吸收与折射均源于分子的大 π电子共轭结构。 理论计算和非线性光学性质测定表明,二者能够发生分子内电荷转移,显示出超快非线性光学响应;化合物a的极化率和分子超极化率均比化合物b的大,反映出基团连接位置不同影响分子的非线性光学性质,但化合物b的固相热稳定性比化合物a的大。 综合各种性质表现,作为有机非线性光学材料,化合物a和b具有潜在的应用价值。
辅助材料(Supporting Information)[化合物(a)和(b)的核磁共振氢谱、碳谱、高分辨质谱、理论模拟紫外吸收光谱及其理论计算所得自然轨道(NBO)、最高占据分子轨道(HOMO)和最低空分子轨道(LUMO) 的电子云图]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
致谢:本工作中核磁共振谱和高分辨质谱由山西大学分析测试中心测定,非线性光学性质由苏州大学微纳非线性光学研发中心测定,作者在此一并致谢。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|