在生物医学领域,对纳米尺寸级别的微小生物目标进行精确定位研究具有非常重要的意义,而光学显微成像技术为此提供了强有力的工具。 光学显微成像技术受到光学衍射极限的限制,难以分辨尺寸在衍射极限(<200 nm)以下的生物结构,无法直接获取微小生物结构信息,阻碍了生物医学的进一步发展。 近年来,随着纳米分辨显微成像技术的出现,新型荧光探针的开发、成像系统与设备的不断发展及成像算法不断完善地深入结合,促进了光学衍射极限以下尺寸微观目标的研究。 基于单分子定位的超分辨荧光显微成像(SMLM)包括光激活定位成像(PALM)与随机光学重构超分辨成像(STORM),将有机荧光探针与超分辨光学显微成像技术紧密结合在一起,荧光探针的光物理性质直接决定着超分辨成像结果的好坏。 因此,设计不同性能的荧光探针可以实现超精细结构的不同超分辨成像,为研究其生物学功能提供了有力的工具。 本文着重围绕基于SMLM的原理、有机荧光探针的设计要求、用于SMLM的荧光探针种类及其生物应用等方面进行总结综述,指出了单分子定位成像上存在的不足,并对其发展方向进行了展望,希望为对超分辨成像研究感兴趣或初涉该领域的研究者提供成像理论与探针设计方面的帮助。
In the field of biology and biomedical science, it is of significance to image microscopic targets inside cells with high precision to afford accurate information for diagnosis. Since the emergence of optical microscope, it has been used as a powerful tool to provide precise results, achieving the visualization of tiny objects. However, due to the optical diffraction limit(~200 nm), it is difficult to distinguish the objects less than 200 nm in size, in particular, a lot of significant biological targets with size less than 200 nm in cells, which blocks further advancement of biology science. Recently, with the development of fluorescent probes, imaging system and reconstruction algorithm, superresolution imaging microscopy is emerging as an advanced technique capable of overcoming the limit of optical diffraction, which shows potentials in the study of tiny targets below optical diffraction limit. Among superresolution imaging nanoscopies, single molecule localization microscopies(SMLM), such as photo activation localization microscopy(PALM) and stochastically optical reconstruction microscopy(STORM), show typical advantages over other strategies. Smart fluorescent probes play key roles in PALM/STORM microscopy, of which the photophysical properties typically determine the imaging resolution. Therefore, it is of significance to develop fluorescent probes with excellent optical properties to achieve ultrafine structure imaging of interest inside single cell. In this work, we will mainly focus on recent progress on organic probes for single molecule localization microscopy, including working principles, selection criteria, designing strategies of fluorescent probe and their biological applications. Furthermore, we will also cover on the discussion of the shortcomings remaining to be solved in the future and figure out the possible advancement of SMLM to facilitate the researchers who are interested in or initially step into the area of super-resolution imaging microscopy with theoretical assistance.
近年来,光学显微成像技术尤其是激光共聚焦荧光显微成像技术因其成像速度快、检测灵敏度高、操作方便及成本低等优点在化学、材料科学、生物医学等领域发挥着越来越重要的作用。 荧光探针特异性标记后的细胞或组织内部精细结构,通过荧光显微成像可获得亚细胞水平上生物结构及细胞形态的变化,实现活细胞及细胞器等相关生理功能的研究,可为生命科学的发展提供便利的研究工具。 然而,传统光学显微成像技术已经不能满足生物医学的深入发展需求,因为传统光学显微成像受到Abbe光学衍射极限的限制,其横向空间分辨率只能到达200 nm左右,轴向分辨率不超过500 nm[1],限制了光学显微成像在生物医学领域的进一步应用。 为了获得细胞内尺寸小于光学衍射极限生物结构的超清晰成像,需要突破光学衍射极限的限制,超分辨显微成像技术应运而生,其成像分辨率可以达到传统荧光显微镜的数倍甚至10倍以上[2],为光学显微成像技术在生命科学中应用提供了新的契机。
超分辨成像技术是基于间接手段实现突破光学衍射极限的新型成像手段,根据其“绕过”光学衍射极限的不同手段,主要分为3种:1)通过空间光学调制缩小光斑的点扩散函数(Point Spread Functions,PSF)尺寸,如Stefan等[3,4]提出的受激辐射损耗超分辨成像(Stimulated Emission Depletion Microscopy,STED),其主要原理是利用套在激发光束周围的高强度环形激光使重叠区域内的荧光分子发生受激辐射损耗而抑制其自发辐射荧光,解决激光汇聚于样品时因物镜衍射而形成的艾里斑问题,这种技术需要荧光探针具有很好的光稳定性和非线性光学效应,能够保证探针分子在高强度的激光照射后快速进入非荧光发射态(暗态)且不会很快发生光漂白[5]。 基于类似机理的超分辨成像技术还包括基态损耗超分辨成像(Ground State Depletion,GSD)[6]和可逆饱和光学(荧光)传递超分辨成像技术(Reversible Saturable Optical(fluorescence) Transitions,RESOLFT)[7];2)基于光学频域扩展的显微成像技术,如(饱和)结构光照明显微成像((Saturated) Structural Illumination Microscopy,SSIM/SIM)[8];3)基于单分子定位成像(Single Molecule Localization Microscopy,SMLM),代表性技术包括Shroff等[9]报道的光活化定位显微成像技术(Photoactivated localization microscopy,PALM)和Zhuang课题组[10]开发的随机光学重构超分辨成像(Stochastically Optical Reconstruction Microscopy,STORM),其中单分子定位超分辨成像技术主要依赖荧光分子对生物样品标记后,在激光照射下产生随机的光致闪烁,结合相应的重构算法获得超分辨图,该成像技术具有成像分辨率高、探针可灵活设计等特点,除此之外还有一些非常用单分子定位成像技术,如基于点累积的纳米分辨成像(Points Accumulation for Imaging in Nanoscale Topography,PAINT)[11]。
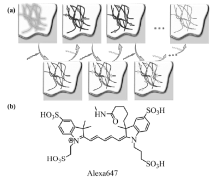
单分子定位显微成像技术(SMLM)包括PALM和STORM,其原理如图1a所示,利用不同波长激光调控高度精确定位的单个荧光分子或绿色荧光蛋白质随机发生荧光淬灭态(暗态)和荧光态之间的相互转变,在每1次循环中,视野中绝大部分的荧光探针分子被转换到暗态,只有稀疏少量的荧光分子发生随机活化的荧光发射,这些稀疏发光的荧光分子的图像彼此不会重叠,可以获取这部分荧光分子高度精确的定位,经过多次重复随机的点亮稀疏荧光分子的过程,可以实现大量荧光分子的精确定位,将采集的稀疏分子发光图像进行整合与重建得到高分辨率的显微成像。 早期研究中,代表性的有机荧光小分子花菁类荧光染料常用于此成像方法,具体过程是将三甲川菁类染料(trimethine cyanine dyes,Cy3)与五甲川菁染料(pentamethine cyanine dyes,Cy5)荧光染料分子同时共价连接至靶向目标,使二者距离足够接近组成能量传递体系,其中Cy5可以在其最大吸收峰对应波长的连续激光照射下进入暗态,Cy3作为可激活处在暗态的Cy5染料分子的启动器,促使其转入荧光态,当在Cy3的最大吸收波长处激发探针时,探针分子则可以回到辐射荧光的初始状态,利用这种方法可实现20 nm的成像分辨率。 2008年,Heilemann等[12]发现商品化的花菁荧光染料如Alexa 647等(结构如图1b所示),在不需要启动染料可以通过两束不同波长的激光照射实现暗态和荧光态之间的转换,操作过程简单直接,因此将该方法命名为dSTORM(direct STORM)。 Alexa 647类商品化荧光染料可用作dSTORM超分辨成像技术的代表性染料,首先使用647 nm波长的激光照射染料后,每个染料分子辐射数千个光子后进入暗态,进入暗态的速率常数正比于照射激光的强度,再在514 nm波长的第2束激光照射下可以使染料分子回到荧光态,但需要激活光的能量相对于Cy3-Cy5染料分子对要高200倍,dSTORM因其显著优势将荧光探针的选择范围扩展到各种商业染料,不需要结构复杂的合成染料,显著降低了该成像技术的应用门槛。在STORM技术中,荧光染料的选择是最终成像分辨率的决定性因素之一,常用于这类成像技术的荧光材料包括有机小分子荧光染料(五甲川菁类荧光染料,七甲川菁类荧光染料等)、绿色荧光蛋白质和半导体荧光量子点等光致发光材料,其中有机小分子荧光染料易于修饰靶向基团,是最常用的标记染料。
对于单分子定位超分辨成像,荧光探针的光物理性能起着决定性作用。 一般情况下,设计可用于单分子定位超分辨成像的荧光探针时,主要考察探针以下4个方面的性质[13]:1)荧光探针的光致转换性能,即在激光照射下能实现荧光探针的荧光态和暗态之间的转换;2)荧光探针在荧光态时具有足够高的亮度,其衡量标准是单次开关转换所能探测到的实际光子数;3)高对比度和低占空比(duty cycle),所谓占空比指的是染料分子停留在荧光态与暗态所占时间的比值,而获得超分辨的清晰图像要求足够暗的荧光背景以及高亮度随机闪烁的荧光信号在时间和空间的充分分离,避免信号重叠,因此高对比度和低占空比是理想的单分子定位成像荧光探针的重要性质之一;4)高光致闪烁循环次数及光稳定性。 其中,染料在荧光态和暗态的光致转换性质是实现STORM的基本要求。 2005年,两个课题组分别报道了碳花菁类荧光染料在巯基乙胺及无氧气缓冲体系中能发生光诱导的闪烁行为,且循环次数在100次左右,每1次循环能监测到数千个光子[14,15]。
对于五甲川菁染料(Cy5)类荧光染料光致随机闪烁的机理,Zhuang课题组[16]利用质谱表征中间体的结构证明了Cy5与巯基化合物在长波长光照条件下发生亲核加成反应,阻断染料多甲川链的共轭结构使染料进入荧光淬灭态(暗态),在短波长光照下发生逆向反应释放加成的巯基化合物,恢复多甲川链的共轭,并且指出该反应难易及速度与染料多甲川链的共轭长度相关,类似的反应不能发生在Cy3上。 根据类似的机理将巯基亲核试剂换成三(2-羧乙基)膦盐酸盐(TCEP),利用有机磷化合物的亲核性也可以实现类似的光致闪烁和超分辨成像(如图2a所示)[17]。 除菁染料外,罗丹明、噁嗪类染料也可以在类似的氧化还原条件下发生光致闪烁(图2b),罗丹明类荧光染料机理与菁染料有所不同,溶液在pH=7~8时,硫醇化合物单电子还原三线态激发态的染料分子形成稳定的阴离子自由基进入暗态,在氧气环境中,可以再次使染料分子回到单线态辐射荧光态[18,19],如图2c所示。 噁嗪类染料则是被还原至氢化隐色体形式进入暗态,在紫外光和氧气的条件下可以恢复至初始状态进而辐射荧光[20],如图2d所示。 类似地,通过将染料与强还原剂(硼氢化钠)共同作用,染料被还原氢化形式进入暗态的研究工作也有报道,染料的氢化状态可以在405 nm激光照射下被氧气氧化回复至初始状态,该方法适用于一系列如菁染料Cy3、Alexa Fluor 647、苯并吲哚五甲川菁染料(Cy5.5)以及罗丹明类染料ATTO 488等[21]。 当然,超分辨率成像技术不仅需要选取性能优异的荧光探针及合适的缓冲液体系,荧光探针的标记密度的高低也对超分辨成像结果起着决定性作用。
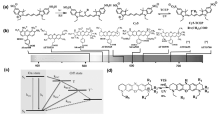 | 图2 不同荧光探针的分子结构及其光致闪烁机理[17,18,19,20]Fig.2 Chemical structures and mechanism of photochemical activation progress of different fluorescent probes (a)Mechanism of photochemical activation progress of Cy5 in buffer systems including mercapto-containing compounds or phosphine-containing compounds[17]; (b)Molecular structure and spectral frequency band of commercial rhodamine derivatives and (c)their mechanism of photoluminescence[18,19]; (d)Molecular structure and photoluminescence of oxazine dye[20] |
将荧光染料设计成具有靶向细胞中特定微结构(如微管蛋白、机动蛋白以及各种细胞器等)能力的荧光探针进行超分辨成像,对于研究亚细胞层面生物学功能具有重要意义,尤其是能同时实现两色或多色荧光标记并进行纳米分辨成像的荧光探针,对深入理解各种亚结构间的相互作用、协同作用、空间联系有着更深层次的生物学意义。 2007年,Zhuang课题组[22]研究了一系列荧光激活团(Activator)-荧光报告团(Reporter)模式的染料分子对,使用两种不同波长的羰花菁染料共价连接并标记到DNA或抗体上组成荧光共振能量传递(Fluorescence Resonance Energy Transfer,FRET)染料分子对,如将半菁染料与Alexa647 (Cy2-Alexa647)及三甲川菁染料与Alexa647(Cy3-Alexa647)荧光染料分子对通过免疫组化染色法分别标记到细胞微管蛋白和网格蛋白,通过区分不同的激发光,实现固定细胞中两种不同蛋白的超分辨成像,如图3所示。
 | 图3 哺乳动物细胞微管蛋白和网格蛋白的双色STORM超分辨成像[22]Fig.3 Two-color STORM imaging of microtubules and CCPs in a mammalian cell[22] |
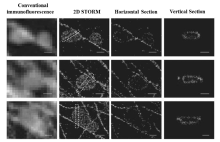
2008年,Zhuang课题组[23]将两种荧光团直接共价连接组成Alexa405-Cy5及Alexa488-Cy5染料分子对,先用两种染料标记二抗后,分别再标记线粒体外膜的转移酶(translocase of outer membrane,TOM20)以及 β-微管蛋白,利用3D-STORM技术观察到固定细胞中线粒体与微管蛋白间的非接触性相互作用,如图4所示,获得其横向空间分辨率为20~30 nm,轴向分辨率为60~70 nm。 然而,通过传统光学显微镜,常常观察到一些错误的信息,比如线粒体两端都与微管蛋白紧密连接等。
2012年,Zhuang课题组[25]将Cy2、Cy3、Alexa 405作为激活基团分别与作为信号基团的Alexa 647和Alexa750组合使用,通过区别启动波长和报告荧光团的辐射波长,实现了多达6种颜色的超分辨成像,尽管同时靶向多种物质比较困难,但是这种多参数模式为多色STORM提供了一种方法[24]。 除了用染料分子对实现多色超分辨成像外,dSTORM的多色成像更加简单,可以直接使用不同发射波长的商业染料实现不同定位的多色超分辨成像。 比如,使用ATTO系列染料(罗丹明和噁嗪母体结构)可以实现细胞骨架网状结构及线粒体内膜20 nm光学分辨率的双色超分辨成像。 Lehmann课题组[26]使用硼氢化钠将28种商业化的荧光染料(包括罗丹明类、噁嗪类、菁类系列荧光染料)还原为隐色体形式,在氧化还原型缓冲体系(Trolox-甲基紫精)中通过两种颜色观察到突触小泡裹泡膜谷氨酸转运体(vesicular glutamate transporter,VGlut)直径为41 nm的环形结构以及裹泡膜网格蛋白直径为56 nm的环形结构,与透射电子显微镜(transmission electron microscope,TEM)观察到的结果基本一致,如图5所示。
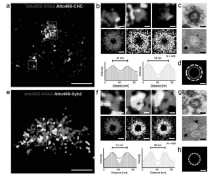 | 图5 小鼠脑的神经细胞中突触前终端的dSTORM图像[26]Fig.5 Caged SD-dSTORM imaging of presynaptic terminals in 150 nm cryosections of mouse brain[26] |
基于STORM超分辨成像方法需要数千帧图像数据进行重构一幅高分辨率的图像,在获得超高空间分辨率的同时牺牲了时间分辨率,基于此考虑,STORM超分辨成像方法很难满足实时活细胞成像的要求,活细胞中微结构的运动容易引起成像的模糊,并且由于大多数有机小分子染料的闪烁离不开较高浓度(10~200 mmol/L)含巯基化合物的缓冲体系,对于活细胞环境并不友好,很多探针如Alexa 647或者酶体系不具有细胞膜穿透性,无法用于活细胞成像,因此,实现活细胞的STORM成像比较有挑战性。
2009年,Heilemann等[18]使用ATTO655作为荧光标记探针,利用细胞内的谷胱甘肽作为还原性巯基化合物使探针进入暗态,对活的人肺癌细胞(A549)中的RNA进行了长达500 s的超分辨成像研究,并发现其无明显位移。 之后,该课题组利用蛋白标签技术(TMP标签)将ATTO655标记到活的宫颈癌细胞(HeLa)的细胞核组蛋白H2B上(图6a所示),并对间期细胞核进行了120 s的超分辨成像,发现间期细胞核3 nm/s 的移动速率[27]。
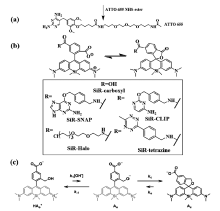
Benke等[28]使用商品化的DNA标记染料picogreen作为探针,使用1 mmol/L的抗坏血酸以及酶氧气清除体系作为缓冲体系,实现了染料的闪烁,并对DNA做了dSTORM成像,同时得到了拟核分辨率为70 nm的超分辨图像。 2012年,Zhuang课题组[29]报道了商品化的细胞膜、线粒体、溶酶体、内质网等膜染料在不需要加巯基的缓冲体系(仍需要酶的氧气清除体系)就可以用较强的激发光使染料进入暗态(可能借助于内源性谷胱甘肽),用405 nm波长的激光照射可以使其恢复荧光发射,产生光致闪烁,并利用这些染料(包括罗丹明、BODIPY、菁染料等)观察到了线粒体分裂和融合的中间态、线粒体管化、内质网微管的延长等细微的现象,空间分辨率达到30~60 nm,时间分辨率为1~2 s。 2013年,Gražvydas等[30]报道了如图6b所示的硅杂结构的罗丹明类分子,与传统的氧杂罗丹明荧光染料相比,硅杂罗丹明荧光染料分子更容易利用羧酸基团在低极性环境中主要以闭环隐色体形式存在,当利用另一个羧酸基团连接了各种蛋白质标签后(SNAP、CLIP、HALO等),发现硅杂罗丹明连接SNAP标签(silicon rhodamine-SNAP,SiR-SNAP)染料分子在水溶液环境中因为聚集以闭环隐色体形式存在,在与标记有荧光标签的蛋白质结合后,染料可以恢复至两性离子的形式发射荧光,这样无定向标记的染料分子则不会产生干扰,降低了背景噪声的影响。 染料分子在功率密度为1 kW/cm2的激发光(640 nm)照射下可以实现大部分染料分子进入荧光暗态,少量的探针分子发生光致闪烁,对活细胞核周围的组氨酸进行了3 min的超分辨成像。
2014年,Urano课题组[31]报道了如图6c所示的近红外荧光发射的硅杂罗丹明染料分子结构,将分子内的亲核基团由羧基变为醇羟基,使染料分子在生理pH的水环境中绝大多数以闭环形式存在,不需要外加巯基化合物或硼氢化钠等实现分子的暗态,而且由于分子的开关环是自发的热力学动态平衡,实现了染料分子的闪烁,其开环状态的寿命约为0.2 s,适合于活细胞的超分辨成像。 这种分子内化学键的可逆形成与断裂,使染料分子在实现闪烁时不依赖外部环境,所用的激发光只需极低功率(40 W/cm2),且染料大多数处于暗态,极大地提高了染料的抗光漂白能力,该课题组通过HaLo标签将染料标记到微管蛋白,实现了活细胞内微管蛋白10 min的超分辨成像。
相对于绿色荧光蛋白质,有机小分子荧光团具有更高的荧光量子效率,易于通过化学修饰实现靶向定位标记和发射波长的调控等,因此在光活化定位成像中有着广泛的应用。Moerner等[32]报道了叠氮-二氰基二氢呋喃荧光团(azido dicyanomethylenedihydrofuran,Azide-DCDHF)在低能量的蓝光照射下,叠氮转变为氨基,发生分子内电荷转移由暗态转变为荧光态(如图7所示),探针由HaLo标签标记到BS-C-1细胞 α-微管蛋白,以及细菌的骨架蛋白质上,对活细胞微管及细菌的不对称分裂进行了超分辨成像。
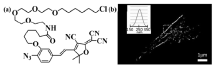 | 图7 (a)HaLo tag-DCDHF分子结构和(b)BS-C-1细胞的骨架蛋白质超分辨图像[32]Fig.7 (a)Molecular structure of HaLo tag-DCDHF; (b)Super resolution imaging in BS-C-1 cells[32] |
2007年,Hell课题组[33]报道了罗丹明内酰胺结构的染料分子在紫外光或双光子(747 nm)照射下从处于暗态的隐色体形式转变为开环状态的荧光辐射形式(如图8a所示)。 通过将5-NHSS标记到哺乳动物PtK2细胞微管蛋白丝状结构,观察到每根微丝50~70 nm的尺寸,以及微丝的直径为25 nm(包括所用的抗体),与文献[34]报道基本一致。 在此工作基础上,Lee等[35]报道了一系列罗丹明酰胺结构,使用不同吸电子基团稳定罗丹明开环的酰胺阴离子,如图8b所示,通过延长酰胺部分的共轭结构使所用的活化光可以达到可见区(405 nm)。 利用探针9的细胞膜靶向性,实现了新月柄杆菌细胞的茎秆结构的3D超分辨成像,得到了28 nm的分辨率。
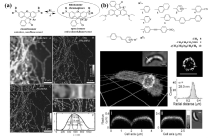 | 图8 不同罗丹明内酰胺分子结构、可逆开关反应机理及其超分辨成像应用[33,35]Fig.8 (a)Photochromic reaction of rhodamine derivatives with light-induced activation( hv) of fluorescence(open isomer) and thermal relaxation( Δ) to the deactivated state(closed isomer) and super-resolution imaging of tubulin network in a PtK2 cell[33]; (b)Chemical structure of different rhodamine spirolactam derivatives and 3D super-resolution imaging of crescents cells[35] |
Halabi等[36]报道了半罗丹明半荧光素类染料利用螺碳碳键(重氮甲烷)光照断裂实现光活化的策略,如图9所示,该类探针由于酚羟基被酯化,在细胞酯酶水解后,乙酰基脱除后才具备发射荧光的能力,同时螺碳键在光照断裂后罗丹明才能从隐色体形式转变为显色形式辐射荧光,而这一步反应取决于氧杂蒽环的电子密度,未发生酯水解的分子即使受到光活化依然无法转变为显色形式,利用这种双重活化机制实现了活细胞内酯水解酶活性的高分辨率监测以及团簇化的酶活性的定量监测。
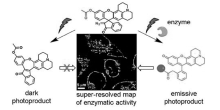 | 图9 半罗丹明半荧光素类探针监测酯水解酶活性及光活化机理[36]Fig.9 A dual-activatable, fluorogenic probes to sense esterase activity and mechanism of photochemical activation progress[36] |
邻位硝基苄基基团是最常用的光活化基团,大量荧光团可利用该基团实现荧光的淬灭,设计成笼状分子探针,经过活化光处理后,硝基基团光还原断裂恢复荧光团的荧光发射性能。 Banala等[37]利用此机理设计了笼状的罗丹明结构,利用SNAP标签可以靶向到感兴趣的特定蛋白质分子上,在固定的U2OS细胞中实现了线粒体的超分辨成像,其成像分辨率比红色荧光蛋白提高2~3倍,结果如图10a所示。 此外,Grimm等[38]报道了碳罗丹明110结构(如图10b所示),实现了对肌动蛋白微丝8 nm的定位精度,在与Alexa 647-phalloidin对比实验中发现,商品化的Alexa系列探针在缓冲体系中只有0.1%处于荧光态,由于辐射的光子数较少只得到了17 nm的定位精度,证明了该探针的优越性。
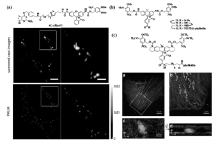 | 图10 硝基苄基掩蔽的罗丹明探针结构及其在U2OS细胞中对线粒体的超分辨成像(a)[37]; 硝基苄基掩蔽的碳罗丹明110结构(b)[38]及硝基苄基掩蔽的硅杂罗丹明结构及肌动蛋白微丝和线粒体双色PALM成像(c)[39]Fig.10 (a)Chemical structures of rhodamine BG-cRhod and imaging of fixed U2OS cells expressing SNAP-Mito(mitochondria)[37]; (b)Synthesis of caged carborhodamine 110 phalloidin conjugate[38]; (c)Chemical structure of phalloidin conjugate and two color iPALM image of a fixed U2OS cell labeled with phalloidin conjugate 17(actin, red) and mEos2 (mitochondria, green)[39] |
在此基础上,Grimm等又报道了长发射波长的硅杂罗丹明的基于PALM荧光探针(如图10c所示),由于存在一定背景荧光的干扰,该探针获得了6.2 nm的定位精度,稍低于Alexa647-phalloidin的定位精度(5.7 nm),通过与荧光蛋白mEos2联用,获得了肌动蛋白微丝和线粒体的双色超分辨图像[39]。
除了常用的荧光染料外,传统的光致变色荧光材料如螺吡喃和二噻吩乙烯等染料也常常被修饰成适用于PALM的荧光探针。 Nevskyi等[40]报道了二噻吩乙烯类光致变色荧光探针,并将其制备成聚合物纳米结构,进行了超分辨成像(图11a所示)。 Zhang等[41]报道了螺吡喃类染料与秋水仙碱共价连接的探针(图11b),探针在紫外光照射后螺吡喃开环变为平面部花菁形式,辐射红色荧光,561 nm光照射后则变为隐色体形式,此探针对微管蛋白的超分辨成像获得了20 nm左右的分辨率。
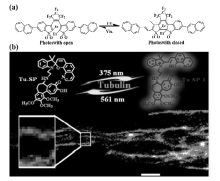 | 图11 二噻吩乙烯类光致变色类荧光分子(a)[40]以及螺吡喃-秋水仙碱连接的光致变色类PALM探针(b)[41]Fig.11 (a)Chemical structures of the open and the closed forms of the photoswitch[40]; (b)Chemical structures of spiropyran derivative binding to alkaloid colchicine and super-resolution imaging of tubulins in microtubules[41] |
此外,朱明强课题组[42]报道了硼二吡咯甲基衍生物(BODIPY)与六芳基联咪唑组成的能量转移分子对,利用联咪唑光致变色行为可逆地控制BODIPY荧光的出现和消失,将其制备成自组装聚合物纳米微球可以直接对其进行超分辨成像,如图12所示。
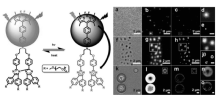 | 图12 BODIPY-联咪唑能量转移分子对及其在自组装聚合物纳米球中的超分辨成像[42]Fig.12 Schematic diagram of fluorescence switching of mTEGHABI-BODIPY and super-resolution imaging of mTEG-HABI-BODIPY self-assemblies with various sizes[42] |
最近,大连理工大学的肖义课题组[43]报道了一种新的罗丹明分子笼的方法,通过将罗丹明供体氨基亚硝化使罗丹明形成隐色体,在光照下释放NO,同时罗丹明辐射荧光(图13)。 探针靶向线粒体,在超分辨成像中获得了19 nm的空间分辨率。
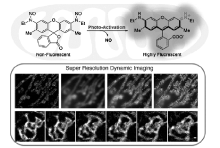 | 图13 NO掩蔽的罗丹明及其对线粒体的超分辨成像[43]Fig.13 Chemical structure of high-payload NO donor(NOD550) and its photo triggered activation and super-resolution dynamic imaging of mitochondria[43] |
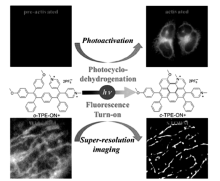
唐本忠院士团队[44]报道了四苯基乙烯荧光探针在紫外光照射下发生的芳香化反应导致其探针溶液从无荧光发射转变成强荧光发射状态,如图14所示,该探针在细胞内对线粒体具有很好的靶向定位性。 并且发现光照成环后的探针在561 nm波长激光照射下可以发生显著光致闪烁,证明此类探针最终可以用于STORM超分辨研究细胞线粒体的超精细结构。
单分子定位显微成像技术(SMLM)可突破光学衍射极限的限制,实现超分辨显微成像,获得超高精度的显微图像提供了非常重要的研究工具与实验平台,在化学、材料科学及生物医学等领域具有广泛的应用前景,逐渐引起不同领域研究者的广泛兴趣。 对于单分子定位的超分辨成像技术,满足特殊光物理性能的荧光探针对超分辨成像结果的优劣起着决定性意义,因而,开发新型荧光探针可以促进超分辨显微成像在生命科学领域的广泛应用。 本论文总结了目前用于单分子定位超分辨成像包括STORM和PALM的有机小分子荧光探针的设计、工作原理及其在生物显微成像领域中的应用情况。 发展新型的不依赖复杂缓冲体系(高浓度巯基化合物,酶的氧气清除体系)的光致闪烁荧光探针对于活细胞成像有着重要意义,也是今后设计新型超分辨荧光探针的基本要求与发展方向。 与此同时,要保证荧光探针的占空比足够低、优良的光稳定性、高的定位精度、低背景荧光的干扰、高对比度、循环次数多和每一个分子能够辐射足够多的光子数等特点,这些均有利于实现活细胞的超分辨定位成像。 用于光活化的荧光探针则要求激活光向着长波长移动,减少所需激活光能量以及激活后的染料易于漂白等特点。 此外,设计新的掩蔽基团、光活化机理,对于探针在活细胞成像尤其是长时间动态监测、进一步提高分辨率等均有着重要意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|