通过电化学聚合法制备了碳纤维布载三维网状聚苯胺电极,采用扫描电子显微镜、傅里叶红外光谱仪和X射线光电子能谱仪观察了电极形貌,并分析了电极表面特征基团。 接着,对比研究了该电极在4种RCl(R=H,Li,Na,K)水溶液中的电容性能。 电化学测试表明,在KCl中的电势窗口(1.8 V)大于在HCl和LiCl中的电势窗口,且在KCl中的比电容(501 F/g@0.5 A/g)远远大于NaCl中的比电容;即使在10 A/g的充放电电流下,电极在KCl溶液中的能量密度仍高于HCl溶液中2.0 A/g下的能量密度,因此KCl为聚苯胺基电容器最佳的电解质类型。 本文通过简单地改变水系溶液中电解质的种类,即可达到拓宽电势窗口、显著提升电化学电容器能量密度的目的,避免了使用有机溶液带来的物理化学稳定性差、污染环境的问题。
Carbon fiber cloth supported three-dimensional polyaniline networks were synthesized by electrochemical polymerization. Scanning electron microscopy, Fourier transform infrared spectroscopy and X-ray photoelectron spectrometer were applied to characterize the morphology of the electrode and analyze the characteristic groups on the electrode surface. The capacitive performance of the as-prepared electrode in four RCl(R=H,Li,Na,K) aqueous solutions was systematically compared. The electrochemical tests show that KCl electrolyte gives a wider potential window(1.8 V) than the HCl or LiCl electrolyte, and also exhibits a superior specific capacitance(501 F/g@0.5 A/g) to the NaCl electrolyte. The energy density under the current density of 10 A/g in the KCl electrolyte is even larger than that in the HCl electrolyte under 2.0 A/g. As a result, KCl is the most suitable electrolyte for the polyaniline-based capacitor. The potential window is widened and the energy density of electrochemical capacitor is remarkably improved just simply by altering the electrolyte in the aqueous solution, which avoids the issues of poor physico-chemical stability and severe environment contamination originated from the organic solutions.
随着化石能源的日益枯竭和环保要求的逐渐提高,人们亟待开发出一种性能优异、环境友好的电化学储能装置。 目前,常用的电化学储能装置有两种:电化学电容器和锂离子电池。 电化学电容器具有快充快放的优点,在功率型用电设备中应用十分广泛。 但其能量密度明显低于锂离子电池,限制了其在储能型用电设备中的使用。 由电化学电容器的能量密度计算式可知,提高能量密度的方法有两种:1)提高比容量值;2)拓宽电势窗口。 对于前者而言,可通过将材料微纳米化、优化电极结构来提高比容量值,但微纳米化制备方法的成本较高,且仍无法突破材料的理论比容量。 对于后者而言,可采用有机电解液替代水系电解液来扩宽电势窗口,但有机电解液存在物理化学稳定性差、污染环境的问题。
聚苯胺是一种导电聚合物,常用于导电纤维、防腐蚀涂层和生化传感器等领域中[1,2,3]。 聚苯胺能够以掺杂/电氧化、脱掺杂/电还原的方式进行可逆充放电,因而也可作为电容器的电极材料。 以无机质子酸(如HCl、H2SO4、HF)作为掺杂剂的聚苯胺通常具有较高的导电性,因此,聚苯胺基电容器常采用无机质子酸水溶液作为电解液。 研究表明,除无机质子酸外,某些路易斯酸(SnCl4、BF3)、碱金属盐(Li盐、Na盐、K盐)和过渡金属盐(FeCl3、NiCl2、CuCl2和ZnCl2)等也可对聚苯胺进行掺杂,使绝缘的本征态聚苯胺转变为导电的掺杂态聚苯胺[4]。 这意味着,碱金属盐也可作为聚苯胺基电容器的电解质。 Ryu等[5]研究了LiPF6掺杂的聚苯胺(简记为LiPF6-PANI)在LiPF6/EC+DMC电解液中的电容行为(LiPF6为电解质,碳酸乙烯酯EC和碳酸二甲酯DMC为溶剂)。 测试结果表明,LiPF6-PANI电极充放电过程可逆,且循环稳定性良好。 张爱琴等[6]以1.0 mol/L KCl水溶液作为电解液、活性炭和聚苯胺分别作为电极材料,组装得到了活性炭-聚苯胺混合电容器。 在6.0 mA/cm2的充放电电流下,该混合电容器比电容达到了159.6 F/g。 这些研究结果均证明了碱金属盐类可取代无机质子酸,成为聚苯胺基电容器的电解质。
与无机质子酸溶液相比,中性的碱金属盐溶液与环境相容性好、更安全、对电容器外壳无过高的耐蚀要求,且聚苯胺在碱金属盐溶液中电容性能研究一直相对匮乏。 基于以上考虑,本文在采用水系电解液的前提下,着重对比了碳纤维布载聚苯胺电极在4种RCl(R=H,Li,Na,K)水溶液中的电容性能,以期获得最适宜的电解质类型,从而有效拓宽电势窗口,提升电化学电容器的能量密度。
苯胺购自国药集团化学试剂有限公司;硫酸(H2SO4)和盐酸(HCl)购自北京化工厂;丙酮购自天津市富宇精细化工有限公司;无水氯化锂(LiCl)购自天津市标准科技有限公司;NaCl和KCl购自天津市凯通化学试剂有限公司;以上均为分析纯试剂;碳纤维布(HCP330型),购自上海河森电气有限公司。 溶液均采用超纯水配制。
CHI 660E型电化学工作站(上海辰华仪器有限公司);CT2001A型蓝电电池测试系统(武汉市蓝电电子股份有限公司);XL30 TMP型扫描电子显微镜(SEM,加速电压15 kV,荷兰PHILIPS公司);Escalab 250xi型X射线光电子能谱仪(XPS,美国Thermo Fisher Scientific公司,Al靶X射线源);聚苯胺基团表征采用VERTEX 70型傅里叶变换红外光谱仪(FTIR,美国Bruker公司),FTIR测试采用KBr压片法。
1.2.1 碳纤维布载聚苯胺电极的制备
首先,将裁剪好的碳纤维布(Carbon Fiber Cloth,简记为CFC)置于丙酮中除油。 为适度解开缠绕的碳纤维,除油期间将其超声约1 min,浸泡和除油时间总计约30 min。 然后,将清洗干净的CFC夹于钛框中,使CFC与溶液接触的面积固定为1.0×1.0 cm2。 采用循环伏安电聚合方法制备碳纤维布载聚苯胺电极(简记为PANI@CFC)。 聚合溶液为1.0 mol/L H2SO4+0.1 mol/L苯胺。 聚合时采用三电极体系,工作电极、辅助电极和参比电极分别为CFC、石墨棒和Ag/AgCl参比电极。 聚合电压范围为-0.2~1.2 V,扫速为40 mV/s,聚合圈数为10。 最后,为去除电极表面残留的苯胺单体及低聚物,使用大量蒸馏水将制备得到的PANI@CFC电极洗净,放置备用。
1.2.2 电化学测试
采用循环伏安法(CV)、恒流充放电法(CP)和电化学阻抗法(EIS)研究PANI@CFC电极在不同电解质水溶液中的电容性能。 测试溶液为1.0 mol/L RCl(R=H,Li,Na,K)水溶液。 其中,CV和EIS在电化学工作站上进行测试,CP测试在蓝电电池测试系统上进行。 EIS测试时,频率范围为10 mHz~100 kHz,电势振幅为5 mV。 单电极测试时,PANI@CFC、Pt片(1.0×2.0 cm2)和Ag/AgCl参比电极(0.1981 V vs.SHE)分别作为工作电极、辅助电极和参比电极。
图1A和1B为CFC基体的SEM照片。 多根碳纤维拧成一束,以“十字”状交织在一起,总体呈现出疏松的结构。 碳纤维表面较为光滑,直径约为10 μm。图1C和1D为PANI@CFC电极在不同放大倍数下的SEM照片。 沉积于CFC表面的聚苯胺由互相桥接的网状纤维构成,这是由聚苯胺独特的生长方式所引起的[7]:生长初期,聚苯胺在导电基体表面形核(即形成“种子”);生长中期,聚苯胺在核上以“一维堆积”的方式形成线状纤维;生长后期,线状纤维表面生出“枝杈”与相邻纤维桥接,形成网状纤维。 由放大的SEM照片可以看出,聚苯胺纤维直径为50200 nm。 网状沉积物中存在大量孔道,这有利于电解液在电极表面的传质过程,缓解了浓差极化现象。
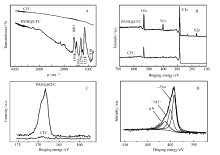
图2A为CFC和PANI@CFC电极的FTIR图。 CFC无明显吸收峰,而PANI@CFC在1700800 cm-1波数段内存在多个强吸收峰。 其中,1601和1538 cm-1吸收峰分别代表了醌环和苯环的伸缩振动[8]。 苯环吸收峰远远强于醌环吸收峰,说明聚苯胺长链主要由苯环构成,氧化度较低[9]。 1393 cm-1对应于QBQ结构中的C—N伸缩振动(Q指醌环,B指苯环)[9]。 1279和1218 cm-1吸收峰分别由聚苯胺骨架C—N伸缩振动、掺杂态聚苯胺中C—N伸缩振动引起[10]。 916 cm-1处为C—H面外弯曲振动吸收峰。 这些特征吸收峰表明聚苯胺已成功聚合于CFC基体上。图2B~2D为CFC和PANI@CFC的XPS谱图。 由宽扫描XPS谱图可以看出,两样品中均含有C、N、O元素。 碳纤维通常由含C、N、O元素的有机物高温碳化而成,因此CFC样品可检测到这3种元素。 除C、N、O元素外,PANI@CFC样品中还能检测出S元素,证明H2SO4已掺杂进聚苯胺骨架中(图2C)。 对PANI@CFC样品的N1 s峰进行分峰处理,可得到N⊕、—NH—和=N—3种含氮官能团的相对含量分别为20%、33%、47%(图2D)。 根据N⊕含量可知,所合成的聚苯胺掺杂度为0.2[11,12]。
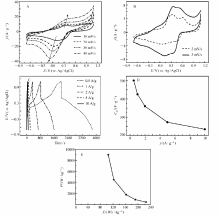
图3A和3B为PANI@CFC电极在1.0 mol/L HCl、LiCl、NaCl和KCl水溶液中的CV曲线。 在HCl溶液中,PANI@CFC共有4对氧化还原峰,对应于聚苯胺的电氧化/掺杂、电还原/去掺杂及单极子/双极子相互转化过程[13]。 当溶液更换为碱金属盐时,氧化还原峰为2对,氧化还原峰成对出现可说明,PANI@CFC电极在碱金属盐溶液中仍以法拉第反应的方式进行充放电。 Epsteinabc等[14]发现LiCl掺杂聚苯胺的过程与无机质子酸掺杂相似,这暗示了聚苯胺在碱金属盐中的充放电机理与无机质子酸中相同。 由图3A可看出,在碱金属盐溶液中,低电势区的还原峰未发展完全,说明电还原反应还未彻底完成,因此,将CV曲线继续负扫至峰形完整。 如图3B所示,碱金属盐溶液的电势窗口高达1.8 V(-0.7~1.1 V vs.Ag/AgCl),远远大于HCl溶液的电势窗口(1.2 V,-0.1~1.1 V vs.Ag/AgCl)。 采用单程线性扫描法(LSV)也可较直观地比较4种电解液的电势窗口大小(见辅助材料图S1),在LSV曲线高电势和低电势区域,电流密度显著上升的阶段代表水分解反应(析氢和析氧)。 可看到NaCl和KCl的电势窗口接近,LiCl的电势窗口较小,HCl的电势窗口最小。 HCl和碱金属盐的电势窗口之所以存在巨大差异,可能原因是:质子酸水溶液pH值较低,因而更易析氢( E= EΘ-0.0591×pH),从而导致下限电势值较高。
本研究中HCl溶液所展现出的电势窗口值与文献[11,12,15]报道的0.9~1.2 V接近,然而却鲜有与拓宽碱金属盐电势窗口相关的研究报道。 Zhang等[16]对比了不同含量比的聚苯胺/聚吡咯复合材料在HCl和KCl溶液中的电容行为,但两种溶液均选用了固定的1.0 V(-0.2~0.8 V vs.SCE)的电势窗口。 Branzoi等[17]制备了嵌入到AAO(阳极氧化铝)模板中的聚苯胺纳米线,并研究了其在HCl/KCl混合溶液中的循环伏安行为,但不同CV圈数的电势窗口均定为0.8 V(-0.4~0.4 V vs.SCE)。
采用恒电流充放电方法,测试得到了PANI@CFC电极在4种溶液中的计时电势(CP)曲线。 如图4所示,NaCl的充放电时间最短,比电容最低,仅有57 F/g。 一方面,LiCl、NaCl和KCl的离子键能依次逐渐减小,即NaCl在水溶液中电离程度较KCl的电离程度低,而聚苯胺的充放电过程与碱金属离子和氯离子各自在聚苯胺骨架上的掺杂、脱掺杂行为有关,电离出的碱金属离子和氯离子数量越多,越有利于聚苯胺的充放电过程。 另一方面,虽然LiCl的电离程度较NaCl的低,但Li+体积较Na+的小,因而越有利于进入到聚苯分子骨架上进行掺杂、脱掺杂。 综合两方面的因素可知,NaCl的电离程度较低且Na+的体积较大,导致了其掺杂、脱掺杂过程明显慢于LiCl和KCl,因此比电容值较低。 HCl比电容值为503 F/g,与文献[18,19,20,21]报道值接近。 LiCl的充放电时间略大于KCl,前者比电容为407 F/g,后者比电容达360 F/g。 Zhang等[16]采用化学氧化聚合法制备了聚苯胺粉体,并将该粉体热压于石墨基体上,得到了可用于电化学测试的工作电极。 实验测得该电极在KCl水溶液中的比电容值为244 F/g,远远低于本文通过电化学聚合法制备的直接负载型PANI@CFC的比电容值,这说明电极材料的结构对电容值的影响较大。 对比CP曲线放电瞬间的欧姆压降可知,HCl的欧姆压降最低,碱金属盐的欧姆压降较高,这可能是由于碱金属盐掺杂的聚苯胺的导电性相对较差的缘故。
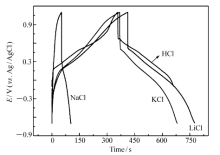 | 图4 PANI@CFC电极在1.0 mol/L HCl、LiCl、NaCl和KCl中的CP曲线Fig.4 CP curves of PANI@CFC in 1.0 mol/L HCl, LiCl, NaCl and KCl charging/discharging current density:2 A/g |
EIS是一种准稳态、变频率域的电化学测量方法,可得到电极-溶液界面更多的动力学信息,因此,采用EIS研究PANI@CFC电极在两端点电势下(1.1和-0.7 V)的电化学行为。图5A和5B给出了极化电势分别为1.1和-0.7 V时的Nyquist曲线。 Nyquist曲线与- Z″=0的交点即为体系欧姆电阻 RΩ。 由插图可看出,在两种极化电势下,LiCl、NaCl和KCl电解液的 RΩ顺序均为LiCl<NaCl<KCl。
通过Nyquist曲线形状,还可以判断某一极化电势下的电化学反应是否相对稳定。图5A和5B的插图表明,在两端点电势下LiCl的Nyquist半圆弧均由杂乱无章的散点组成,远不及NaCl和KCl的平滑,这说明在LiCl溶液中,电极反应受到了强烈干扰。 在进行EIS测试时,同步观察到在LiCl溶液中,PANI@CFC电极表面析出了大量气泡(见辅助材料图S2),证明存在析氢和析氧反应。 水分解产生的氢气、氧气气泡在电极表面不断生成、脱除,搅动了溶液,因而使得Nyquist数据点呈现不规则分布。 经pH计测定,1.0 mol/L的LiCl、NaCl、KCl的pH值分别为5.4、5.5、8.7,这表明LiCl水溶液的酸性最强。 由公式 E= EΘ-0.0591×pH可知,析氢反应的理论电动势随pH减小而增大,因而LiCl溶液会在更高的电势下析氢;之所以出现析氧反应(4OH--e- ↔ 2H2O+O2)可能是因为掺杂了LiCl的聚苯胺更容易吸附溶液中OH-的缘故。 若在LiCl溶液中长期充放电至此端点电势,产生的气体将逐渐累积于电容器壳内,使设备内部压力升高,带来较大的安全隐患。 因此,LiCl溶液的电势窗口并不能拓宽至1.8 V。
综上所述,KCl的电势窗口最宽且比容量相对较大,优于HCl、LiCl和NaCl,因此KCl为聚苯胺基电容器最优的电解质类型。 根据式(1)可知,能量密度 E(Wh/kg)随电势窗口Δ V(V)的增加而呈二次方增加,与提高比电容 CM(F/g)相比,提高电容器的电势窗口更能有效地提高能量密度,这正体现了碱金属盐溶液的优越性。
图3A和3B为PANI@CFC电极在1.0 mol/L KCl中不同扫速下的CV曲线。 当扫速从10 mV/s增大到50 mV/s,氧化还原峰电流密度也随之增大,且氧化峰和还原峰的分离程度愈大,这说明了PANI@CFC电极在KCl溶液中的电化学反应属于准可逆反应。 降低扫速至2和5 mV/s时,CV曲线的氧化还原峰数目增加。 当扫速为2 mV/s时,出现明显的4对氧化还原峰,与HCl溶液中的数目相同,这也说明了PANI@CFC电极在KCl溶液中的电化学反应过程与HCl溶液中的相同,即在醌基氮 (—N⊕(RCl) =(C6H4) = N⊕(RCl) —,R指H或K原子)上发生电氧化/掺杂、电还原/去掺杂反应[13](反应式(2)和(3))。
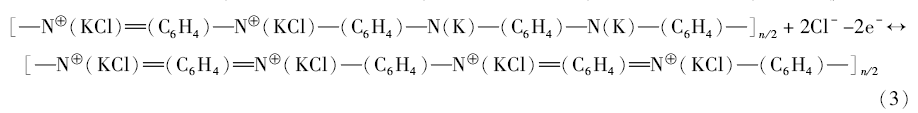
图6C是PANI@CFC电极在不同充放电电流密度下的CP曲线。 0.5 A/g下的CP曲线存在2对平台,与10 mV/s下CV曲线的2对氧化还原峰势对应一致。图6D给出了不同电流密度下的比电容值。 当电流密度为0.5 A/g时,PANI@CFC的比电容可达501 F/g。 当增大到10 A/g时,电极仍维持233 F/g的比电容。 当电流密度分别为1、2和5 A/g时,对应的比电容分别为425、360和272 F/g。 观察可知,随充放电电流密度增大,PANI@CFC的比电容不断减小,这是因为当电流密度增大时,电化学反应速率加快,反应物质来不及扩散到电极内部或材料体相内部,从而降低了活性物质的利用率。 辅助材料图S3给出了PANI@CFC在电流密度为2.0 A/g下的充放电循环性能。 在整个循环过程中,库伦效率均保持在99%以上,放电比电容在前63个循环中逐渐增大,接着逐渐降低,最终稳定在249 F/g。 实验结果表明,该电极在1.0 mol/L KCl溶液中的循环稳定性能较好。
PANI@CFC(E)功率密度与能量密度是衡量电极材料电容性能好坏的两个重要指标。 根据CP曲线可得到电极材料的功率密度与能量密度。PANI@CFC电极的能量密度通过式(1)计算,功率密度可采用下式计算:
式中, E代表能量密度(Wh/kg); P代表功率密度(W/kg); t代表放电时间(s)。
图6E给出了PANI@CFC电极在不同能量密度下的功率密度(即Ragone图)。 随着放电电流密度增大,功率密度提高,而能量密度下降。 0.5 A/g时,功率密度为450 W/kg,能量密度达225 Wh/kg。 当电流密度增大到10 A/g后,功率密度提升至8991 W/kg,能量密度仍维持在105 Wh/kg,该能量密度值比HCl溶液中2 A/g下的能量密度还高(101 Wh/kg)。 本实验得到的Ragone图,其优势在于能量密度值处于一个较高的水平。 Yang等[22]在Na2SO4水溶液中测试了聚苯胺/二氧化锰复合材料的电容性能,其在1.0 A/g下的能量密度仅有33 Wh/kg。 Liu等[23]制备了石墨烯包覆的聚苯胺空心球,其在0.510 A/g下的能量密度为5885 Wh/kg。 Lee等[24]制备了磺化的聚苯胺材料,其在0.510 A/g下的能量密度为5898 Wh/kg。 以上报道均是从设计电极材料的结构和组成入手,来优化电容性能;而本实验是从调控电解质种类的角度入手,结果表明扩宽电势窗口更能显著提高能量密度。
在4种RCl(R=H,Li,Na,K)电解质中,HCl和LiCl的电势窗口较窄,NaCl比电容值极低,均无法为提升电容器能量密度作出贡献,因此最适宜于作为聚苯胺基电容器的电解质为KCl。 电化学测试表明,KCl溶液的电势窗口为1.8 V,充放电电流为0.5 A/g时,比电容值可达501 F/g,功率密度为450 W/kg,能量密度达225 Wh/kg。 即使在10 A/g下,KCl溶液中的能量密度值仍高于HCl溶液中2 A/g下的能量密度值。 本文提出了一种只需简单地改变电解质类型,即可有效地提高电容器的能量密度的方法,扩大了聚苯胺基电容器的应用范围,为提升电容器的能量密度提供了一个新思路。
辅助材料(Supporting Information)[电极LSV、EIS及循环稳定性能及库伦效率数据]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|