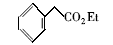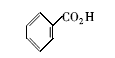利用对氨基苯磺酸氟硼酸重氮盐与Fe3O4磁性纳米粒子(MNPs)的偶联反应,非常方便地制备出表面含有磺酸基的Fe3O4磁性纳米粒子。 透射电子显微镜(TEM) 测试结果表明,粒子的平均粒径在 20 nm左右。 溶解性实验表明,该纳米粒子具有较好的水溶性,但不溶于常用的有机溶剂,因此可利用其磁性回收并循环使用。 将该纳米粒子用于催化羧酸与醇的酯化反应,产物酯的收率为71%~86%。 催化剂在酯化反应中的最优使用量为1.5%(质量分数)。 同时,该催化剂可催化果糖合成5-羟甲基糠醛(HMF),收率为32%。
Fe3O4 magnetic nano particles(MNPs) with sulfonic acid groups on the surface were readily prepared via coupling reaction between 4-amino phenylsulfonic acid diazonium tetrafluoroborate and Fe3O4 nano particles. Transmission electron microscopy(TEM) images reveal that the average size of these acidic particles is about 20 nm. These acidic particles show good solubility in water, but they are insoluble in most of common organic solvents, allowing easy isolation and recycling of the particles by their magnetic property in catalytic reactions. In terms of application, when the acidic magnetic particles were used to catalyze esterification reactions between carboxylic acids and alcohols, moderate to high isolated yields(71%~86%) of ester products were obtained. The optimized catalyst loading is 1.5%(mass fraction). Furthermore, 5-hydroxymethyl furfural(HMF) was also synthesized in a 32% yield from fructose utilizing the acidic magnetic particles as a catalyst.
催化剂在化学反应中具有至关重要的作用。 传统的均相与异相催化剂各有优缺点。 均相催化剂催化效率高、选择性好,但制备方法复杂 (一般需要配体),成本高,回收利用较困难;异相催化剂易于循环利用,但催化效率低。 近年来,为了提高非均相催化剂的效率,人们将催化剂做成纳米尺寸以增加其表面积[1,2,3,4]。 不过,纳米尺寸的异相催化剂在制备过程中,用传统的过滤或离心手段进行分离,存在效率低、耗能高等缺点。 为了解决这一问题,近年来又出现了磁性纳米催化剂,利用磁性实现催化剂的回收利用[5]。 磁性纳米催化剂表面能高,易团聚,因此需要进行表面修饰。 在磁性纳米催化剂中,提供磁性的Fe3O4纳米粒子廉价易得,是研究与应用最广泛的一种磁性载体[6]。
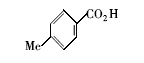
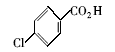
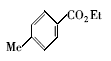
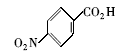
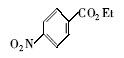
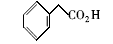
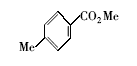
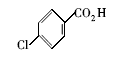
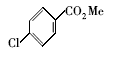
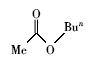
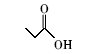
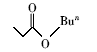
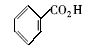
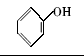
浓硫酸作为一种广泛使用的酸性催化剂,年消费量达上千万吨。 但这种原料在使用后一般无法回收利用,造成极大的浪费且增加环保压力。 开发可循环利用的固体酸催化剂来代替传统的硫酸,近年来引起人们的广泛关注[7,8,9]。 为了对催化剂进行更好地回收利用,带有磺酸基的磁性纳米催化剂也有相关报道[10,11,12,13]。 但是,文献[10,11,12]中制备催化剂要用硅烷偶联剂和剧毒的氯磺酸等,方法复杂,成本高(如图1所示)。 本文利用对氨基苯磺酸重氮盐与Fe3O4 纳米粒子偶联,得到了含有磺酸基的水溶性铁磁性纳米粒子,方法简便、原料价廉易得(图1);在应用方面,我们用该磁性粒子催化酯化反应以及制备5-羟甲基糠醛(HMF)。
 | 图1 含磺酸基的磁性纳米催化剂制备方法比较[10,11,12]Fig.1 Comparison of methods for the preparation of MNPs with sulfonic acid group[10,11,12] |
Bruker AV 400 MHz型核磁共振仪(NMR,瑞士Bruker公司)、Tecnai G2 F20型透射电子显微镜(TEM,美国FEI公司);FeCl3·6H2O、FeSO4·7H2O、尿素、NaOH、NaNO2、对氨基苯磺酸、盐酸、氟硼酸、苯甲酸、无水乙醇、二氯甲烷、果糖、二甲亚砜(DMSO)、石油醚和乙酸乙酯均为分析纯试剂,均购自于国药集团化学试剂有限公司;去离子水自制。
将FeCl3·6H2O(1.35 g,6 mmol)、FeSO4·7H2O(0.69 g,2.5 mmol)、尿素(1.2 g,20 mmol)用10 mL脱氧去离子水溶解,然后在100 ℃下反应12 h。 自然冷却至室温后再放置12 h。 将反应所得产品离心分离,然后用脱氧去离子水洗涤5次,用磁铁将溶液和Fe3O4纳米粒子分离,分离后将所得产品在50 ℃下烘干,得到带有磁性的黑色Fe3O4纳米粒子(0.26 g,收率44.8%)。
由于对氨基苯磺酸是两性化合物,易形成内盐而使溶解度下降。 因此操作中先将对氨基苯磺酸变成钠盐,以使重氮化反应顺利进行。 得到对氨基苯磺酸盐酸重氮盐的水溶液后,再加入冷的氟硼酸,由于氟硼酸重氮盐一般溶解度低,因此从水溶液中析出。 具体如下:对氨基苯磺酸晶体(1.05 g,6 mmol)溶于5%NaOH(5 mL)溶液中。 称取NaNO2(0.4 g,6 mmol)并溶于3 mL去离子水中,将此溶液倒入前述碱性溶液中,冷却至05 ℃,加入2 mol/L的盐酸6 mL,搅拌 20 min。 在05 ℃下, 滴加冷的氟硼酸,搅拌30 min,得到细小的淡黄色氟硼酸重氮盐,过滤、干燥,得重氮盐0.77 g(图2,收率55.5%)。
将Fe3O4(100 mg)纳米粒子分散在0.1 mol/L NaOH(20 mL)溶液中,然后加入氟硼酸重氮盐(96 mg),用机械搅拌器搅拌48 h。 抽滤,滤液用稀盐酸调至pH<2,然后缓慢加入适量无水乙醇,有橙色细小晶体析出。 抽滤,烘干得橙红色晶体(80 mg)。 取少量橙红色晶体,检验其在水、乙酸乙酯和乙醇等溶剂中的溶解性。
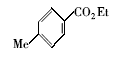
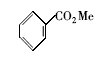
在一圆底烧瓶中加入苯甲酸(4.0 g,33 mmol)、无水乙醇(30 mL)和水溶性Fe3O4磁性纳米粒子(60 mg,质量分数1.5%),安装分水器,机械搅拌下加热回流 8 h,期间补加乙醇4次,每次20 mL。 反应完成后,改为蒸馏装置蒸出过量乙醇。 用磁铁将催化剂取出,重复利用。 将残留液倒入盛有30 mL冷水的烧杯中,搅拌下分批加入饱和Na2CO3溶液,中和至无气体产生,水相用乙酸乙酯(20 mL×3)萃取,合并有机相,无水MgSO4干燥,最后过柱纯化(洗脱剂: V(石油醚): V(乙酸乙酯)=5:1)得苯甲酸乙酯(4.21 g,85%)。1H NMR(CDCl3), δ:8.02~8.09(m,2H),7.50~7.56(m,1H),7.38~7.43(m,2H),4.38(q,2H),1.40(t,3H)。
称取果糖(1.00 g)与含磺酸基团的Fe3O4纳米粒子(150 mg)加入烧杯中,再加入10 mL DMSO混合,将混合溶液在100 ℃下反应4 h,冷却至室温,再加入冰水 10 mL,用乙酸乙酯萃取3次,合并有机相、干燥、浓缩,粗产物用柱层析纯化 (洗脱剂: V(石油醚): V(乙酸乙酯)=2:1)。 最后称得产品为0.22 g,收率为32%。1H NMR(CDCl3), δ:9.54(s,1H),7.22~728(m,1H),6.49~652(m,1H),4.69(s,2H),199(s,1H)。
采用共沉淀法合成Fe3O4 磁性纳米粒子。 共沉淀法合成纳米粒子的优点是:成本低、操作简便、无需高温高压、反应时间短、适合工业化生产等。 我们以FeCl3·6H2O和FeSO4·7H2O为铁源,尿素作沉淀剂,很方便地制备出Fe3O4 磁性纳米粒子(图3A)。 该纳米粒子具有较强的磁性,可很容易地被搅拌子或磁铁吸引。 受Griffete等的工作[13]启发,我们将Fe3O4纳米粒子与对氨基苯磺酸氟硼酸重氮盐直接偶联,得到橙色的含磺酸基的Fe3O4磁性纳米粒子(图3B)。 与文献[10,11,12,13]相比,我们的制备方法具有原料价廉易得,条件温和,步骤简单,催化剂易于回收利用等优点。
催化剂制备过程中的条件优化如表1所示。 不进行超声分散且反应时间仅为2 h时,所得催化剂几乎无磁性。 通过初期的超声分散及反应过程中的快速剧烈搅拌,将反应时间延长至48 h,得到具有一定磁性的催化剂。
| 表1 制备水溶性Fe3O4磁性纳米粒子的条件优化 Table 1 Optimization for the preparation of water-soluble magnetic Fe3O4 nanoparticles |
该纳米粒子可在水中溶解得到橙红色通明的溶液(图3C)。 由于该粒子外围被磺酸基包围,具有强极性,因此不溶于常见的有机溶剂。 水溶性Fe3O4 磁性纳米粒子的溶解性情况见表2。 但是,与Fe3O4 磁性纳米粒子相比,水溶性Fe3O4 磁性纳米粒子的磁性有所降低,这可能是因为其外面包裹了磺酸基等基团。 由图3D可以看出,水溶性Fe3O4 磁性纳米粒子在乙醇介质中为不溶,且在较强磁铁作用下能被吸引到容器的侧壁上。
| 表2 水溶性Fe3O4磁性纳米粒子在不同介质中的溶解情况 Table 2 Solubility of water-soluble magnetic Fe3O4 nanoparticles in different media |
为了进一步观察所制备纳米粒子的微观结构,图4给出了 Fe3O4纳米粒子与水溶性Fe3O4纳米粒子的透射电子显微镜(TEM)照片。 Fe3O4纳米粒子呈不规则的块状结构,有些有棱角,平均尺寸约20 nm。 水溶性Fe3O4纳米粒子的尺寸也在 20 nm 左右,与Fe3O4纳米粒子相比并未明显增大,这是因为表面的磺酸基团对尺寸的增加非常有限;从粒子的形状来看,水溶性Fe3O4纳米粒子基本无棱角,可能是表面修饰后造成的结果。
苯磺酸及其衍生物常用作酯类化合物合成的催化剂。 本文所制备的水溶性Fe3O4磁性纳米粒子,表面含有苯磺酸基团,因此我们推测该纳米粒子能催化酯的合成。 首先,以苯甲酸和乙醇的酯化反应作为研究对象。 将苯甲酸与过量的乙醇混和,然后加入一定量的磁性纳米催化剂,回流并用分水器分水。图5给出了不同催化剂用量(质量分数)对反应产率的影响。 当催化剂质量分数低于1%时,产率较低;当催化剂质量分数为1%时,产率提高到近70%;当质量分数增加到1.5%时,收率达到85%;再增加催化剂用量,收率提高不明显。 另外,以苯甲酸乙酯合成为例,研究了催化剂的循环使用情况,结果表明,循环使用5次后,催化剂活性稍有下降,但产率仍在70%以上。 与我们以前使用浓硫酸/氨基磺酸协同催化剂相比[9],催化剂质量分数由以前的31.9%降至1.5%。 这可能是因为本文中是纳米尺寸的催化剂,催化效率高于传统尺寸的催化剂。
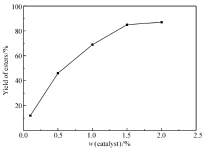 | 图5 不同用量的水溶性磁性纳米催化剂与苯甲酸乙酯产率关系图Fig.5 Correlation curve between the amount of water-soluble magnetic Fe3O4 nanoparticles and the yields of ethyl benzoate |
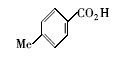
为了进一步验证水溶性Fe3O4磁性纳米粒子在催化酯化反应中的应用,我们还合成了其它的几种酯类化合物(表4)。 从表4中可以看出,简单酯的合成收率为71%~86%,但苯甲酸苯酯合成收率仅百分之十几。 产率低的原因可能是在酯化反应中,苯酚的羟基亲核性弱,反应活性低。
| 表4 水溶性磁性纳米粒子催化合成不同酯的结果 a Table 4 Esters syntheses catalyzed by water-soluble magnetic Fe3O4 nanoparticles a |
本文利用价廉易得的原料,在温和条件下通过简便的两步法合成了一种外围含磺酸基团的Fe3O4磁性纳米粒子。该纳米粒子可被强磁铁吸附在容器壁上。 TEM 结果表明,粒子呈不规则形状,平均尺寸约20 nm。 该纳米粒子具有较好的水溶性,但不溶于常用的有机溶剂,因此在催化反应中易于回收利用。 利用该磁性纳米粒子,可催化合成酯类化合物 (中等至高收率),催化剂质量分数为1.5%。 在合成苯甲酸乙酯的反应中,催化剂循环利用5次,产物收率仍在70%以上。 同时,利用该催化剂,可将果糖转化成非常有价值的 5-羟甲基糠醛。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|