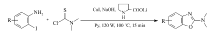
建立了一种简单实用、经济高效的以取代2-碘芳胺和 N, N-二甲基氨基硫代甲酰氯为原料,以碘化亚铜为催化剂,吡啶为溶剂,100 ℃条件下,串联合成2-( N, N-二甲氨基)苯并噁唑衍生物的微波催化体系,合成了一系列中等至良好产率的2-( N, N-二甲氨基)苯并噁唑衍生物,最高产率达90%。
Microwave-assisted one-pot synthesis of a variety of N, N-dimethyl-2-benzoxazolamine derivatives were achieved by the cascade reaction of substituted 2-iodoanilines with dimethylcarbamothioic chloride in pyridine in the presence of CuI at 100 ℃ with moderate to good yields(up to 90%).
苯并噁唑不仅是众多具有生物活性天然产物的重要结构骨架,也是一些新药的前体化合物。 其中2-氨基苯并噁唑衍生物是一类具有较高生物活性的含氮稠杂环化合物,广泛地应用在有机化学、医药和生物等领域[1,2,3]。 以2-氨基苯并噁唑为母体结构的药物在治疗阿尔茨海默氏病、精神分裂症、艾滋病(AIDS)和肿瘤等疾病上有诸多应用[4,5]。 例如,含有2-氨基苯并噁唑类的非核苷类HIV-1逆转录酶抑制剂、丁酰胆碱酯酶抑制剂、酪氨酸激酶抑制剂等已广泛应用于临床治疗[6]。
常见合成2-氨基苯并噁唑化合物的方法主要有以下3种:1)金属催化苯胺环化;2)羧酸衍生物与邻氨基苯酚缩合反应;3)氧化-环化邻氨基苯酚与醛制备[7,8,9]。 虽然这些方法均非常有效,但是也存在原料获取困难、部分试剂毒害大、条件剧烈和环境污染等问题[10]。 例如,2006年,EI-Faham等[11]以邻氨基苯酚与 N, N, N', N'-四甲基氯甲脒六氟磷酸盐为原料合成目标产物,但该方法中使用了难以制备的四甲基氯甲脒六氟磷酸盐为原料,且反应时间较长,有副反应发生。 因此,寻求简便、高效、普适性高的苯并噁唑合成方法是其在应用过程中急需解决的难题。
铜催化串联、偶联反应相比其他过渡金属催化反应,具有催化剂便宜、原料易得,重要的是其多与氮配体和氧配体形成简单的螯合物催化剂,且铜催化条件温和,可避免副产物的生成。 因此,铜催化反应以其低成本、高效率、环保绿色等优点受到人们广泛的关注[12]。 自1986年,Gedye将微波技术引入有机合成后,被广泛地研究和使用。相比传统加热方法,微波技术具有高效、节能等优点[13]。
采用易于获得且价廉的2-碘芳胺、 N, N-二甲基氨基硫代甲酰氯为原料,通过便宜且活性高的铜盐催化,以微波作为辅助合成手段,高效制备2-( N, N-二甲氨基)苯并噁唑化合物(见Scheme 1);与以往反应相比,该反应催化体系引入微波辅助合成大为缩短了反应时间,提高了合成效率,既节约了成本,又使反应操作简化。
Initiator+微波合成仪(瑞典Biotage公司);WRS-1B型数字熔点仪(上海精密科学仪器有限公司);AVANCE III型核磁共振仪(NMR,德国Bruker Biospin公司);Agilent 6890N-Agilent 5973型气-质联用质谱仪(GC-MS,美国Agilent公司)。
2-碘芳胺和 N, N-二甲基氨基硫代甲酰氯购自上海晶纯试剂有限公司,上述试剂及其它试剂均为分析纯;柱层析(TLC)硅胶H和G(青岛海洋化工厂),未再活化;TLC硅胶铝板(德国Merck公司)。
1.2 2-( N, N-二甲氨基)苯并噁唑衍生物的制备
在干燥的反应容器内加入2-碘苯胺(1.0 mmol)和有机溶剂吡啶3.0 mL,充分溶解,依次加入无机碱NaOH(3.0 mmol)、 N, N-二甲基氨基硫代甲酰氯(2.5 mmol),催化剂碘化亚铜(0.1 mmol)和脯氨酸锂(0.1 mmol)。 置于微波反应器中,在120 W功率、100 ℃,反应15 min,停止反应后冷却至室温,减压浓缩,所得粗产品通过乙酸乙酯-石油醚硅胶柱层析分离得到2-( N, N-二甲氨基)苯并噁唑,计算产率。目标产物通过1H NMR、13C NMR和质谱进行结构表征。
2-( N, N-二甲氨基)苯并噁唑 黄色固体, 产率85%;mp 88.589.5 ℃;1H NMR(CDCl3,400 MHz), δ:7.32(d,J=6.4 Hz,1H),7.20(d,J=8.0 Hz,1H),7.09(t,J=6.6 Hz,1H),6.94(t,J=8.0 Hz,1H),3.13(s,6H);13CNMR(CDCl3,100 MHz), δ:162.9,149.1,143.3,123.6,120.4,115.9,108.8,37.4;MS(EI, m/z):162[M+]。
5-甲基-2-( N, N-二甲氨基)苯并噁唑 浅黄色固体,产率81%;mp 66.568.5 ℃;1H NMR(CDCl3,400 MHz), δ:7.21(d,J=8.0 Hz,1H),7.03(s,1H),6.93(d,J=8.0 Hz,1H),3.14(s,6H),2.37(s,3H);13CNMR(CDCl3,100 MHz), δ:162.7,149.3,141.1,130.0,124.6,115.3,109.1,37.5,21.5;MS(EI, m/z):176[M+]。
6-甲基-2-( N, N-二甲氨基)苯并噁唑 黄色固体,产率82%;mp 52.554.5 ℃;1H NMR(CDCl3,400 MHz), δ:7.19(d,J=7.8 Hz,1H),7.02(s,1H),6.92(d,J=7.6 Hz,1H),3.13(s,6H),2.34(s,3H);13CNMR(CDCl3,100 MHz), δ:162.7,149.1,141.1,130.18,124.6,115.2,109.3,37.6,21.5;MS(EI, m/z):176[M+]。
7-甲基-2-( N, N-二甲氨基)苯并噁唑 棕色油状液体,产率73%;1H NMR(CDCl3,400 MHz), δ:7.08(d,J=7.6 Hz,1H),6.96(d,J=7.6 Hz,1H),6.71(t,J=7.2 Hz,1H),3.07(s,6H),2.32(s,3H);13CNMR(CDCl3,100 MHz), δ:162.8,148.3,142.8,123.7,121.6,119.1,113.5,37.6,14.8;MS(EI, m/z):176[M+]。
4-甲基-2-( N, N-二甲氨基)苯并噁唑 浅黄色固体,产率76%;mp 49.551.5 ℃;1H NMR(CDCl3,400 MHz), δ:7.08(d,J=8.0 Hz,1H),6.93(d,J=7.6 Hz,1H),6.87(t,J=7.6 Hz,1H),3.17(s,6H),2.48(s,3H);13CNMR(CDCl3,100 MHz), δ: 162.7,148.5,142.3,126.2,124.8,119.8,106.0,37.6,16.5;MS(EI, m/z):176[M+]。
5-硝基-2-( N, N-二甲氨基)苯并噁唑 黄色固体,产率89%;mp 161.5164.0 ℃;1H NMR(CDCl3,400 MHz), δ:8.04(s,1H),7.85(d,J=8.6 Hz,1H),7.20(d,J=8.6 Hz,1H),3.13(s,6H);13C NMR(CDCl3,100 MHz), δ:164.3,152.7,145.4,144.6,116.5,111.3,108.3,37.9;MS(EI, m/z):207[M+]。
5-溴-2-( N, N-二甲氨基)苯并噁唑 浅黄色固体,产率83%;mp 65.567.5 ℃;1H NMR(DMSO- d6,400 MHz), δ:7.34(s,1H),7.02(s,2H),3.11(s,6H);13CNMR(DMSO- d6,100 MHz), δ:163.6,148.1,146.2,122.7,118.5,116.3,110.5,37.4;MS(EI, m/z):227[M+]。
6-氯-2-( N, N-二甲氨基)苯并噁唑 浅黄色固体,产率85%;mp 97.598.5 ℃;1H NMR(CDCl3,400 MHz), δ:7.16(t,J=7.6 Hz,2H),7.05(t,J=6.4 Hz,1H),3.14(d,J=2.6 Hz,6H);13CNMR(CDCl3,100 MHz), δ:163.5,149.2,142.2,125.4,124.1,116.3,109.6,37.8;MS(EI, m/z):196[M+]。
5-氯-2-( N, N-二甲氨基)苯并噁唑 浅黄色固体,产率90%;mp 90.592.5 ℃;1H NMR(CDCl3,400 MHz), δ:7.24(s,1 H),7.06(d,J=8.4 Hz,1H),6.87(d,J=9.0 Hz 1H),3.12(s,6H);13CNMR(CDCl3,100 MHz), δ:163.7,147.5,144.9,129.2,119.7,115.7,109.1,37.9;MS(EI, m/z):196[M+]。
5-叔丁基-2-( N, N-二甲氨基)苯并噁唑 浅黄色油状液体,产率67%;mp 68.570.5 ℃;1H NMR(CDCl3,400 MHz), δ:7.37(s,1H),7.11(d,J=8.4 Hz,1H),6.99(d,J=8.4 Hz,1H),3.11(s,6H),1.27(s,9H);13CNMR(CDCl3,100 MHz), δ:163.1,147.1,147.1,143.0,117.1,113.0,107.8,37.7,34.7,31.8;MS(EI, m/z):203[M+]。
2-( N, N-二乙氨基)苯并噁唑 浅黄色油状液体,产率81%;1H NMR(CDCl3,400 MHz), δ:7.25(d,J=7.4 Hz,1H),7.19(d,J=8.0 Hz,1H),7.06(t,J=7.4 Hz,1H),6.92(t,J=7.4 Hz,1H),3.53 (m,4H),1.22(t,J=7.2 Hz,6H);13CNMR(CDCl3,100 MHz),δ: 162.0,148.9,143.3,123.9,119.9,115.8,108.7,43.1,13.6;MS(EI, m/z):190 [M+]。
5-硝基-2-( N, N-二乙氨基)苯并噁唑 黄色固体,产率80%;mp 94.596.5 ℃;1H NMR(CDCl3,400 MHz), δ:8.04(s,1H),7.84(d,J=8.4 Hz,1H),7.21(d,J=8.8 Hz,1H),3.52(t,J=7.2 Hz,4H),1.22(t,J=7.2 Hz,6H);13CNMR(CDCl3,100 MHz), δ:163.4,152.7,145.1,144.4,116.4,111.0,108.1,43.1,13.3;MS(EI, m/z):235[M+]。
首先,以2-碘苯胺和 N, N-二甲基氨基硫代甲酰氯为模型考察不同铜盐对产率的影响,结果列于表1。 从表1可以看出,在各种铜盐筛选中,CuI的效果最好,在吡啶溶剂中可以与脯氨酸锂更好的形成具有有效催化环境的配合物;其次考察不同无机碱对反应的影响,碱性强的NaOH给出高达83%的收率,而其它无机碱与NaOH相比均不甚理想,因此后续反应我们均以NaOH为碱进行考察;最后我们考察了温度和辐射时间对该反应的影响。 温度在该反应中起重要作用,高温对产率贡献不大,当将反应温度降低至90 ℃,产物收率明显降低,升高至110 ℃,产率基本没变化,说明最优温度是100 ℃,此外通过缩短和延长反应时间,选定在15 min条件下收率最优。 据此,确定适宜反应条件为:2-碘苯胺(1.0 mmol), N, N-二甲基氨基硫代甲酰氯(2.5 mmol),CuI(0.1 mmol),脯氨酸锂(0.1 mmol),NaOH(3.0 mmol),吡啶3.0 mL,100 ℃,于120 W微波辐射反应15 min。
| 表1 铜催化下2-碘苯胺与 N, N-二甲基硫代氨基甲酰氯最优反应条件优化 a Table 1 Optimization of reaction conditions for copper-catalyzed reaction of 2-iodoanilines and dimethylcarbamothioic chlorides a |
在最优条件下,考察了催化体系对于不同底物的普适性,结果列于表2。 从表2中可以看出,上述催化体系对于各种2-碘芳胺和 N, N-二甲基氨基硫代甲酰氯均具有较高的催化活性,大部分底物能以相对较好的收率生成相应的目标产物,2-溴芳胺也可和 N, N-二甲基氨基硫代甲酰氯反应,但活性较低。 取代基的电子效应对反应有影响,不管是带有吸电子还是供电子的取代基的2-碘芳胺,均能顺利生成相应的2-( N, N-二甲氨基)苯并噁唑产物。 吸电子取代基活性略高于供电子取代基2-碘芳胺,供电子取代2-碘芳胺与 N, N-二乙基氨基硫代甲酰氯反应的产率略微降低;其次位阻效应对该反应有很大的影响。 例如,氨基的间位或对位有取代基的2-碘芳胺与 N, N-二甲基氨基硫代甲酰氯能够较好地关环,氨基或者碘邻位由于空间位阻原因,相应产率略低于其间位和对位取代基的2-碘芳胺。 此外,2-碘芳胺也可与 N, N-二乙基氨基硫代甲酰氯反应生成相应产物。 该反应所得产物基本与文献[14]中各化合物的1H NMR(CDCl3)、13C NMR(CDCl3)谱和MS数据一致,说明2-( N, N-二甲氨基)苯并噁唑衍生物在该合成工艺下得到顺利合成。
| 表2 2-( N, N-二甲氨基)苯并噁唑衍生物的合成 a Table 2 Synthesis of N, N-dimethyl-2-benzoxazolamines a |
依据最优反应条件,对底物进行克级放大实验。 以2-碘苯胺(20.0 mmol)、 N, N-二甲基氨基硫代甲酰氯(50.0 mmol)为原料,在2.0 mmol CuI作为催化剂,2.0 mmol脯氨酸锂,60.0 mmol NaOH,在100 ℃,于120 W微波辐射反应15 min时,能顺利生成2-( N, N-二甲氨基)苯并噁唑,产率为75%。
研究了铜盐催化下微波辐射下2-碘芳胺和 N, N-二甲基氨基硫代甲酰氯合成2-( N, N-二甲氨基)苯并噁唑衍生物的反应,该催化体系对不同取代基的2-碘芳胺和 N, N-二甲基氨基硫代甲酰氯具有良好的普适性,均能高选择性的完成该反应,因此该体系非常适合用于合成生物学上含有2-( N, N-二甲氨基)苯并噁唑框架的重要化合物。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|