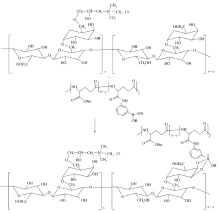
为拓宽多重响应性凝胶在生物医学领域中的应用,本文基于生物大分子构筑具有pH响应、糖响应性的可自修复性水凝胶。 本文选用3-氨基苯硼酸(APBA)和2,3-环氧丙基三甲基氯化铵(CHGTA)分别对聚谷氨酸( γ-PGA)和瓜尔胶(GG)进行改性制备了聚谷氨酸- g-氨基苯硼酸( γ-PGA- g-APBA)和阳离子瓜尔胶,在此基础上,对 γ-PGA- g-APBA和阳离子瓜尔胶进行物理共混制备生物基凝胶。 通过傅里叶变换红外光谱仪(FTIR)、核磁共振波谱仪(1H NMR)和流变仪对聚合物化学结构、接枝率、流变性能和力学性能进行表征,并考察了凝胶在不同pH值及糖浓度下刺激响应性。 结果表明,凝胶具有自修复性,修复效率可达100%;具有pH响应性,在环境pH值较高时更易形成凝胶,且凝胶强度随pH值升高而增大;同时所制凝胶具有糖响应性,在4 g/L的葡萄糖溶液中浸泡后即可导致凝胶解体。 这些结果说明功能基团APBA的引入可赋予凝胶多重响应性。 所制的双重响应性生物基凝胶具有良好的生物相容性,有望应用于生物医学、功能器件、传感等领域。
Phenylboronic acid and derivatives that conjugate with diol units to form a reversible ester bond can be used to prepare self-healing and stimuli-responsive materials. Stimuli-responsive hydrogels based on phenylboronic acid have been reported to have excellent self-healing properties. However, in these examples, employed polymers are not fully degradable nor have low biocompatibility. Therefore, this study aims to prepare a bio-based hydrogel for potential biomedical applications. Poly( γ-glutamic acid- g-3-aminophenylboronic acid)( γ-PGA- g-APBA) was synthesized by grafting 3-aminophenylboronic acid(APBA) in the presence of 1-ethyl-3-(3-dimethylaminopropyl)-carbodiimide(EDC) and N-hydroxysuccinimide(NHS) as catalysts, and guar gum was modified by cationic etherification agent, 2,3-epoxypropyltrimethylammonium chloride(CHGTA). These two modified bio-polymers were characterized by Fourier transform infrared(FT-IR) spectroscopy, nuclear magnetic resonance(1H NMR), and ultraviolet-visible(UV-Vis) spectrophotometer, and were mixed to form hydrogels. Mechanical properties of the prepared hydrogels were characterized by the rheometer. The results show that( γ-PGA- g-APBA/CGG) hydrogels have self-healing and pH-responsive properties. The structure of the gels is damaged with large strain and reconstructed completely with small strain, indicating that the hydrogel have the self-healing property and the repeatability. With the increase of pH value from 7 to 9, the hydrogels are formed and their strengths increase with pH, due to the conversion of the trigonal boronic-ester bond to tetrahedral boronic-ester bond. In the presence of 4 g/L glucose, the formed gel dissociates and changes to sol, because of the competing reaction between glucose and guar gum with PBA group. Moreover, rheology test indicates the shear-thinning and injectable properties of the hydrogels. Thus, the bio-based( γ-PGA- g-APBA/CGG) hydrogels have the potential applications in sensors, medicine and tissue engineering.
智能凝胶能够对外界环境的变化做出响应,具有更多的功能与更广泛的应用范围[1,2,3,4,5]。 构筑刺激响应性凝胶需对分子结构进行精确的设计与控制,通过大分子改性[6]、活性聚合[7]和点击化学[8]等方法在聚合物分子链中引入具有可响应外部刺激的官能团,或利用氢键、配位键、静电相互作用、主客体相互作用、亲疏水相互作用、 π-π相互作用等构筑刺激响应性凝胶[9,10,11]。 而利用可逆共价键来构筑刺激响应性凝胶也是一种常用方式,亚胺键、二硫键、配位键[12]和可逆硼酸酯键等可逆共价键具有相对较好的化学稳定性和较快的响应性,因而常被用来构筑响应性凝胶。 其中,基于硼酸酯键的凝胶是由苯硼酸与含1,2-或1,3-二醇的化合物结合的,具有较好的pH和糖响应性、自修复性,引起了研究人员的兴趣[13]。 Anderson等[14]合成了侧基含有苯硼酸与2,3,4,5,6-己五醇基团的共聚物,通过两种侧基形成的硼酸酯键形成凝胶,该凝胶具有较好的自修复性和葡萄糖响应性。 该课题组进而分别利用苯硼酸和 D-(+)-葡萄糖酸 δ-内酯修饰四臂聚乙二醇(PEG),将修饰后的两种分子在溶液状态下混合即可得到具有糖响应性的自修复凝胶[15];Zhang等[16]利用含二硫键的双硼酸酯交联剂交联含多巴胺侧基的聚甲基丙烯酸,得到具有自修复性、氧化还原与pH响应性的凝胶。 在已有的研究报道中,绝大部分研究中选用了不可降解或生物相容性较差的聚合物,从而限制了它们进一步在生物医学领域中的应用[17]。 生物大分子凝胶是通过生物大分子之间的相互作用得到的超分子凝胶,其原料来源广泛,具有优异的生物相容性和可降解性,可拓宽其在更广领域中的应用。
选用具有良好生物相容性及生物可降解性的生物大分子聚谷氨酸( γ-PGA)和瓜尔胶(GG), 通过3-氨基苯硼酸(APBA)和2,3-环氧丙基三甲基氯化铵分别对 γ-PGA和GG接枝改性,制备聚谷氨酸- g-氨基苯硼酸( γ-PGA- g-APBA)及阳离子瓜尔胶(CGG)。 APBA在弱碱性条件下可与1,2或1,3二羟基形成硼酸酯键(见图1),而在酸性介质中硼酸酯键断裂,因而所制的材料具有一定的pH响应性;利用 γ-PGA- g-APBA和CGG在弱碱性条件下反应制备凝胶;详细考察了所得凝胶的pH响应性、葡萄糖响应性与自修复性。
3-氨基苯硼酸(APBA,≥98%)、2,3-环氧丙基三甲基氯化铵(CHGTA,≥98%),上海麦克林生化科技有限公司;1-乙基-3-(3-二甲基氨丙基)碳二亚胺盐酸盐(EDC·HCl,≥99%)、 N-羟基丁二酰亚胺(NHS,≥99%)、瓜尔胶(GG,粘度5000~5500 cps)均购自阿拉丁试剂(上海)有限公司;聚谷氨酸( γ-PGA,平均相对分子质量2.0×105~5.0×105)购自日本和光纯药工业株式会社;实验用蒸馏水为二次蒸馏水。
AVANCE Ⅲ 400 MHz型核磁共振谱仪(1H NMR,英国布鲁克公司);Nicolet iS50 FT-IR型傅里叶变换红外光谱仪(FTIR,美国赛默飞世尔科技公司); DHR-2型流变仪(美国TA仪器公司),使用20 mm平行板。
1.2.1 阳离子瓜尔胶(CGG)的制备
按照文献[18]方法制备CGG。 称取0.71 g GG于250 mL三口烧瓶中,加入150 mL去离子水,搅拌30 min,充分溶解;将0.27 g CHGTA与0.15 g NaOH溶于10 mL去离子水中后,逐滴滴入GG水溶液中,在4050 ℃条件下反应18 h。 反应结束后,用盐酸调节pH值为中性,将产物使用异丙醇沉淀,再用70%异丙醇洗涤2次,经冷冻干燥得白色絮状纤维,即为CGG。
1.2.2聚谷氨酸- g-氨基苯硼酸( γ-PGA- g-APBA)的制备
称取0.55 g APBA和0.38 g γ-PGA置于单口烧瓶中,加入60 mL去离子水,冰浴,搅拌至完全溶解;将含有EDC·HCl (3 mmol, 0.58 g)和NHS(9 mmol,1.03 g)的5 mL去离子水溶液逐滴加入反应液中,冰浴反应4 h。 反应结束后,产物用乙醇沉淀,再用去离子水与乙醇的混合溶液透析7 d,除去小分子杂质,每8 h换1次透析溶液。 透析后的样品溶液经冷冻干燥得到淡黄色海绵状固体,即为 γ-PGA- g-APBA。
1.2.3 刺激响应性凝胶的制备
取12.5 mg CGG溶于1 mL磷酸盐缓冲溶液(PBS)中;称取68.7 mg γ-PGA- g-APBA溶于2 mL PBS中。 待二者完全溶解后,将 γ-PGA- g-APBA溶液加入CGG溶液中,搅拌均匀,再滴加0.2 mL NaOH溶液(0.3 mol/L),振荡搅拌,即得超分子生物基刺激响应性凝胶。
1.2.4 凝胶自修复性测试
将凝胶用裁刀切成两半,一半使用罗丹明B染液浸没染色,取出后对两部分施加一定外力使两部分断面充分相互接触。 流变学测试:取适量凝胶,使用20 mm平行板,测试频率为1 Hz,测试程序为:1)对凝胶施加0.05%的应变,时间为60 s;2)应变值设置为500%时间设置为15 s;3)重复以上操作,对凝胶的储能模量( G')和损耗模量( G″)进行测试。
在EDC和NHS催化作用下,功能基团APBA可与 γ-PGA发生酰胺化反应生成略带黄色的 γ-PGA- g-APBA。 用FT-IR对改性聚合物的结构进行表征,结果如图2所示。
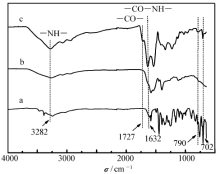 | 图2 APBA(a)、 γ-PGA(b)和 γ-PGA- g-APBA(c)的红外光谱Fig.2 FT-IR spectra of APBA(a), γ-PGA(b) and γ-PGA- g-APBA(c) |
图2谱线a中出现了波数在1584、1448 cm-1处的特征吸收峰,归属于APBA中苯环骨架振动峰,790、702 cm-1处为苯环间位取代面外变形的振动峰。 γ-PGA为氨基酸的聚合物,在 γ-PGA的红外光谱中(图2谱线b),1727 cm-1处为—CO—的伸缩振动吸收峰,1532 cm-1出现—NH—的面内弯曲振动峰,且在750700 cm-1之间可观测到—NH—的面外弯曲振动峰。 对 γ-PGA- g-APBA的红外谱图进行分析(图2谱线c),图中出现了间取代苯的吸收峰与羰基的吸收峰,同时在波数为1632 cm-1处出现了酰胺的伸缩振动峰;与未接枝的 γ-PGA相比,其羰基的吸收减弱。 这是由于酰胺基团中氮元素中孤对电子与羰基形成共轭体系,产生诱导效应,从而降低其羰基的吸收。 由此可以初步判断成功制备了 γ-PGA- g-APBA。
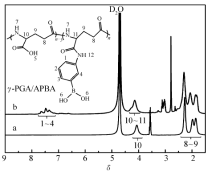
γ-PGA- g-APBA的结构进一步用核磁谱图(1H NMR)验证,结果如图3所示,其中,图3谱线a为 γ-PGA的谱图,图3谱线b为 γ-PGA- g-APBA的谱图。 1.72.3之间的峰归属于 γ-PGA主链中的—CH2—质子;1.96和1.74处的峰归属于临近—CH—的—CH2—质子(9号),2.25处的峰归属于临近羰基的—CH2—质子(8号);3.84.5处的峰为主链中与羧基相连的—CH—的质子峰(10号)。 但其在 γ-PGA- g-APBA的1H NMR谱图中,该峰分裂为两质子峰(图3谱线b),这是由于氨基苯硼酸与羧基作用生成酰胺键对—CH—的影响,使其电子云密度降低,化学位移增大,向低场移动;处于低场4.3处峰的峰面积越大,APBA的接枝率越高;而7.27.8处的质子峰归属于苯环上质子。 根据1H NMR谱图中各质子峰面积与氢原子个数的关系,并通过对 γ-PGA- g-APBA结构的分析,由1.72.3和7.27.8处的质子峰的峰面积比即可计算出各比例下APBA的接枝率。 根据计算得, γ-PGA- g-APBA接枝率为29%。
用2,3-环氧丙基三甲基氯化铵对GG进行改性,其红外图谱如图4所示。 CGG的FT-IR谱图中(图4谱线b),3349 cm-1处存在—OH的伸缩振动峰,877和1065 cm-1处的双峰为醚键—C—O—C—伸缩振动峰,而指纹区1015 cm-1处的峰为—C—O—的伸缩振动峰,为该区吸收最强的峰。 与GG的红外图谱相比(图4谱线a),CGG图谱中出现965 cm-1的吸收峰,该峰为—C—N—的伸缩振动峰,说明瓜尔胶改性成功。
2.2.1 凝胶的形成
分别将 γ-PGA、 γ-PGA- g-APBA与GG、CGG在不同的pH缓冲液中混合,其外观形貌如图5所示的数码照片。 从图5中可见,改性前 γ-PGA与GG、CGG的混合物在弱碱性条件下呈液体状,说明它们均不能形成凝胶(图5B中1、2号样品)。 因改性前 γ-PGA中不含硼酸基团,无法与GG/CGG中二羟基形成硼酸酯键,因而体系中不存在动态可逆键,无法形成凝胶。 将改性后的 γ-PGA- g-APBA与GG、CGG混合后,APBA中硼酸基团与瓜尔胶中的二羟基在弱碱性条件下结合,形成可逆酯键,从而形成凝胶。 但由于GG在水中的溶解度相对较差,可能影响GG与 γ-PGA- g-APBA之间的作用,因而形成的凝胶不稳定,静置一段时间后有去凝胶化现象(图5C中3号样品)。 而改性后CGG在水中的溶解度高,因而其与 γ-PGA- g-APBA在碱作用下易形成凝胶,即使放置一段时间后所制的 γ-PGA- g-APBA/CGG凝胶仍可较稳定存在(图5C中5号样品)。 但若体系中未加入NaOH溶液时,体系pH未达到硼酸酯键形成条件,则无法交联形成交联网络,无法形成凝胶(图5C中4号样品)。 这些结果表明只有在NaOH存在的碱性液中才能形成稳定的 γ-PGA- g-APBA/CGG凝胶。
2.2.2 自修复性能
为了研究 γ-PGA- g-APBA/CGG凝胶的自修复性能,将该凝胶切断后(如图6中插图所示),再将其放置一起并对凝胶的自修复性能进行测试;10 s后,切断的凝胶可完全修复,说明凝胶具有自修复性能,这是因为体系中的动态硼酸酯键可再次生成而形成凝胶。 为进一步表征凝胶自修复性能及修复的可重复性,利用旋转流变仪对凝胶进行阶跃式应变扫描,结果如图6所示。 施加较小应变时( γ=0.05%),所制 γ-PGA- g-APBA/CGG凝胶的储能模量( G')约为900 Pa;但在较大应变 ( γ=500%)下,凝胶网络遭到破坏, G'立即下降至~10 Pa,且其储能模量小于损耗模量( G″),即混合物表现为溶胶状态;而再次施加较小的应变( γ=0.05%)时,凝胶的 G'恢复至初始值,说明破损的凝胶可修复完全;多次重复改变应变的大小,凝胶可重复在大应变下破坏后,在小应变作用下,其储能模量与损耗模量均能完全恢复至初始状态,表明该凝胶具有自修复性能,且其自修复行为可多次重复。
 | 图6 自修复凝胶在不同应力下的流变性,插图为凝胶自修复照片Fig.6 Rheology analyses of the self-healing behavior Inset pictures are the photo-images of undamaged hydrogel(A), fresh-cut hydrogel(B), after self-healing(C) |
2.2.3 糖响应性
由硼酸基团与顺式1,2-或1,3-二羟基形成的硼酸酯键具有动态可逆性,多糖中同样存在顺式二羟基结构,可与硼酸基团形成硼酸酯键。 因而 γ-PGA- g-APBA与CGG形成的凝胶在糖溶液中时,由于CGG与糖类之间的竞争关系,赋予凝胶糖响应性。 为验证与探究这一猜想,对 γ-PGA- g-APBA/CGG凝胶进行糖响应性测试。 配制4 g/L的葡萄糖溶液,将凝胶浸泡于等体积葡萄糖溶液中,稍稍振荡后,静置2 min, γ-PGA- g-APBA/CGG凝胶完全去凝胶化,形成溶液状态,如图7所示。 说明葡萄糖与凝胶中的APBA反应生成新的硼酸酯键,而原凝胶中APBA与CGG硼酸酯键被破坏发生解离。因而, γ-PGA- g-APBA/CGG凝胶具有糖响应性,可应用于药物的控制释放领域。
 | 图7 在糖溶液中未浸泡(A)和浸泡后(B)的凝胶糖响应性数码照片Fig.7 Glucose-responsive property of the γ-PGA- g-APBA/CGG hydrogel without(A) and with(B) glucose |
2.2.4 pH响应性
硼酸酯键是由硼酸基团与1,2-或1,3-羟基形成的可逆共价键,而硼酸基团在溶液中存在两种形式,即不带电的三角形式和带电荷的四面体形式,其与二羟基形成稳定硼酸酯键需满足pH>p Ka,在不同的pH值下,硼酸酯键可发生转换,因此赋予凝胶pH响应性。
为了验证 γ-PGA- g-APBA/CGG凝胶的pH响应性,将凝胶置于10 mL离心管,配制一系列pH值分别为6.0、7.0、7.4、8.0及9.0的PBS,取等量缓冲液分别加入凝胶中,对凝胶的状态进行观察。如图8B所示,放置5 d后,凝胶在酸性条件下去凝胶化,变成溶胶状态;而在中性和碱性缓冲溶液中,仍能在一定程度上保持凝胶状态,且随着pH值的增加,凝胶越稳定。
 | 图8 凝胶在不同pH缓冲液中的变化图Fig.8 Optical images of the γ-PGA- g-APBA/CGG hydrogels in (1)pH=6.0, (2)pH=7.0, (3)pH=7.4, (4)pH=8.0, (5)pH=9.0 buffer solutions |
为了进一步探究凝胶的pH响应性,使用流变仪对不同pH缓冲溶液中凝胶进行频率扫描测试。设定测试温度为37 ℃,应变恒定为0.1%,在0.1100 rad/s的角频率范围内对凝胶进行测试,凝胶在pH值为7.0、7.4、8.0和9.0的缓冲溶液中的储能模量( G')和损耗模量( G″)如图9A9D所示。
'> | 图9 不同PBS中凝胶的流变图Fig.9 Rheology analyses of the hydrogels in various PBS A.pH=7.0; B.pH=7.4; C.pH=8.0; D.pH=9.0; E.storage modulus( G') of the hydrogels in different pH |
由于硼酸酯键是动态可逆化学键,其断裂和形成的速率存在化学平衡,平衡速率影响到凝胶在不同剪切速率下的粘弹行为。 凝胶的粘弹行为依赖于剪切速率的变化,在较小剪切速率下,剪切速率小于平衡速率,硼酸酯键的断裂与重新形成来得及适应外力变化,分子链有足够时间对外力作用做出响应,因而损耗模量高于储能模量,混合物主要表现为粘性溶胶状;而当剪切速率达到一定值时,剪切速率大于平衡速率,硼酸酯键来不及断裂与重新形成,分子链没有充足的时间解缠结,引起弹性响应,储能模量高于损耗模量,即此时混合物为类固体的凝胶状态,而储能模量与损耗模量的交点即为混合物的凝胶点,也是硼酸酯键断裂与重新形成的速率。 由图9可知,在pH=7.0、7.4的PBS中的凝胶在剪切速率为0.1100 rad/s的范围内均能观察到凝胶点,而pH=8.0、9.0的PBS中的凝胶在这一剪切速率范围内则观察不到凝胶点。 将各凝胶的储能模量进行比较(图9E)可得:随着缓冲溶液的pH值升高,凝胶的储能模量先升高,即相应凝胶强度依次升高。 这是由于随着凝胶环境的pH升高,体系中硼酸酯键的形成的数量更多,且更加稳定,聚合物网络交联密度提高,凝胶强度提高。 同时,由于硼酸酯键更稳定,分子链运动松弛时间延长,需要更长的时间对外力作用做出响应,具体表现即为体系凝胶点降低,即需要更低的剪切速率作用下体系才能表现为粘流态溶胶。
2.2.5 可注射性
可注射性是凝胶在生物医药领域应用所需的基本特性之一。 由于硼酸酯键的形成与p Ka值及体系pH有关,因此对于 γ-PGA- g-APBA/CGG凝胶而言,体系pH影响其交联程度进而对凝胶强度产生影响。 在一定pH值下,凝胶强度较低,具有可塑性,可使用26G注射针注射且不堵塞针头(图10A),且注射后可保持凝胶状态。
 | 图10 凝胶通过26G针头注射图片(A)及凝胶的剪切变稀行为(B)Fig.10 Optical image of the hydrogel passing through a 26-gauge needle(A) and shear-thinning behavior of self-healing gels(B) |
为进一步研究凝胶的可注射性,对其粘度随剪切速率的变化特点进行探究,如图10B所示。 由图可知,随着剪切速率的增加, γ-PGA- g-APBA/CGG凝胶的粘度逐渐降低。 硼酸酯键是动态可逆共价键,使凝胶具有动态可逆的机械性能,在较高的剪切速率下,凝胶动态交联网络瓦解,分子链趋向于在同一个速度梯度下运动,宏观表现为凝胶的粘度下降,因此可利用注射器对凝胶进行注射,即凝胶具有可注射性。
以生物大分子聚电解质聚谷氨酸( γ-PGA)和瓜尔胶(GG)为主要单体,选用功能基团3-氨基苯硼酸(APBA)对 γ-PGA接枝改性后制备功能化 γ-PGA- g-APBA;利用2,3-环氧丙基三甲基氯化铵(CHGTA)改性瓜尔胶制备阳离子瓜尔胶。 将两种改性产物的溶液在弱碱性条件下混合,即可制备得到自修复凝胶。功能基团APBA赋予了凝胶自修复性、pH响应性及糖响应性:凝胶在较大应变时发生破裂显示流体行为,较小应变时凝胶发生修复,其储能模量大于损耗模量;pH值大于苯硼酸p Ka值时,凝胶较稳定,小于苯硼酸p Ka值时凝胶解体;在有葡萄糖存在的条件下,凝胶解体。 这种具有良好生物相容性、pH响应性及葡萄糖响应性的生物基自修复凝胶应用于生物传感以及组织工程。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|