共同通讯联系人:余昌敏,研究员; Tel/Fax:025-83587982; E-mail:iamcmyu@njtech.edu.cn; 研究方向:荧光染料的设计与合成
荧光技术具有操作简便、分辨率高且可实现实时成像等特点,已被广泛应用于生物医学检测和成像领域,其中,近红外二区荧光染料(NIR-Ⅱ,10001700 nm)由于其发射波长较长,光散射和组织自发荧光干扰较少,在生物组织成像中具有更高的时空分辨率和更深的成像深度。 本文主要介绍了基于近红外二区荧光探针的设计原理及其在生物成像领域的研究现状,并对其发展作了进一步展望。
Co-corresponding author:YU Changmin, professor; Tel/Fax:025-83587982; E-mail:iamcmyu@njtech.edu.cn; Research interests:design and synthesis of fluorescence dyes
Due to simple operation, high resolution and real-time imaging,fluorescence technology has been widely used in detection and bioimaging. The second near-infrared window dyes(NIR-Ⅱ, 10001700 nm) have longer emission wavelength, less interference with light scattering and tissue autofluorescence, resulting in higher temporal and spatial resolution and deeper imaging depth in tissue imaging. In this review, we mainly introduce the designed mechanism and research progress in bioimaging based on NIR-Ⅱ dyes, and further give an outlook in the following studies.
光学荧光成像技术为生物研究和生物医学应用提供了强大的工具[1]。 尤其在早期癌症诊断和成像指导治疗中,光学成像探针和技术具有很好的应用前景,对临床癌症诊疗会产生重大影响[2,3]。 通过光学的方式在体内进行生物成像的过程中,光子穿透深度主要是由组织成分的散射和吸收决定的,而噪音和背景辐射则来自于组织自身的荧光和散射的光子。 生物成像技术的发展目标在于,达到更大的成像深度,更好的空间分辨率,以及更高的信噪比[4]。 最近的研究表明,在6501450 nm波长范围内组织吸收达到最低水平[5],且在此范围内成像波长越长,组织成分的光散射和自体荧光就会越少[6]。 因此,相较于在可见光(400750 nm)和传统的近红外光(NIR,750900 nm)区域成像相比,近红外二区(NIR-Ⅱ,10001700 nm)的生物成像技术可以更好地避免组织自发荧光和光子散射等背景干扰,已被越来越多地应用到生物医学成像领域。
目前,对于NIR-Ⅱ荧光探针的研究主要分为无机纳米材料、共轭聚合物和有机小分子材料3个方面[7,8,9,10,11]。 基于无机纳米材料的系统,包括单壁碳纳米管(Single-walled carbon nanotubes,SWNTs)[7,8]、半导体量子点(Quantum dots,QDs)稀土掺杂纳米颗粒等。 对于有机小分子染料而言,它们的物理和光学性能可以通过调节结构进行精细的调整,目前有以屏蔽单元-供体-受体-供体-屏蔽单元(Shielding unit-Donor-Acceptor-Donor-Shielding unit,S-D-A-D-S)和供体-受体-供体(Donor-Acceptor-Donor,D-A-D)作为核心结构的有机小分子荧光团。 在此,我们将详细介绍基于NIR-Ⅱ区的荧光探针在生物成像领域的研究进展。
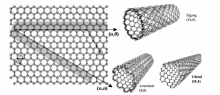
自1991年日本电镜学家Iijima在用直流电弧放电法制备C60的过程中首次发现碳纳米管以来,由于其独特的结构和优异的电学、力学、光学性能,已吸引了世界纳米科技研究领域的热切关注[9]。 如图1所示,碳纳米管是由层与层间相互关联的碳原子完全卷起的结构,直径从约1 nm到150 nm,长度则可达到厘米级别[10]。 按照管壁层数,碳纳米管可以分为如下2类:1)单壁碳纳米管(SWNTs)是一种由单层石墨卷成的柱状无缝管,其直径在0.72 nm之间;2)多壁碳纳米管是由相隔约0.34 nm的多个同轴单壁碳纳米管套构成,直径在1.4150 nm之间。
SWNTs型NIR荧光探针的发射大多位于NIR-A区域(IR-A,11.4 mm),是一种理想的生物探针,因为发射波长在近红外光谱范围内(0.81.7 mm),具有低的自体荧光,且激发和发射光谱带之间具有大斯托克斯位移,可以进一步减少背景自发荧光和散射的影响。 研究证实,发射波长在11001400 nm范围内,NIR荧光团的组织渗透率比接近800 nm的高。与目前已知的其它近红外荧光材料如有机荧光染料和半导体量子点相比,SWNTs的NIR荧光非常稳定,几乎无光漂白的极限,能承受长达10 h的激发光照射;生物体内的全血样品对此波段近红外荧光的吸收系数最小,单壁碳纳米管可以被细胞内吞进入哺乳动物细胞内部,而不影响细胞的分裂和生长,细胞毒性小。 因此,SWNTs已经显示出了生物和医学应用的潜力,它们独特的光学特性使其适合于生物成像[11,12]和生物传感[13]。
2009年,Dai等[14]首次实现了利用SWNTs对动物全身成像,他们在单壁碳纳米管表面修饰一层磷脂-聚乙二醇(PL-PEG)分子,制备出一种新型的PL-PEG功能化的SWNTs(Exchange-SWNTs)(图2)。 磷脂与纳米管表面通过疏水相互作用结合,而PEG链则可以提高SWNTs的水溶性和生物相容性。 研究证明,Exchange-SWNTs可以在血清中可长期稳定存在且具有良好的生物相容性。 小鼠活体成像结果表明Exchange-SWNTs具有较强的NIR-Ⅱ区光致发光信号(红色),并且显示出良好的组织渗透能力,在皮肤下的血管系统中也显示出清晰的图像。 2011年,Dai等[15]在上述实验的基础上,又进一步研究了Exchange-SWNTs应用于深层组织解剖成像的可能性。 实验结果表明,不需要过高的激发,Exchange-SWNTs就可以实现在小鼠体内深层组织成像,证实尾静脉注射的SWNTs的循环路径是从肺部到肾脏,然后是网状内皮系统(Reticuloendothelial system)的器官循环,最后在肝脏和脾脏中显示出荧光,并通过主成分分析(Principal component analysis,PCA)可以观测到胰腺,由于胰腺被埋在肝脏和脾脏下方,这在原始的时间图像中是无法观察到的。
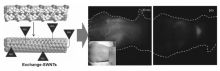 | 图2 Exchange-SWNTs制备示意图及其在小鼠成像中的应用[14]Fig.2 The schematic of the Exchange-SWNTssynthesis and its bioimaging in mice[14] |
实现脑部成像对于研究包括神经退行性疾病在内的多种疾病具有重要的意义,迄今为止,脑成像在很大程度上依赖于X射线计算机断层扫描和磁共振血管造影术[16,17,18],但其空间分辨率和扫描时间都很有限[19,20,21]。 由于分辨率高、操作简便且可实现实时成像,荧光技术在脑成像中极具潜力,但是在可见光和传统的近红外区域(400900 nm)中,由于光线散射,穿透深度限制在12 mm[22],需要开颅技术[23,24,25]。 为解决这一难题,Hong等[7]利用SWNTs构建发射波长在近红外二区窗口(NIR-Ⅱa)的成像系统SWNT-IRDye800,并报告了一种无需开颅即可透过头皮和颅骨的小鼠脑部荧光成像技术。 通过尾静脉注射入小鼠体内,用808 nm的激光激发,然后分别在NIR-I (<900 nm),NIR-Ⅱ (1.01.7 μm)和NIR-Ⅱa(1.31.4 μm)区域对小鼠脑部进行成像。 对比结果表明,NIR-Ⅱa区发现了最尖锐和最清晰的脑血管图像,而在NIR-I区中血管成像较为模糊,进一步证实了长波长发射光在脑部成像中的优势。 由于单碳纳米管的横向方向上的量子约束,单壁碳纳米管的NIR-Ⅱ发射波长主要依赖于纳米管的直径和手性角,在此基础上,Shuo等[26]通过采用激光汽化法和化学富集合成了一种荧光亮度增强的半导体型SWNTs,其半径在0.961.24 nm之间。 该体系在808 nm激发下,在波长可达到15001700 nm的NIR-Ⅱb窗口。 实验结果表明,该体系可实现3mm×3 mm宽度和深度下的毛细血管成像。 借助于EPR效应,即实体瘤的高通透性和滞留效应(Enhanced permeability and retention effect,指的是,相对于正常组织,某些尺寸的分子或颗粒更趋向于聚集在肿瘤组织的性质),SWNTs可以大量聚集在肿瘤细胞内实现肿瘤组织的活体成像。
目前,NIR-Ⅱ半导体量子点主要是基于Ⅱ~Ⅵ(CdTe/HgTe)[27,28,29],Ⅲ~Ⅴ(InP/InAs/GaAs)[30,31,32]和Ⅳ~Ⅵ(PbS/PbSe)[33]族元素构建,长期以来,由于其含有的有毒离子,如Cd2+、Hg2+、Pb2+和As3+等,严重限制了它们在生物领域的应用[34]。 为了克服这一难题,研究者常引入ZnS涂层来制备核/壳纳米结构,一方面提高了QDs的生物相容性,另一方面减少了表面的缺陷,提高发光度[35]。 研究表明,在紫外线或可见光的激发下,半导体量子点的荧光发射波长与粒子大小相关,较大的粒子具有较长的波长发射。 此外,通过采用Ⅰ~Ⅵ族元素(Ag2S、Ag2Se和Ag2Te)制备QDs,可赋予其良好的生物相容性和出色的光学特性,如第二红外发光、高量子产量和高光稳定性[36,37,38,39,40]。 例如,Dai等[41]通过配体交换的方法制备了亲水性的Ag2S QDs并利用其作为NIR-Ⅱ探针进行细胞成像,与之前报道过的文献相比[40,42],Ag2S QDs仅仅使用了十二烷基硫醇(DT)作为共价配体和溶剂,获得了最明亮的光致发光。 细胞毒性实验进一步证明Ag2S QDs在细胞增殖、凋亡、坏死以及DNA损伤方面几乎没有影响。 通过在Ag2S QDs表面修饰聚乙二醇(PEG)分子,他们进一步进行活体荧光成像[43]。 经反应得6PEG-Ag2SQDs,其量子产率大约为15.5%,通过在NIR-Ⅱ区域连续收集荧光图像,可以明显地观察到QDs在小鼠体内的循环变化(图3)。 除通过引入核壳结构来提高QDs的发光度外,研究者也可利用在QDs表面包覆致密聚合物来提高其生物相容性和光学稳定性,例如,Dong等[44]通过表面十八烯(C18)和PEG修饰后制备得到聚马来酸酐-alt-1-十八烯-聚乙二醇-Ag2Se(C18-PMH-PEG-Ag2Se)量子点成像体系。 研究证实,该QDs具有良好的水溶性、高胶体稳定性和光稳定性,以及良好的生物相容性。 与吲哚菁绿(ICG)相比,C18-PMH-PEG-Ag2SeQDs对器官和血管可以进行高分辨率的成像。
 | 图3 (a)C18-PMH-PEG-Ag2Se量子点结构示意图;(bh)C18-PMH-PEG-Ag2Se量子点在不同时间间隔(注射6PEG-Ag2S QDs前后)的动态对比增强图像;(i)基于连续NIR-Ⅱ荧光图像的PCA重叠图像[43]Fig.3 (a)The structure of C18-PMH-PEG-Ag2Se and (bh)dynamic contrast-enhanced images of 4T1 tumor-bearing mouse at different time intervals(before and after rejection of 6PEG-Ag2S QDs) based on principalcomponent analysis(PCA); (i)A PCA-overlaid image based on the continuous NIR-Ⅱ fluorescence images[43] |
为了实现提高活体组织对QDs的摄取效率,Chen等[45]将Ag2S QDs与细胞穿膜肽(Tatpeptide)结合制备出对人间充质干细胞(hMSCs)靶向识别的Tat-Ag2S QDs,研究表明,Ag2S QDs的荧光量子产率为15.5%,灵敏度和时空分辨率高,化学稳定性好,耐光性好且细胞毒性低,具有在活体细胞中追踪干细胞的潜力。 借助Tat-Ag2S QDs,可以很清楚地观察到小鼠体内hMSCs的全身移动情况。 在急性肝衰竭的小鼠体内,将被Tat-Ag2S QDs标记的hMSCs经尾部静脉注射后,不需要进行剖腹,就可以在肺和肝脏中明显观察到明亮的NIR-Ⅱ区荧光,在14 d的长期监测中可以清楚地观察Ag2S示踪的hMSCs转移情况。
研究[46]表明,稀土纳米材料也可以在低功率且连续的波源激发下,在NIR第一组织透明的窗口内,产生短波红外光(Short-wavelength infrared light,SWIR,10002300 nm)发射且伴随较大的斯托克斯位移变化,其中,NIR-Ⅱ区发射波长取决于其纳米晶体中的镧系离子。 通常情况下,利用稀土纳米材料进行生物医学成像时,研究人员并没有注意到SWIR辐射。 近来,Naczynski等[47]首次评估了稀土材料在活体SWIR成像中应用的可能,并利用多光谱SWIR成像平台研究稀土材料在疾病中检测。 如图4所示,该成像体系由未掺杂稀土的NaYF4外壳包围着稀土掺杂的NaYF4核心组成的核壳结构,透射电子显微镜(TEM)结果证实该纳米体系具有均匀的球形形态和狭窄的粒径分布(~10 nm),具有良好的生物相容性,细胞毒性低。 借助于多光谱SWIR成像平台证实了该体系响应速度快,可用于实时成像,且具有较好的疾病跟踪和实时多光谱SWIR成像的潜力。 通过静脉注射入黑色素瘤小鼠模型中,1 min内即可在小鼠器官内观察到NIR-Ⅱ区成像。 研究结果证明了SWIR成像在动物模型中可用于识别病变组织,同时为开发利用稀土纳米材料作为探针,并应用于生物医学平台成像技术,为实时纳米材料跟踪、深层组织成像和癌症病灶检测和监测,提供了一种新思路。
目前,共轭聚合物(Conjugated polymers)在有机太阳能电池[48,49]、发光二极管[50,51]和有机电子学[52,53]等领域中均得到了广泛应用。 然而,由于激发和发射波长的限制(<900 nm),该类聚合物在荧光成像上的应用并不多见。 利用聚合物的多样性,开发发射波长在NIR-Ⅱ区的聚合物型染料,并应用于体外和体内的生物成像显得非常有意义。
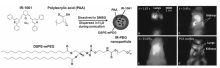
研究者通过在共轭聚合物主链上引入供-吸电子体系,增加聚合物共轭程度,可以使其荧光发射波长红移至NIR-Ⅱ区。 例如,Hong等[54]利用呋喃和噻吩为基本单元构建共轭聚合物(pDA),由于供电子的结构单元M1与吸电子结构单元M2通过共聚作用结合起来,显示出较强的荧光性(图5)。 该共聚物的荧光发射大约在1050 nm处,具有较大的斯托克斯位移(~400 nm),并且荧光量子产率约为1.7%,远高于常见的碳纳米管的量子产率(~0.4%)。 将其与二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-mPEG)混合形成脂质体胶束pDA-PEG。 利用pDA-PEG可以对小鼠的下肢动脉血流进行实时、快速的追踪成像,这是首次使用NIR-Ⅱ型荧光剂在毫秒尺度上直接跟踪、测量体内血液流速,现实了小鼠的单个心跳周期内快速血流变化的成像。
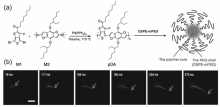 | 图5 (a)合成pDA聚合物的方法;(b)利用pDA-PEG对小鼠动脉血流的超快NIR-Ⅱ成像[54]Fig.5 (a)Scheme for the synthesis of pDA Polymer; (b)A time course of NIR-Ⅱ fluorescence images of a mouse hindlimb immediately following intravenous injection of pDA-PEG, showing the blood flow front moving inside the femoral artery(indicated by red arrows)[54] |
另一方面,通过适当的结构设计来增加共轭聚合物的π-共轭长度可以减少能隙,从而使染料红移达到NIR-Ⅱ区。 例如,我们课题组[55]基于吡咯并吡咯二酮(DPP)结构设计了一种NIR-Ⅱ区新型半导体聚合物PDFT1032(图6),并探究了该聚合物形成纳米颗粒作为荧光探针并应用于生物成像的可能性。 DPP作为一个平面电子受体,可以很容易地与不同的电子供体结合来修改带隙并实现预期的光学特性,利用电子供体基团对DPP衍生物进行修饰,实现了波长红移到NIR-Ⅱ区。 测试结果表明,PDFT1032突破了原有DPP型纳米颗粒的发射波长均小于900 nm的限制,其发射波长可达到1032 nm。 此外,PDFT1032还具有各种优良的性能,包括高光稳定性、高吸收率以及良好的生物相容性等。 借助生物活体成像技术,成功将该探针应用到肿瘤诊断和前哨淋巴结活体检验中,从而使PDFT1032成为一种极具前景的荧光造影剂,具有广泛的临床应用潜力。
 | 图6 (a)PDFT1032纳米粒子示意图;(b)PDFT1032的吸收光谱和荧光光谱[55]Fig.6 (a)Schematic drawing of a PDFT1032 nanoparticle; (b)Absorbance and fluorescencespectra of PDFT1032[55] |
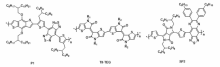
目前,值得一提的是越来越多的研究组将目光聚焦在利用基于聚合物的NIR-Ⅱ区染料进行光声成像(Photoacoustic Imaging,PAI)。 PAI是近年来发展起来的一种非入侵式和非电离式的新型生物医学成像方法,其结合了光学组织成像中高选择性和深穿透特性的优点,可得到高分辨率和高对比度的组织图像,实现深层活体内组织成像[56]。 NIR-Ⅱ区共轭聚合物作为PA造影剂具有如下3个优点:1)有更大的消光系数;2)可以调整吸收波长和激子能量耗散途径;3)可以对聚合物纳米粒子进行表面功能化,以进一步实现特异性结合[57]。 目前,已有多种NIR-Ⅱ区聚合物被报道可进行PA成像(图7)。 例如,Guo等[57]合成了D-A型共轭聚合物P1,该聚合物与DSPE-mPEG形成脂质体纳米粒子,在1064 nm激发下具有更好的PA成像效果,是目前报道的利用NIR-Ⅱ区共轭聚合物作为PA成像,无需开颅即可原位对脑肿瘤进行检测。 Wu等[56]则利用噻吩异靛蓝衍生物合成一种新的半导体聚合物TⅡ-TEG,与DSPE-mPEG形成脂质体纳米粒子之后,可以在NIR-Ⅱ区采集到明显的PA信号。 实验结果表明,在1064 nm激发下,PA信号穿透鸡肉组织深度达到5.3 cm,并可以应用到肿瘤异体移植成像。 Jiang等[58]通过Stille聚合反应合成了新型聚合物SP2并利用共沉淀法与嵌段聚合物聚乙二醇- b-聚醚多元醇- b-聚乙二醇(PEG- b-PPG- b-PEG)形成纳米成像体系,这是首次被报道的可同时用于NIR-Ⅰ和NIR-Ⅱ窗口的PA显影剂。 体内成像结果表明,该体系可在3 cm的组织深度上进行PA成像,由于在NIR-Ⅱ窗口中生物组织背景信号的降低,在1064 nm激发下比750 nm激发下的信噪比高1.4倍。 在活体大鼠的脑血管中则进一步证实了体系可以运用于生物体内PA成像。
有机小分子具有明确的结构,可以根据物理和光学性能调节结构进行精细的光谱学性质设计和调整,在基于NIR-Ⅱ区的分子设计方面具有重要的优势。 此外,考虑到将NIR-Ⅱ区显象剂应用于临床,基于有机小分子的探针仍然是最理想的候选项,因为它们具有较高的生物相容性,快速的排泄能力,以及制备方法简单快捷。 因此,发展基于有机小分子的NIR-Ⅱ区染料,依然是目前生物成像和化学研究领域的一个研究热点[3]。
有机小分子结构设计主要是基于减少最低的未占据分子轨道(LUMO)和最高被占据分子轨道(HOMO)之间的能量差距,将荧光发射红移到较长的波长。 以S-D-A-D-S作为核心结构设计NIR-Ⅱ区有机分子染料也受到研究者广泛关注。 例如,Yang等[59]设计合成了一种基于S-D-A-D-S 结构的NIR-Ⅱ型分子荧光团IR-FE,如图8所示,IR-FE结构是以3,4-乙烯二氧噻吩(EDOT)为电子给体(D),苯并噻二唑为电子受体(A),烷基链取代芴为屏蔽基团(S)。 它在有机溶剂和水溶液中具有较好的荧光特性。 光谱学测试结果显示,IR-FE发射主峰在1047 nm,在二甲基亚砜(DMSO)中的激发量子产率(QY)为9.6%,在磷酸盐缓冲液(PBS)和胎牛血清中表现出光稳定性;在808 nm 激光连续2 h照射下,荧光信号只有微小衰退(小于15%)。 活体组织成像表明,在注射后2 h内,IR-FE即可被肿瘤细胞吸收,使肿瘤区别于背景,并在后续的36 h内肿瘤可以清楚地被识别出来,而最强烈的肿瘤荧光信号在12 h后可被观察到。 通过改变连接官能团结构,Zhu等[60]在以IR-FE为主题结构的小分子染料上修饰特定的蛋白质活抗体,实现了对特定细胞的靶向成像。
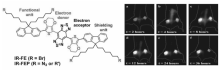 | 图8 IR-FE和IF-FEP的化学结构和肿瘤荧光信号[59]Fig.8 Chemical structures of IR-FE and IF-FEP and tumor fluorescent signal[59] |
另外一种NIR-Ⅱ小分子设计机理是基于D-A-D作为核心结构。 通过精确结构设计,Sun等[3]设计了一系列以D-A-D为核心结构的新型NIR-Ⅱ染料。 如图9所示,以D-A-D为框架是得到NIR-Ⅱ染料的关键[61],光谱学性能测试结果表明,由于噻吩和苯环的引入,染料分子Q4具有最优的NIR-Ⅱ性能,最大发射峰值在~1100 nm处。借助于脂质体DSPE-mPEG负载能力,Q4成功应用在小鼠活体组织的NIR-Ⅱ成像。 此外,通过修饰靶向多肽RM26,可以实现在PC3肿瘤组织的富集和成像,进一步拓展了有机小分子染料的应用范围。
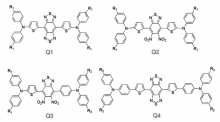 | 图9 基于D-A-D框架的NIR-Ⅱ染料Q1Q4的结构[3]Fig.9 The chemical structures of Q1Q4 NIR-Ⅱ dyes based on the D-A-D scaffold[3] |
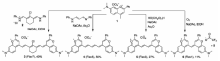
此外,Dai等[62]合成了基于D-A-D结构的有机分子CH1055,该分子以苯并双噻二唑(BBTD)作为电子受体(A)、三苯胺作为电子给体(D)组成D-A-D分子骨架,在侧链上引入羧基并与聚乙二醇(PEG)连接使其具有水溶性。 如图10a和10b所示,CH1055发射峰值在1055 nm,具有良好的生物相容性,可以经过肾排泄。 经过PEG修饰后,该荧光染料表现出良好的生理稳定性和较长的血液循环时间,活体组织成像效果明显。 另外,当CH1055染料与EGFR抗体结合时,该染料分子可以特异性地识别过度表达表皮生长因子受体(EGFR)的肿瘤细胞。 另外,我们课题组以CH1055为母体,通过牛磺酸和促卵泡激素(FSH)蛋白修饰,分别得到了CH-4T[63]和FSH-CH[64],并可以进行超快的体内成像(图10c)。 除此之外,Sun等[65]也基于CH1055设计了具有水溶性的探针68Ga-SCH2,68Ga的引入使探针不仅可以作为NIR-Ⅱ区成像剂,而且可以应用到小鼠模型的正电子发射型计算机断层显像(PET)。 将2-氨基-9,9-二烷基-取代的芴引入到CH1055结构中制备出荧光染料H1,通过扭曲苯并噻唑核心,并且有效地调节静电势的分布和带隙到一个理想的范围。 芴结构不仅作为电子给体,而且可以作为保护基团避免主链聚集。 通过对荧光染料H1改性,该研究组又合成了3种具有水溶性和生物相容性的探针,SXH、SDH和H1 NPs,均可以对体内肿瘤进行NIR-Ⅱ区成像[66]。 Zhang等[67]设计合成了NIR-Ⅱ区染料FD-1080,通过对花菁类结构的适当改性将其吸收和发射转移到NIR-Ⅱ区域,磺酸和环己烯基团的引入提高了水溶性和稳定性。 实验结果表明,FD-1080不仅能够对后肢血管系统和脑血管实现高分辨率的生物成像,而且还能根据对清醒和麻醉的老鼠的呼吸颅脑运动的动态成像来量化呼吸率。
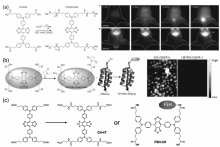 | 图10 (a)CH1055的化学结构和CH1055-PEG的一步合成; (b)CH1055-anti-EGFR亲和体的合成和癌细胞的分子成像[62]; (c)CH-4T与FSH-CH的合成[63,64]Fig.10 (a)The chemical structure of CH1055 and the one-step synthesis of CH1055-PEG; (b)A simplified reaction schematic illustrating the synthesis of the CH1055-affibody and molecular imaging of cancer cells[62]; (c)Synthesis of CH-4T and FSH-CH[63,64] |
聚甲炔类染料作为短波红外(SWIR)造影剂具有独特的优势,其吸收系数高,因此具有较大的量子效率。 此外,较小的斯托克斯位移为其SWIR激发和检测提供潜在的可能性。 Cosco等[68]通过花色素盐(1)[69]在酸性条件下与不同化合物合成聚甲炔染料36(图11),并探讨其光物理性质。 这一系列染料中,染料4(Flav5)和3(Flav7)的激发分别为908 nm(far-NIR)和1045 nm(SWIR)。 通过与SWIR染料IR-26、IR1061的对比,Flav7具有最高的荧光量子产率(0.53)。 借助DSPE-mPEG形成脂质体并将Flav7包裹在其内部,可以明显提高染料分子的稳定性和生物相容性,并在小鼠后肢的血管成像中显示出了优异的空间和时间分辨率,证实其具有较大的潜力可应用于临床。
研究表明,脂质体纳米粒子具有良好的生物相容性,可以包覆疏水小分子造影剂,提高分子造影剂的水溶性和生理稳定性。 例如,Shou等[70]将NIR-Ⅱ区疏水染料Q1封装于磷脂囊泡中形成纳米探针,发射峰值在1000 nm,可以对小鼠体内的血液循环系统进行成像,进而可运用于包括淋巴引流和路径选择、肿瘤血管生成、动脉血栓形成和缺血等血管畸形的成像中(图12)。
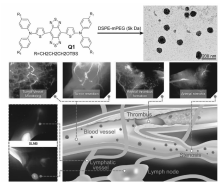 | 图12 NIR-Ⅱ分子造影剂Q1形成脂质体结构的TEM图及其在生物成像中的应用[70]Fig.12 The TEM image of NIR-Ⅱ dye Q1-based lipid nanoparticles and their schematic illustration of the biologicalapplication[70] |
如前所述,借助脂质体包裹形成纳米粒子可以有效解决有机小分子水溶性差、量子效率低等缺点,近来,随着纳米技术的不断发展,功能性纳米材料为提高生物成像的检测灵敏度和特异性提供了新的途径。 例如,Tao等[71]将NIR-Ⅱ疏水小分子造影剂IR-1061和聚丙烯酸(PAA)通过微乳液法制备出胶体纳米粒子,并在制备过程中加入DSPE-mPEG来提高胶体粒子的稳定性和生物相容性(图13)。 制备的IR-PEG纳米粒子在水溶液中NIR-Ⅱ区的量子产率约为1.8%,明显高于有机小分子本身的量子产率。 通过尾静脉注射入小鼠体内,在注射后大约4 s内,就可以观察到纳米颗粒在小鼠肺部和肾脏内的荧光,并通过血液流动经过这些器官(图13)。 由于脂质体纳米体系存在包封率低和稳定性差等缺点,采用生物相容性好的无机纳米粒子可以有效解决这些问题,例如,Xu等[72]将两种荧光染料分别装载到核壳硅纳米材料的疏水内部构建响应型纳米NIR-Ⅱ区体系。 其中一种染料是对H2S响应的NIR-Ⅱ区发射的ZX-NIR分子,另外一种aza-BODIPY染料对H2S不反应,作为内标分子。 实验表明,该体系可以实现在NIR-Ⅱ区选择性识别H2S丰富的直肠癌细胞和不同类型的活细胞分化过程。
与传统的近红外一区成像技术和其他的医学成像手段相比,近红外二区的生物成像技术不仅具有更深的成像深度,而且可以更好地避免组织自发荧光和光子散射等背景干扰。 到目前为止,多种多样的近红外二区染料,如无机纳米材料(单壁碳纳米管,半导体量子点,稀土纳米材料)、共轭聚合物和有机小分子材料,已被成功地合成和制备出来。 由于其特殊的性能,近红外二区染料除了作为生物医学造影剂外,还可以应用在光热和光动力治疗、药物输送和外科手术引导等领域。
随着分子设计理论和纳米材料的不断发展,越来越多的近红外二区成像体系将会被设计开发并推动在临床医学中的应用。 值得注意的是,目前大多数近红外二区荧光分子水溶性和生理稳定性较差,荧光量子产率较低,而对于聚合物和无机纳米体系而言,则存在代谢慢、毒性较大且缺少特定组织的靶向性等问题,借助新方法、新材料解决上述存在的问题将会有助于推动近红外二区成像技术在生物领域的中应用。 总体来说,近红外二区染料的开发设计要注意以下几点:1)对于有机近红外二区荧光染料,在选择合适的空间构型的基础上,要注意减少带隙,并且在修饰基团时考虑基团对于染料水溶性的影响,提高分子水溶性和生理稳定性;2)合理设计分子结构,特别是基于聚合物分子的染料和纳米粒子,设计合成可降解的近红外二区染料探针,提高探针的生物相容性和代谢能力;3)赋予染料特定功能,如将染料与靶向分子结合,提高染料在生物体内特定部位的聚集能力,推动临床中对于疾病靶向和早期诊断的发展。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|