利用254 nm紫外光对[2.2]对环蕃氯仿溶液进行辐照,得到两种主要产物4-醛基-[2.2]-对环蕃和4,4'-(乙基-1,2-二取代)二苯甲醛,利用核磁共振波谱仪(NMR)和气相色谱-质谱联用(GC-MS)技术手段对产物的结构进行分析研究。 同时对反应条件进行探究,发现当氯仿和水同时存在时才能生成醛基,并由此提出了提出了可能的反应机理:通过瑞默-提曼反应使CHCl2·自由基加成到苯环上并进一步生成醛基。
In this paper, the chloroform solution of [2.2]paracyclophane is irradiated under 254 nm ultraviolet light to yield two main products, i.e. 4-formyl[2.2]paracyclophane and 4,4'-(ethane-1,2-diyl)dibenzaldehyde. The structures of the products are characterized by nuclear magnetic resonance spectroscopy (NMR), gas chromatography-mass spectrometer (GC-MS). The reaction conditions are explored. The coexistence of chloroform and water is important to form the aldehyde products and a possible reaction mechanism that the CHCl2· radical is added to the benzene ring and further forms an aldehyde group by Reimer-Tiemann reaction is proposed.
环蕃拥有一对平行共轭的苯环,两个苯环的电子效应可以通过空间传递,因此环蕃具有独特的电子效应和化学性质[1,2,3],使得其在立体选择性合成、材料科学、基础有机以及超分子化学等方面有着特殊的应用前景。 而环蕃衍生物的主要用途就是作为不对称催化剂催化不对称合成反应[4],其衍生物主要包括苯环上的取代物和桥键上的取代物,主要的制备方法为步骤十分繁琐的化学合成法[5],如Reimer-Tiemann反应[6]、Gattermann-Koch反应、Vilsmeier反应、Friedel-Crafts反应、Duff反应等。 这些合成反应一方面过程复杂,另一方面条件较为苛刻,Reimer-Tiemann反应、Vilsmeier反应、Duff反应需要较为活泼的底物,如苯酚、苯胺等,Gattermann-Koch反应则需要高压反应。
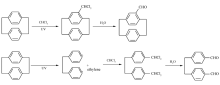
与繁琐的化学合成法相比,紫外辐照法具有步骤简单、成本低、产率较高等特点,值得我们对其进行深入的研究,从而了解环蕃在紫外辐照下的化学行为,并且可以利用辐照进行环蕃衍生物环蕃醛的合成。 目前,环蕃醛的主要用途有催化立体选择合成[7,8],以及作为重要的中间体合成其他的环蕃衍生物,如胺类、酚类衍生物等[9,10,11]。 本工作主要利用紫外光辐照[2.2]对环蕃的氯仿溶液,对辐照产物分析可以得知,产物主要为小分子的环蕃醛,包括4-醛基-[2.2]-对环蕃(1)和4,4'-(乙基-1,2-二取代)二苯甲醛(2)(Scheme 1)。
'> | Scheme 1 The ultraviolet radiation process for the synthesis of 4-formyl[2.2]paracyclophane(1) and 4,4'-(ethane-1,2-diyl)dibenzaldehyde(2) |
[2.2]对环蕃(pCp,98%)购于安耐吉公司(萨恩化学技术(上海)有限公司)。
AVANCE 400型核磁共振仪(NMR,瑞士布鲁克公司),TMS内标;质谱分析在Trace 2000型气质联用仪(GC-MS,美国ThermoQuest公司)内配置的质谱分析仪上进行,其中色谱条件为120 ℃保持1 min,10 ℃/min升至280 ℃,保持12 min;FL 2200型高效液相色谱(HPLC, 中国福立仪器公司),配备C18反相柱和300 nm紫外检测器,流动相为 V(乙腈): V(水)=40:60混合液,流速0.5 mL/min;ZW18Z18Y型高臭氧自镇流石英紫外线杀菌灯(杭州亚光照明灯饰有限公司),波长254 nm。
1.2.1 pCp的紫外辐照
在100 mL烧杯中加入含有0.5 g pCp的30 mL CHCl3,室温搅拌下用254 nm紫外光照射45 h,然后加入50 mL甲醇,沉淀出大部分未反应的原料pCp,滤液经液相色谱检查,主要含有原料pCp和另外两个环合物。 过滤除去沉淀,减压浓缩滤液,剩余物经柱层析分离(洗脱液: V(正己烷): V(乙酸乙酯)=10:1),先后得到31 mg化合物1(6%)和277 mg化合物2(55%)。 化合物1,1H NMR(400 MHz,CDCl3), δ:9.95(s,1H),7.02(d, J=1.9 Hz,1H),6.73(dd, J=7.8 Hz,1.9 Hz,1H),6.59(d, J=7.8 Hz,1H),6.56(dd, J=7.9 Hz,1.8 Hz,1H),6.50(dd, J=7.9 Hz,1.8 Hz,1H),6.43(dd, J=7.9 Hz,1.8 Hz,1H),6.37(dd, J=7.9 Hz,1.8 Hz,1H),4.10(ddd, J=11.8 Hz,9.6 Hz,1.5 Hz,1H),3.27(ddd, J=12.5 Hz,10.4 Hz,2.0 Hz,1H),3.21(dd, J=11.7 Hz,4.5 Hz,1H),3.18(dd, J=11.7 Hz,4.5 Hz,1H),3.142.97(m,3H),2.95(ddd, J=13.1 Hz,10.1 Hz,6.7 Hz,1H);13C NMR(400 MHz,CDCl3), δ:191.1,143.2,140.6,139.5,139.4,138.1,136.6,136.3,136.1,133.2,132.9,132.3,132.1,35.2,35.1,35.0,33.6;MS(EI) m/z:236.14。 化合物2,1H NMR(400 MHz,CDCl3), δ:9.99(—CHO),7.80,7.30(—C6H4—),3.06(—CH2—CH2);13C NMR(400 MHz,CDCl3), δ:191.8(—CHO),148.16,134.74,129.90,129.13(—C6H4—),37.42(—CH2—CH2—);MS (EI) m/z:238.09。
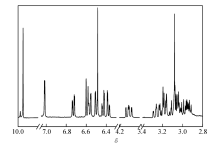
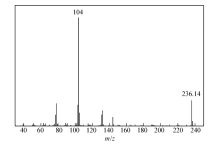
图1和图2分别为化合物1和化合物2的核磁共振氢谱。 从核磁共振氢谱可以看出,化合物1的氢谱信号十分复杂,而化合物2的核磁共振氢谱则非常简单;而且两种产物都在 δ 9.9处有强的醛质子信号。 这说明化合物1为不对称环结构,不对称环化合物的构象会被环锁定,难以通过旋转来使环上各个位置的质子处于相同的化学环境,从而使得谱图变得十分复杂;而化合物2为开环结构,核磁共振氢谱则相对简单,由于结构对称。 峰的数目大大减少。 化合物1的核磁与文献中化学合成法得到的环蕃醛核磁完全一致[12],这有力地证明了我们得到的产物为4-醛基-[2.2]-对环蕃。 而质谱分析结果表明,化合物1的相对分子质量为236.14,化合物1的质谱如图3所示,质谱结果进一步证明了化合物1就是4-醛基-[2.2]-对环蕃。
'>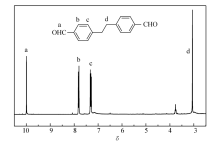 | 图2 4,4'-(乙基-1,2-二取代)二苯甲醛的氢谱Fig.2 1H NMR spectrum of 4,4'-(ethane-1,2-diyl)dibenzaldehyde |
化合物2的核磁共振氢谱(图2)显示苯环为对称结构,因此,化合物2的苯环为对称取代结构。图4为化合物2的质谱,化合物2相对分子质量为238.09,质谱分析表明化合物2为4,4'-(乙基-1,2-二取代)二苯甲醛。
'>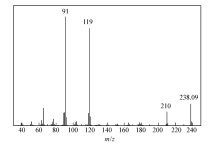 | 图4 (4,4'-(乙基-1,2-二取代)二苯甲醛)的质谱Fig.4 GC-MS of 4,4'-(ethane-1,2-diyl)dibenzaldehyde |
因此紫外辐照pCp氯仿溶液,主要反应过程如Scheme 1所示。 Scheme 1显示化合物1为单醛基取代环蕃结构,碳数目较环蕃增加1,而化合物2则由环蕃开环并生成对位取代双醛结构,碳数目较环蕃没有变化。 化合物1肯定由加成反应生成,而化合物2则有两种可能,环蕃桥键开环随后被氧化成醛,或者脱烯烃,然后与化合物1一样通过加成反应制得。
通过实验表明,紫外辐射制醛的反应与氯仿和水存在很大关联。 如图5所示,研究了不同条件下反应液的核磁共振氢谱,从核磁共振氢谱中可以很清楚的看出,在其它条件不变的情况下,只有水和氯仿同时存在,才会生成醛基(10附近)。
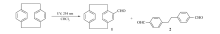
因此,我们想到瑞默-梯曼反应(RT)机理,RT反应是通过氯仿产生的·CHCl2自由基加成到苯环进行的,但是RT反应中苯环一般需要酚基活化[6]。 这里环蕃结构中苯环可能由于环蕃结构而活化。 我们推测化合物2也是由于氯仿自由基加成而成(Scheme 2),因为如果是被氧气氧化而成,那么氧化程度没有控制,应该有羧酸生成。
我们得到了一种较为简单、可控且成本低的环蕃醛合成法。 利用紫外辐照对[2.2]对环蕃进行照射,对得到的产物进行纯化分析后发现,得到的化合物基本上为环蕃的衍生物环蕃醛。 避开了传统的化学合成法,利用更加简单易行的紫外辐照法得到了具有重要应用的环蕃醛,且避免了醛基进一步反应生成羧酸,使得反应变得较为可控。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|