发展了一种高效、简便的潜在生物活性的含氰苯并呋喃-2-酮类化合物的合成新方法。 以廉价碘化亚酮为催化剂,锌粉为添加剂,催化对亚甲基苯醌与1,1-偶氮双(环己烷甲腈)和H2O三组分反应,经历1,6-共轭加成/芳构化,惰性碳-碳键断裂,以及后续的串联自由基插氰/环化及水解等步骤,“一锅法”快速合成了一系列含氰苯并呋喃酮结构的化合物。 为含氰苯并呋喃酮类化合物的合成提供一条简便而高效的途径,同时也为对亚甲基苯醌类化合物的高值化应用提供一个新的思路。
A new and efficient method for the synthesis of potentially biologically active cyano-containing benzofuran-2-one derivatives has been developed. In the presence of low-cost CuI and zinc powder, the three-component reactions of para-quinone methides with 1,1-azobis(cyclohexanecarbonitrile) and H2O proceed smoothly through radical cascades, including 1,6-conjugate addition/aromatization, inert C(aryl)—C( t-butyl) bond cleavage and downstream cyano-insertion/cyclization/hydrolysis, which leads to a series of cyano-containing benzofuran-2-ones. This method offers a simple and efficient way for the synthesis of cyano-containing benzofuranone derivatives, as well as a new idea for the high-value application of para-quinone methides.
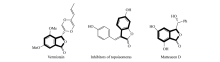
苯并呋喃酮是一类重要的活性分子构建骨架(Scheme 1)。 目前,基于苯并呋喃酮骨架设计合成的衍生物已经在医药[1,2]、农药[3,4]和材料[5]等领域得到了广泛的应用。 近年来,通过合适的芳环稠合形成内酯的方法引起了有机化学家的广泛关注[6,7,8]。 例如,Shi等[6]使用邻烯基苯酚底物作为原料,通过醋酸钯(Ⅱ)-三苯基膦(Pd(OAc)2/PPh3)催化加氢酯化得到一系列相应的苯并五元内酯。 2013年,Hashmi课题组[7]报道了以金催化剂介导炔基芳基醚内氧化环合,实现一系列苯并呋喃酮及其衍生物的合成。 然而,在这些合成实验中,大多存在实验操作复杂(需多步合成)、反应条件较严苛、使用较昂贵的稀有金属催化剂等不足之处。 因此发展使用廉价催化剂(如铜),通过步骤经济,原子经济型过程实现苯并呋喃酮结构的化合物合成仍然具有重要的理论和实际意义。 基于上述研究背景以及我们对廉价铜催化烯环合的研究兴趣[9,10],本课题组发展了一种以廉价碘化亚酮/锌粉为催化剂,催化对亚甲基苯醌、1,1-偶氮双(环己烷甲腈)和水三组分的反应,实现了一系列含氰苯并呋喃酮骨架构建的简单、快速的合成(Scheme 2)。
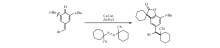 | Scheme 2 Synthesis of benzofuran-2(3 H)-ones using 1,1'-azobis(cyanocyclohexane) |
2,6-二叔丁基苯酚、二正丙胺、醋酸酐、碘化亚铜、锌粉、偶氮二异丁腈(AIBN)、2,2,6,6-四甲基哌啶-氮氧化物(TMEPO)和1,1-偶氮双(环己基甲腈)购自百灵威科技有限公司,其它试剂除标明外均为分析纯。 实验中所需的原料4-苯基亚甲基-2,6-二叔丁基-2,5-环己二烯-1-酮(1a-1i)参照相关文献[11]报道方法合成得到。
AVANCE 400(或500)MHz型核磁共振波谱仪(NMR,瑞士Bruker公司);GC-MS-QP2010型质谱仪(MS,日本岛津公司);XT5A型显微熔点仪(北京市科仪电光学仪器厂)。
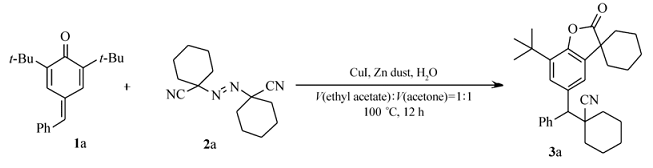
以产物3a合成为例,在反应管中依次加入4-苯基亚甲基-2,6-二叔丁基-2,5-环己二烯-1-酮(1a)(0.3 mmol)、1,1-偶氮双(环己烷甲腈)(2a)(1.5倍化学计量)、锌粉(1.2倍化学计量)、H2O(3倍化学计量)、CuI(摩尔分数20%)和 V(乙酸乙酯): V(丙酮)=1:1混合溶剂2 mL,在N2气氛围中于温度100 ℃的油浴中搅拌反应12 h,反应液经抽滤处理后,用柱层析法分离, V(环己烷): V(乙酸乙酯)=30:1的混合溶剂进行梯度洗脱,得产物3a,白色固体。
产物3a-3n经过了熔点测定、核磁共振氢谱和碳谱等表征,核磁共振表征谱图详见本文辅助材料。
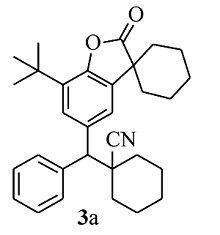
白色固体3a 产率74%;mp 72.5~73.3 ℃。1H NMR(400 MHz,CDCl3), δ:7.62(d, J=7.2 Hz,2H),7.55(d, J=1.6 Hz,1H),7.40~7.36(m, J=9.4,4.6 Hz,3H),7.30(d, J=7.2 Hz,1H),3.66(s,1H),2.03~1.83(m,7H),1.81~1.59(m,13H),1.41(s,9H);13C NMR(101 MHz,CDCl3), δ:179.7,149.3,140.1,135.2,134.3,133.8,128.8,127.3,126.7,123.3,121.4,61.5,45.4,42.7,36.2,35.9,34.4,34.1,34.1,29.6,25.1,24.9,22.8,20.8,20.7;HRMS m/z(ESI)计算值C31H37NO2[M+H]+:456.2897,实测值:456.2896。
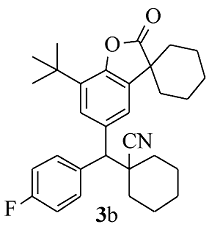
白色固体3b 产率68%;mp 98.0~99.2 ℃。1H NMR(400 MHz,CDCl3), δ:7.58(dd, J=8.6,5.4 Hz,2H),7.50(d, J=2.0 Hz,1H),7.33(d, J=1.6 Hz,1H),7.06(t, J=8.8 Hz,2H),3.67(s,1H),1.99~1.86(m,7H),1.79~1.60(m,13H),1.41(s,9H);13C NMR(101 MHz,CDCl3), δ:179.6,163.2(d, J=247.5 Hz),149.3,135.8,135.0,134.5,133.9,130.4(d, J=7.9 Hz),126.5,123.1,121.2,115.8(d, J=21.2 Hz),60.6,45.3,42.7,36.1,36.0,34.4,34.1,34.1,29.6,25.1,24.9,22.8,20.8,20.7;HRMS m/z(ESI)计算值C31H36FNO2[M+H]+:474.2803,实测值: 474.2806。
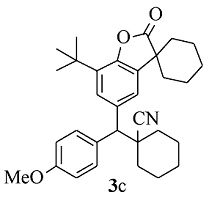
黄色固体3c 产率63%;mp 108.2~109.0 ℃。1H NMR(400 MHz,CDCl3), δ:7.54~7.52(m,3H),7.34(d, J=2.0 Hz,1H),6.91(d, J=8.8 Hz,2H),3.81(s,3H),3.62(s,1H),1.99~1.87(m,7H),1.79~1.63(m,13H),1.41(s,9H);13C NMR(101 MHz,CDCl3), δ:179.7,158.8,149.2,135.6,134.3,133.8,132.2,129.8,126.5,123.3,121.2,114.1,60.6,55.3,45.4,42.9,36.1,36.0,34.3,34.1,34.1,29.6,25.1,24.9,22.8,20.8,20.7;HRMS m/z(ESI)计算值C32H39NO3[M+H]+:486.3003,实测值:486.3006。
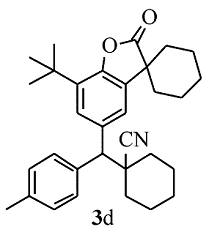
黄色固体3d 产率68%;mp 103.6~103.9 ℃。1H NMR (400 MHz,CDCl3), δ:7.55(d, J=1.6 Hz,1H),7.51(d, J=8.0 Hz,2H),7.36(d, J=2.0 Hz,1H),7.18(d, J=8.0 Hz,2H),3.63(s,1H),2.34(s,3H),1.99~1.84(m,7H),1.80~1.60(m,13H),1.41(s,9H);13C NMR(101 MHz,CDCl3), δ:179.8,149.2,137.1,137.0,135.5,134.3,133.7,129.5,128.7,126.6,123.3,121.3,61.2,60.4,45.4,42.7,36.2,36.0,34.3,34.1,34.1,29.6,25.1,24.9,22.8,21.0,20.8,20.7;HRMS m/z(ESI)计算值C32H39NO2[M+H]+:470.3054,实测值:470.3052。
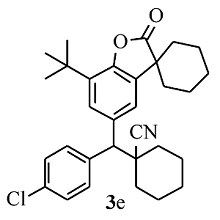
黄色固体3e 产率77%;mp 62.3~63.0 ℃。1H NMR(400 MHz,CDCl3), δ:7.55(d, J=8.4 Hz,2H),7.49(d, J=1.6 Hz,1H),7.35~7.32(m,3H),3.65(s,1H),1.99~1.86(m,7H),1.78~1.60(m,13H),1.40(s,9H);13C NMR(101 MHz,CDCl3), δ:179.6,149.4,138.6,134.7,134.5,134.0,133.3,130.1,129.0,126.5,123.0,121.2,65.9,60.7,45.3,42.6,36.1,35.9,34.4,34.1,34.1,29.6,25.1,24.9,22.7,20.8,20.7;HRMS m/z(ESI)计算值C31H36ClNO2[M+H]+:490.2507,实测值:490.2511。
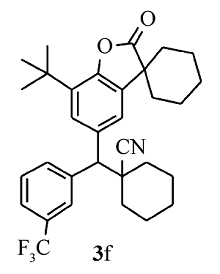
黄色固体3f 产率61% ;mp 101.5~102.9 ℃。1H NMR(400 MHz,CDCl3), δ:7.95(d, J=7.2 Hz,1H),7.77(s,1H),7.58~7.51(m,3H),7.36(d, J=2.0 Hz,1H),3.74(s,1H),2.01~1.85(m,7H),1.85~1.64(m,13H),1.41(s,9H);13C NMR(101 MHz,CDCl3), δ:179.5,149.6,141.1,134.6,134.2,134.1,131.7,131.2(d, J=32.3 Hz),129.4,126.6,126.1,125.3(d, J=273.5 Hz),124.3,122.8,121.3,61.2,45.4,42.7,36.1,35.9,34.4,34.1,34.0,29.6,25.0,24.9,22.7,20.7,20.6;HRMS m/z(ESI)计算值C32H36F3NO2[M+H]+:524.2771,实测值:524.2774。
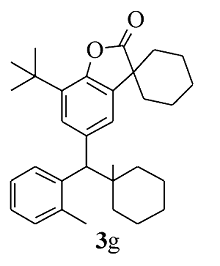
黄色固体3g 产率60%;mp 186.2~187.1 ℃。1H NMR(400 MHz,CDCl3), δ:8.20(d, J=8.0 Hz,1H),7.45(d, J=1.6 Hz,1H),7.35~7.30(m,2H),7.18~7.15(m,2H),3.98(s,1H),2.35(s,3H),2.00~1.82(m,7H),1.81~1.60(m,13H),1.40(s,9H);13C NMR(101 MHz,CDCl3), δ:179.8,149.2,138.6,136.3,134.2,134.0,133.4,131.1,127.3,126.9,126.7,126.7,123.5,122.1,55.4,45.3,42.7,36.9,35.0,34.3,34.2,33.9,29.6,25.2,24.9,22.9,22.6,20.7,20.6,20.5;HRMS m/z(ESI)计算值C32H39NO2[M+H]+:470.3054,实测值:470.3057。
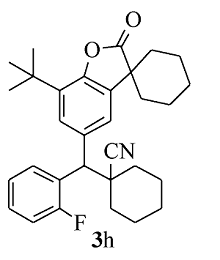
白色固体3h 产率51%;mp 161.4~162.3 ℃。1H NMR(400 MHz,CDCl3), δ:8.05(td, J=7.6,2.2 Hz,1H),7.53(d, J=1.6 Hz,1H),7.40(d, J=2.0 Hz,1H),7.27~7.21(m,2H),7.09~7.04(m,1H),4.24(s,1H),2.00~1.85(m,7H),1.81~1.63(m,13H),1.41(s,9H);13C NMR(101 MHz,CDCl3), δ:179.7,159.3(d, J=245.6 Hz),149.4,134.4,134.2,134.0,128.8,128.7,128.6,127.3(d, J=13.6 Hz),126.9,124.7,121.6,115.7(d, J=23.8 Hz),50.5,45.3,42.6,36.1,35.2,34.4,34.1,34.1,30.3,29.6,25.1,24.9,22.7,20.7,20.6;HRMS m/z(ESI)计算值C31H36FNO2[M+H]+:474.2803,实测值:474.2806。
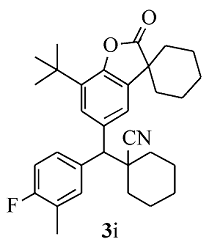
黄色固体3i 产率60%;mp 93.2~94.1 ℃。1H NMR(400 MHz,CDCl3), δ:7.52(d, J=1.6 Hz,1H),7.49~7.45(m,1H),7.36~7.33(m,2H),7.01 (t, J=9.0 Hz,1H),3.60(s,1H),2.29(d, J=1.6 Hz,3H),2.03~1.85(m,8H),1.83~1.70(m,12H),1.41(s,9H);13C NMR(101 MHz,CDCl3), δ:179.66,159.4(d, J=246.0 Hz),149.3,135.6,135.1,134.4,133.9,132.2,127.2,126.5,125.2(d, J=17.4 Hz),123.1,121.2,115.4(d, J=22.3 Hz),60.6,45.4,42.7,36.2,36.0,34.4,34.1,34.0,29.6,25.1,24.9,22.8,22.8,20.7,20.7;HRMS m/z(ESI)计算值C32H38FNO2[M+H]+:488.2959,实测值:488.2963。
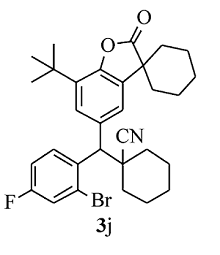
白色固体3j 产率58%;mp 148.8~150.0 ℃。1H NMR(400 MHz,CDCl3), δ:8.21(dd, J=8.8,6.0 Hz,1H),7.48(d, J=1.6 Hz,1H),7.40(d, J=1.6 Hz,1H),7.34 (dd, J=8.0,2.8 Hz,1H),7.19~7.14(m,1H),4.44(s,1H),2.02~1.84(m,7H),1.83~1.60(m,13H),1.40(s,9H);13C NMR(101 MHz,CDCl3), δ:179.6,159.8(d, J=252.4 Hz),149.4,135.5,134.4,133.9,133.5,129.4(d, J=8.3 Hz),127.0,126.0(d, J=9.1 Hz),123.2,121.6,120.7(d, J=24.1 Hz),115.5(d, J=20.9 Hz),56.8,45.3,42.8,36.4,34.9,34.4,34.1,34.0,29.6,25.0,24.9,22.7,22.6,20.8,20.6;HRMS m/z(ESI) 计算值C31H35BrFNO2[M+H]+:552.1908,实测值:552.1911。
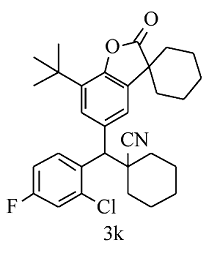
白色固体3k 产率52%; mp 173.4~174.1 ℃。1H NMR(400 MHz,CDCl3), δ:8.19 (dd, J=8.8,6.0 Hz,1H),7.46(d, J=1.6 Hz,1H),7.38(d, J=1.6 Hz,1H),7.17~7.09(m,2H),4.43(s,1H),1.99~1.89(m,7H),1.82~1.57(m,13H),1.40(s,9H);13C NMR(101 MHz,CDCl3), δ:179.5,159.9(d, J=251.3 Hz),149.4,135.3(d, J=9.9 Hz),134.4,134.0,133.9,133.6,129.5(d, J=8.6 Hz),126.9,123.2,121.6,117.4(d, J=24.5 Hz),115.0(d, J=21.0 Hz),54.1,45.3,42.7,36.3,34.9,34.4,34.1,34.0,29.6,25.0,24.9,22.7,22.6,20.7,20.6;HRMS m/z(ESI)计算值C31H35ClFNO2[M+H]+:508.2413,实测值:508.2416。
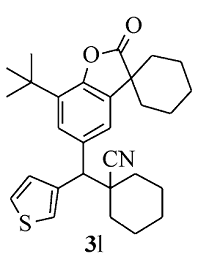
黄色固体3l 产率51%;mp 72.5~73.3 ℃。1H NMR(400 MHz,CDCl3),δ: 7.49(d, J=2.0 Hz,1H),7.42~7.41(m,1H),7.40~7.38(m,1H),7.36~7.34(m,1H),7.32(d, J=2.0 Hz,1H),3.86(s,1H),1.97~1.87(m,6H),1.83~1.61(m,14H),1.41(s,9H);13C NMR(101 MHz,CDCl3),δ: 179.7,149.3,140.3,134.7,134.3,133.7,127.9,126.6,126.1,123.2,122.5,121.5,56.6,45.4,43.4,35.9,35.8,34.3,34.1,34.0,29.6,25.1,24.9,22.9,22.9,20.8,20.7; HRMS m/z(ESI) 计算值C29H35NO2S [M+H]+:462.2461,实测值: 462.2463。
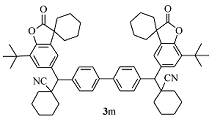
微黄色固体3m 产率50%;mp 197.9~199.2 ℃。1H NMR(400 MHz,CDCl3), δ: 7.68(d, J=8.4 Hz,4H),7.58(d, J=8.4 Hz,6H),7.38(d, J=2.0Hz,2H),3.70(s,2H),1.98~1.87(m,14H),1.80~1.60(m,26H),1.41(s,18H);13C NMR(101 MHz,CDCl3), δ: 179.7,149.4,139.4,139.2,135.0,134.4,133.9,129.3,127.3,126.7,123.2,121.3,61.2,45.4,42.7,36.2,36.0,34.4,34.1,34.1,29.6,25.1,24.9,22.8,20.8,20.7,20.7; HRMS m/z(ESI) 计算值C62H72N2O4 [M+H]+:909.5565,实测值: 909.5568。
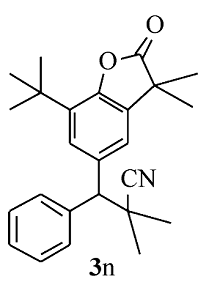
白色固体3n 产率75%;mp 149.3~150.1 ℃。1H NMR(400 MHz,CDCl3), δ:7.60(d, J=7.2 Hz,2H),7.43(s,1H),7.40~7.36(m,2H),7.32~7.30(m,2H),3.64(s,1H),1.51(s,3H),1.49(s,3H),1.42(s,9H),1.39(s,6H);13C NMR(101 MHz,CDCl3), δ:181.1,149.2,140.3,136.2,134.5,134.3,128.9,128.6,127.4,126.5,124.8,120.3,61.3,42.4,36.4,34.4,29.6,27.8,27.5,25.4,25.4; HRMS m/z(ESI)计算值C25H30NO2 [M+H]+:376.2271,实测值: 376.2274。
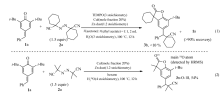
以4-苯基亚甲基-2,6-二叔丁基-2,5-环己二烯-1-酮(1a)与1,1-偶氮双(环己烷甲腈)(2a)的反应为模板反应来探索最佳反应条件(表1)。 使用Cu(0)、Cu(Ⅰ)、Cu(Ⅱ)3种不同价态的铜盐作为催化剂,均得到了良好的产率 (Entry 3-5)。 另外,我们还尝试了铁催化剂,但得到的结果(Entry 6)不够令人满意。 进一步进行条件摸索,发现锌粉的使用是非常重要的,我们推测它可能促进叔丁基的脱去(其与水在高温条件反应形成亲核性氢氧化物,从而有助于与脱下叔丁基正离子结合),并且有利于抑制一些难以辨别的自由基副反应(Entry 7)。 溶剂对反应有较大的影响,以纯丙酮作为溶剂目标产物3a的产率为60%,以乙酸乙酯作为溶剂时产率为67%,而当以 V(乙酸乙酯): V(丙酮)=1:1的混合溶剂作为溶剂时目标产物3a的产率提高到74%(Entries 8-9)。 进一步调节两种溶剂的体积比(如, V(乙酸乙酯): V(丙酮)=2:1)反应产率未出现太大的变化(Entry 10)。 此外,分别降低偶氮试剂、铜催化剂、H2O以及锌粉的用量,均在一定程度上对反应产率造成影响(Entries 11-14)。 此外,使用稀氨水代替锌粉没有取得预想的结果,只得到27%产率(Entry 15)。 值得注意的是,将反应时的空气氛围替换为N2氛围得到了相似的产率(Entry 16)。 然而,如果反应处于纯O2的反应环境中,化合物3a的产率降低至45%(Entry 17)。 我们推测,过多氧气存在高温时可能破坏铜催化循环,另一方面氧气也可能作为自由基清除剂而影响此自由基反应历程。 此外,反应降低温度至80 ℃,产率有所降低(Entry 18),或者进一步升高反应温度,反应产率未出现明显的提高。
| 表1 优化反应条件摸索 Table 1 Screening for optimal reaction conditions a |
综上所述,最佳反应条件为:1a(0.3 mmol),2a(1.5倍化学计量),锌粉 (1.2倍化学计量),H2O(3倍化学计量),CuI(摩尔分数20%)为催化剂,2 mL的 V(乙酸乙酯): V(丙酮)=1:1的混合溶剂为溶剂,温度为100 ℃,空气环境中反应12 h。
得到最佳反应条件后,接着考察了反应底物的适用范围(Scheme 2)。 初步筛选表明:底物对亚甲基苯醌结构中的芳基取代基,例如,芳环上被4-Me、4-MeO、4-F、4-Cl、3-CF3、2-Me、2-F等取代的对亚甲基苯醌化合物与优化反应条件是兼容的,且以较好的产率得到相应的苯并呋喃铜3a-3k。 接下来,还考察了结构中带有杂环的对亚甲基苯醌与优化反应条件的兼容性,结果表明这些杂环(如噻吩)对该条件均表现较好的兼容性,以51%的产率得到产物3l。 但用甲基或异丙基替代上述对亚甲基苯醌结构中的叔丁基( t-Bu),反应通常不能得到目标产物苯并呋喃-2-酮,而经过了1,6-共轭加成/芳构化生成相应的取代酚。 此外,含有双重对亚甲基苯醌结构的化合物也是可行的底物,形成在结构上具有在金属催化反应中广泛使用的pincer-配体特征的含氰苯并呋喃-2-酮骨架(3m)。 还考察了其它烷基偶氮试剂在反应中的活性,当使用AIBN作为自由基前体时,反应仍然保持较高的活性,以75%的产率得到产物3n。
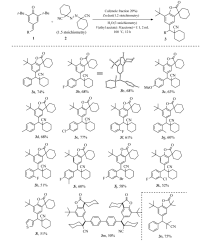 | Scheme 2 Scope of p-QMs and azo compounds in the cyclization reactions |
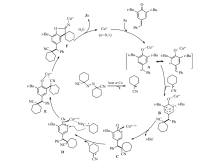
为了探测反应机理,设计了如Scheme 3(1)所示的控制试验。 结果显示加入过量自由基清除剂TMEPO时,环化过程被严重抑制,此现象表明该反应是经历了一个自由基介导的过程(eq.1)。 此外,还进行了如Scheme 3(2)所示的18O原子追踪实验(具体实验方法和结果详见本文辅助材料),实验结果表明新形成的羰基的氧原子应该来自H2O(eq.2)。
基于上述实验结果和相关的文献报道[12,13],提出以下可能的反应机理过程,如Scheme 4所示:首先,1,1-偶氮双(环己烷甲腈)在加热或者铜的催化下分解产生环己烷甲腈自由基,接着Cun+与对亚甲基苯醌的共振异构体(两性离子对)配合,得到的中间体A与环己烷甲腈自由基经过1,6-共轭加成生成自由基阳离子B。 可能通过反应过程中产生的亲核试剂(如锌粉与水反应形成的氢氧化物,氰基水解生成的氨)的协助,然后经历一个逆Friedel-Crafts过程脱去叔丁基正离子,得到allyl-type的Cu配合物C。 接着,环己烷甲腈自由基与中间体C形成结合,形成具有铜桥联特征的中间体D。 可能由于铜桥联的导向和促进作用,复合物D中的环己烷甲腈基团与相邻的allyl-type Cu单元发生自由基交叉偶联,经历一个Cu( n+1)+/Cu n+的单电子转移还原形成中间体E。 最后,通过后续的自由氰基插入反应、环化和水解等串联反应,最后得到产物3a和参与下一步催化循环的Cu n+。
本文通过铜催化的对醌甲基化合物、1,1-偶氮双(环己烷甲腈)、水三组分串联环化反应,实现苯并呋喃-2(3 H)-酮骨架化合物的高效构建。 反应中使用廉价易得的偶氮试剂作为自由基源,廉价铜作为催化剂,水作为碳基氧源,三组分“一锅法“合成目标产物。 本方法为对醌甲基化物的转化合成及应用提供了新的方法,更具有意义的是为含氰基苯并呋喃-2(3 H)-酮骨架化合物的合成探索了一条高效、温和、环境友好的新途径。
辅助材料(Supporting Information)[产物3a-3n的核磁共振氢谱和碳谱图、3b的X射线谱图和利用已知方法使用
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|