GUO Yijiang, CHEN Qingde, SHEN Xinghai. Syntheses and Properties of Novel Boron-Containing Ionic Liquids 1-Alkyl-3-methylimidazolium Benzyoltrifluoroborates[J]. Chinese Journal of Applied Chemistry, 36(10): 1186-1193

合成了新型离子液体1-烷基-3-甲基咪唑苯甲酰基三氟硼酸盐[C nmim][BTB]( n=4,6,8),并通过NMR、差热、热重等方法研究了其基础物化性质。 结果发现,3种离子液体的分解温度在200 ℃左右;随着阳离子碳链的增长,离子液体的粘度、熔点逐渐升高,并从亲水性变为疏水性。 尤其是疏水性的[C6mim][BTB]和[C8mim][BTB]在与水长时间的混合中表现出较好的稳定性,基本解决了四氟硼酸盐离子液体亲水性强、BF−4易水解的缺点,有望用于乏燃料后处理并提高临界安全。
Three novel boron-containing ionic liquids(ILs), 1-alkyl-3-methylimidazolium benzyoltrifluoroborates([C nmim][BTB], n=4, 6, 8), were successfully synthesized and some of their physico-chemical properties were characterized by nuclear magnetic resonance(NMR), differential scanning calorimeter(DSC), and thermogravimetric analysis(TGA). It was found that their decomposition temperatures were around 200 ℃. With the increase of the length of carbon chain on the imidazolium ring, the melting temperature, viscosity and hydrophobicity gradually increased. [C4mim][BTB] was hydrophilic, while [C6mim][BTB] and [C8mim][BTB] were hydrophobic. In particular, the later two were more stable when they mixed with water for a long time. In other words, the shortcoming of tetrafluoroborate ILs( i.e., strong hydrophilicity, especially the easy hydrolysis of BF−4) was overcome to great extent. Thus, it is hopeful for the two ILs to be used in the field of spent fuel reprocessing, which will effectively impove the critical safety.
离子液体是一类熔点低于100 ℃的新型有机盐。相对于传统有机溶剂,其具有诸多优点[1]:1)化学稳定性和热稳定性较高,不可燃;2)蒸气压低;3)电化学窗口宽,电导率高;4)溶解能力强,对于很多有机物、无机物具有很好的溶解能力;5)可改变阴、阳离子组成来调节其理化性质。 由于自身独特的优点,其在电化学、有机合成、液液萃取、催化和纳米材料等方面得到了广泛研究[2,3]。
Harmon等[4]曾通过蒙特卡洛核粒子运输程序计算得到了Pu在H2O、1-乙基-3-甲基咪唑氯铝酸盐([C2mim][AlCl4])和1-乙基-3-甲基咪唑四氟硼酸盐([C2mim][BF4])中的最小临界浓度分别为8、150和1000 g/L,说明[C2mim][BF4]的使用可以大大提高临界安全。 但四氟硼酸盐类离子液体普遍存在的亲水性强、B
2007年,Nozaki等[19]首次公开了一种新型酰基三氟硼酸钾盐的合成。 随后,多个课题组[20,21,22,23,24,25,26]对该类化合物的合成方法进行了优化。 值得注意的是,此类化合物的稳定性得到Molander等[20]的肯定。 但到目前为止,尚未见其用于离子液体合成的报道。 为了解决四氟硼酸类离子液体的上述缺点,我们尝试合成一系列以苯甲酰基三氟硼酸根(BTB-)为阴离子的新型离子液体,并对其稳定性等物化性质进行研究。
二异丙胺(北京化玻站生物分析技术有限公司);正丁基锂(2.5 mol/L己烷溶液)、硼酸三乙酯、碘乙烷购自苏州星科元信息科技有限公司;丙酮、氢氟酸(质量分数40 %的水溶液)、 N, N-二甲基硫代甲酰胺购自北京翰隆达科技发展有限公司;氟化钾、碳酸钾购自北京百灵威科技有限公司。 碘苯购自北京百捷生物科技有限公司;四氢呋喃(超干溶剂)购自艾览化工科技公司;以上均为分析纯试剂。 1-烷基-3-甲基咪唑溴盐([C nmim]Br( n=4,6,8))购自中国科学院兰州化学物理研究所,纯度高于99%。
采用Bruker-500 MHz型核磁共振仪(NMR,瑞士 Bruker公司)采集离子液体的1H NMR、19F NMR和13C NMR谱图。 采用Vario EL型元素分析仪(德国Elementar Analysensysteme Gmhb.公司)进行元素分析。 离子液体中的水含量通过DL31型卡尔费休水份滴定仪(瑞士METTLER TOLEDO公司)进行测定。 经检测,各离子液体的水含量均低于300 mg/L。 离子液体的粘度在DV3T型粘度计(美国BROOKFIELD公司)上测定,测量的温度范围为25~75 ℃。 离子液体的分解温度通过Q600 SDT型热重-差热同步测定仪(TG-DSC,美国TA公司)在N2气气氛下测定,升温速率为10 ℃/min,测量的温度范围为25~600 ℃。 离子液体的熔点通过Q100型差示扫描量热仪(DSC,美国TA公司)在N2气气氛下测定,升温速率为10 ℃/min,测量的温度范围为-80~40 ℃。 水溶液中B元素的浓度采用Prodigy全谱直读电感耦合等离子体-原子发射光谱仪(ICP-AES,美国Leeman公司)测量。
采用文献[25]所述方法合成:干燥N2气气氛下,将10.2 g(0.1 mol)的 N, N-二异丙胺溶于200 mL四氢呋喃中,用干冰-丙酮浴将其冷却至-78 ℃,搅拌15 min,加入40.4 mL 2.5 mol/L正丁基锂的己烷溶液并搅拌10 min。 在干冰-丙酮浴中加入适量液氮使丙酮凝固以控制温度在-110 ℃左右,搅拌15 min。 加入14.7 g(0.1 mol)硼酸乙酯并反应15 min后,逐滴加入9.01 g(0.1 mol) N, N-二甲基硫代甲酰胺。 待丙酮完全融化后,继续反应1 h。 随后移出干冰-丙酮浴,继续反应25 min。 再次用干冰-丙酮浴降温至-78 ℃,加入26.4 mL 质量分数40%的氢氟酸水溶液,反应2 h。 升温至0 ℃,加入62.8 g(0.45 mol)碳酸钾固体,剧烈搅拌10 min。 随后,加入100 mL二氯甲烷,充分搅拌,过滤。 将滤饼在真空60 ℃真空干燥12 h,得 N, N-二甲基硫代氨基甲酰基三氟硼酸钾(产物Ⅰ)。
将产物Ⅰ溶于300 mL丙酮中,加入18.81 g(0.12 mol)碘乙烷,室温下反应19 h。 旋蒸除去溶剂,得(乙硫基)( N, N-二甲亚铵基)甲基三氟硼酸盐(产物Ⅱ)的粗产品。 将其用二氯甲烷多次提取,合并提取液,旋蒸除去溶剂,在60 ℃条件下真空干燥24 h, 得产物Ⅱ。
在干燥N2气气氛下,将0.2 g(1.08 mmol)产物Ⅱ和0.22 g(1.08 mmol)碘苯溶于2 mL四氢呋喃中,用干冰-丙酮浴冷却至-78 ℃。 逐滴加入0.432 mL 2.5 mol/L正丁基锂的己烷溶液。 1 h后,加入0.08 mL(1.08 mmol)丙酮终止反应。 10 min后,加入0.5 mL 6.5 mol/L KF溶液,移出干冰-丙酮浴,继续搅拌1 h。 然后,加入2 mL二氯甲烷搅拌,过滤。 用二氯甲烷多次洗涤固体产物,弃去洗涤液。 残余固体用丙酮多次提取,合并提取液,旋蒸除去溶剂后得到K[BTB],产率37%。
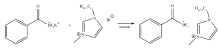
[C4mim][BTB]的合成路线如图1所示,具体如下:将等物质量的K[BTB]与[C4mim]Br溶于适量丙酮中,在室温下反应12 h。 旋蒸除去溶剂后加入适量二氯甲烷和水,振荡后分相。 旋蒸除去所收集有机相中的溶剂后,在60 ℃真空干燥24 h,得黄色透明液体,产率67%。 [C6mim][BTB]与[C8mim][BTB]的合成方法与之相似,二者产率均为90%。
通过1H NMR(见辅助材料图S1)、13C NMR(见辅助材料图S2)和元素分析对其进行了表征。 结果如下:
[C4mim][BTB]:1H NMR(500 MHz,CDCl3), δ:9.32(s,1H),8.09(d, J=7.0 Hz,2H),7.43~7.35(m,3H),7.26(t, J=1.7 Hz,1H),7.20(t, J=1.7 Hz,1H),4.13(t, J=7.4 Hz,2H),3.90(s,3H),1.79~1.72 (m,2H),1.32~1.23 (m,2H),0.87(t, J=7.4 Hz,3H)。13C NMR(126 MHz,CDCl3), δ:137.51,131.42,128.34,128.04,123.43,121.85,49.74,36.26,31.98,19.38,13.29。 元素分析值/%:C 57.79,H 6.44,N 8.90(理论值/%:C 57.72,H 6.48,N 8.97)。
[C6mim][BTB]:1H NMR(500 MHz,CDCl3), δ:9.32(s,1H),8.09(d, J=7.0 Hz,2H),7.43~7.35(m,3H),7.26(t, J=1.7 Hz,1H),7.20(t, J=1.7 Hz,1H),4.13(t, J=7.4 Hz,2H),3.90(s,3H),1.79~1.72 (m,2H),1.32~1.23(m,6H),0.87(t, J=7.4 Hz, 3H)。13C NMR(126 MHz,CDCl3), δ:137.45,131.40,128.34,128.02,123.46,121.83,49.99,36.26,30.99,30.06,25.81,22.32,13.86。 元素分析值/%:C 60.00,H 7.14,N 8.29(理论值/%:C 60.00,H 7.12,N 8.23)。
[C8mim][BTB]:1H NMR (500 MHz,CDCl3), δ:9.32(s,1H),8.09(d, J=7.0 Hz,2H),7.43~7.35(m,3H),7.26(t, J=1.7 Hz,1H),7.20(t, J=1.7 Hz,1H),4.13(t, J=7.4 Hz,2H),3.90(s,3H),1.79~1.72 (m,2H),1.32~1.23(m,10H), 0.87(t, J=7.4 Hz, 3H)。 [C8mim][BTB]的13C NMR(126 MHz,CDCl3), δ:137.43,131.41,128.34,128.02,123.48,121.83,50.00,36.25,31.66,30.13,28.92,26.18,22.56,14.03。 元素分析值/%:C 61.93,H 7.70,N 7.57(理论值/%:C 61.97,H 7.66,N 7.61)。
我们对[C nmim][BTB]( n=4,6,8)进行了DSC分析(图2),并进一步得到了相关过程的热力学参数(表1)。 在升温过程中,测得[C4mim][BTB]的玻璃化转变温度为-62.3 ℃熔化温度为5.5 ℃(图2曲线a)。 [C6mim][BTB]的熔点为17.2 ℃,玻璃化转变温度为-59.2 ℃(图2曲线b)。 此外,[C6mim][BTB]的DSC曲线还在-23.4 ℃处出现了明显的放热峰(图2曲线b),即在升温过程中存在一个冷结晶过程,离子液体从玻璃态转变为晶体[27]。 [C8mim][BTB]的熔点为32.1 ℃(图2曲线c),因而在室温时为固态。 与[C4mim][BTB]和[C6mim][BTB]平直的降温DSC曲线(未给出)不同,[C8mim][BTB]在降温过程中在-6.5 ℃处出现了一个明显的结晶放热峰(图2曲线d)。 这使得在[C8mim][BTB]的升温DSC曲线(图2曲线c)中-19.2 ℃处出现的吸热峰不可能是玻璃化转变的信号,而有可能在此温度下发生了晶型的转变[27]。 由此可见,3种1-烷基-3-甲基咪唑苯甲酰基三氟硼酸盐的熔化温度均低于100 ℃,为离子液体。
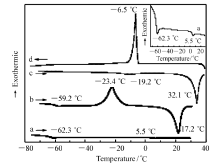 | 图2 [C4mim][BTB](a)、[C6mim][BTB](b)和[C8mim][BTB](c,d)的DSC曲线(插图:放大的曲线a)Fig.2 DSC curves of [C4mim][BTB](a), [C6mim][BTB](b) and [C8mim][BTB](c,d) Inset: enlarged curve a |
表1 离子液体的热力学参数 Table 1 Thermodynamic parameters of ionic liquids
| 表1 离子液体的热力学参数 Table 1 Thermodynamic parameters of ionic liquids |
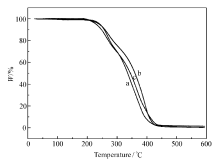
进一步通过热重分析(TGA)测试了所合成离子液体的热稳定性。如图3所示,3种离子液体皆在200 ℃左右开始分解,到400 ℃基本分解完全。这说明,此3种离子液体的热稳定性主要取决于阴离子结构,阳离子上碳链长度的变化对分解温度影响不明显。考虑到热分解温度,其在不超过200 ℃的环境中可放心使用。
离子液体的水溶性在液液萃取等领域是需要重点关注的一项性质。 为研究所合成3种离子液体的水溶性,我们将0.5 g [C nmim][BTB]( n=4,6,8)与0.5 mL三次水在2 mL离心管中混合,25 ℃下振荡(240 r/min)一定时间。 结果发现,3 h后,尚有少量[C4mim][BTB]未溶;6 h后,基本与水混溶。 12 h后,停止振荡,静置,[C6mim][BTB]及[C8mim][BTB]与水保持着清晰的两相界面,离子液体位于水的下方,说明二者具有一定的疏水性。 通过ICP-AES测定水相中B元素的含量,计算出[C6mim][BTB]及[C8mim][BTB]在水中的浓度分别为54.5和15.9 mmol/L,均低于1-丁基-3-甲基咪唑六氟磷酸盐([C4mim][PF6])的84.5 mmol/L[11],分别与1-乙基-3-甲基咪唑双三氟甲烷磺酰亚胺([C2mim][NTf2])的48.9 mmol/L和1-丁基-3-甲基咪唑双三氟甲烷磺酰亚胺([C4mim][NTf2])的15.7 mmol/L[28]接近(表2)。 鉴于[C2mim][NTf2]、[C4mim][NTf2]和[C4mim][PF6]在离子液体萃取体系中最为常用,有理由可以相信[C6mim][BTB]和[C8mim][BTB]可用于液液萃取领域。 由于此类离子液体的疏水性随碳链长度的增加而增强,将来可选用不同碳链长度的咪唑阳离子来进一步调节其疏水性,以满足实际需求。
表2 离子液体的黏度及在水中溶解度(25 ℃) Table 2 Viscosity and solubility in water of ionic liquids(25 ℃)
*This work. | 表2 离子液体的黏度及在水中溶解度(25 ℃) Table 2 Viscosity and solubility in water of ionic liquids(25 ℃) |
我们进一步将与水混合并振荡不同时间后的[C6mim][BTB]、[C8mim][BTB]进行干燥处理,测定其19F NMR谱图。 两离子液体的谱图(图4)均在143.06~143.81 mg/L区间出现了对应于BTB-中F的核磁共振吸收峰[25]。 在经历与水不同时间的混合后,其谱图(图4)在更高位移区未出现新的峰,且BTB-中F的核磁共振吸收峰未出现明显的位移,说明离子液体中的BTB-未出现明显的水解现象[25]。 这就是说,在有水的环境中,两离子液体具有较好的稳定性,这将有利于其在液液萃取等领域中的应用。
各离子液体的动力学粘度数据如图5所示。 当温度为298.15 K时,[C4mim][BTB]的粘度为220 cP,略高于粘度为180 cP的[C4mim][BF4][29]。 这可能是BTB-的体积大于B
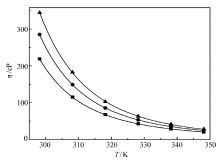 | 图5 [C4mim][BTB](■)、[C6mim][BTB](●)和[C8mim][BTB](▲)的粘度-温度图及VFT公式拟合曲线Fig.5 Plots and VFT formula fitting curves of viscosity vs temperature of [C4mim][BTB](■), [C6mim][BTB](●) and [C8mim][BTB](▲) |
对于[C4mim][BTB],当温度从298.15 K增加至348.15 K时,其粘度从220 cP迅速降低至20 cP。 [C6mim][BTB]和[C8mim][BTB]的变化趋势与[C4mim][BTB]相似。 当温度为348.15 K时,3种离子液体的粘度在20~30 cP之间,阳离子碳链长度的改变对粘度影响较小。
多数离子液体的粘度与温度间的关系符合VFT(Vogel-Fulcher-Tammann)经验公式(式(1))[32]。
式中, A、 B、 T0为与熔体组成有关的常数, η为动力学粘度(cP)。 于是,我们进一步尝试用VFT公式对得到的实验粘度数据进行拟合(图5),拟合参数列于表3中。 从表3可知,拟合的相关系数 R2皆大于0.999,且各参数的拟合误差均低于相应拟合值。 这说明,此3种离子液体的粘度与温度间的关系很好地符合VFT经验公式,可以准确预测其他温度下离子液体的粘度,有利于其应用。
表3 VFT公式对离子液体粘度-温度数据拟合的参数 Table 3 Fitting results of VFT formula
A、 B、 T0 are fitting parameters, R is correlation coefficient. | 表3 VFT公式对离子液体粘度-温度数据拟合的参数 Table 3 Fitting results of VFT formula |
我们合成了3种以BTB-为阴离子的新型咪唑类离子液体,并通过NMR、差热、热重等方法研究了其基础物化性质。 结果发现,3种离子液体开始分解的温度在200 ℃左右,随着碳链增长,其粘度和熔化温度逐渐升高。 其中,[C6mim][BTB]和[C8mim][BTB]的粘度高于[C4mim][NTf2]与[C2mim][NTf2],但低于[C4mim][PF6]。 [C4mim][BTB]为亲水性离子液体;[C6mim][BTB]和[C8mim][BTB]则为疏水性离子液体,二者在水中的溶解度均低于[C4mim][PF6],而分别与[C2mim][NTf2]和[C4mim][NTf2]接近。 尤为关键的是,二者在与水长时间的混合中表现出较好的稳定性。 鉴于[C2mim][NTf2]、[C4mim][NTf2]和[C4mim][PF6]在离子液体萃取体系中最为常用,[C6mim][BTB]和[C8mim][BTB]有望用于乏燃料后处理并提高临界安全。
辅助材料(Supporting Information)[离子液体的1H NMR和1C NMR谱图]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|