发展了一种微波-超声复合场下绿色高效合成砜类化合物的简便方法。 以芳甲基氯和苯亚磺酸钠为原料,以水为反应介质,在微波-超声复合场辅助下合成了一系列芳甲基苯基砜。 通过考察微波功率、超声功率、原料投料比、溶剂体积和反应时间等因素的影响,得出了苄基氯与苯亚磺酸钠之间模型反应的最优反应条件:微波功率为40 W,超声功率为50 W,苄基氯与苯亚磺酸钠的摩尔配比为1:3,反应时间为5 min。 在此条件下合成的苄基苯基砜产率为83%。 相比常规油浴条件,在微波-超声复合场的强化下反应速率提升了约42倍。 该方法具有较好的底物适应性,成功合成了23种砜类化合物。
A green, efficient and simple method for the synthesis of sulfones under combined microwave and ultrasound irradiation was developed. The aromatic methyl phenyl sulfones were synthesized from arylmethyl chlorides and sodium benzenesulfonates in aqueous media under combined microwave and ultrasound irradiation. The effects of microwave power, ultrasonic power, materials molar ratio, substrate concentration and irradiation time were investigated. The optimal conditions for the synthesis of benzyl phenyl sulfone are:microwave power, 40 W; ultrasonic power, 50 W; molar ratio of benzyl chloride and sodium benzene sulfonate, 1:3; reaction time, 5 min. The obtained yield is 83% under these conditions. Compared with the reaction in oil bath, the reaction was accelerated about 42 times. Twenty three sulfones have been successfully synthesized with broad substrate generality.
砜类化合物及其衍生物是重要的有机合成中间体[1],其结构中的砜基官能团经活化后可使其 α-位碳原子作为反应中心用于碳-碳键的形成[2]。 同时砜类化合物也具有一定的生物活性[3]。 特别是砜的芳基杂环类衍生物,在医药和农药领域均有广泛的应用,如CRTH2受体拮抗剂[4]、逆转录酶抑制剂[5]、杀菌剂[6]、除草剂[7]、抗病毒[8]、抗肿瘤[9]以及抗HIV[10]等。 因此,砜类化合物的合成具有十分重要的研究意义。
制备芳基砜的方法包括硫醚或亚砜的氧化[11]、芳烃在强酸条件下磺酰化[12]、亚磺酸盐和砜基的烃化[13,14]等反应。 通过氧化硫醚或亚砜合成砜的方法对氧化剂要求苛刻,且需要使用重金属催化剂,对环境污染严重;芳烃的磺酰化合成砜的方法同样需要在苛刻的条件下反应较长时间;而通过亚磺酸盐与卤代烷的反应一般需要醇类、乙腈、二甲基亚砜等极性溶剂,需要使用大量有机溶剂为反应介质,且所需时间较长[15,16,17]。 水是一种环境友好、价廉易得的绿色溶剂[18]。 近年来,以水代替常规有机溶剂参与化学反应成为热点,但大多数有机物难溶于水,需要添加相转移催化剂或与水互溶的有机溶剂助溶[19,20]。 研究表明,相转移催化剂应用于亚磺酸盐与卤代烷的反应可以提高反应收率,但相转移催化剂难以回收,且反应时间仍然较长,效率不高[21,22]。 Yi等[23]使用一定配比的离子液体与水作为反应溶剂,在温和条件下可得到较高收率,但仍需预先合成离子液体。 Varma等[24]利用微波辐射水介质中的亚磺酸钠与卤化物,在较短时间内得到较高产率的砜,但需在密闭的耐压玻璃反应器中进行高压反应,对反应设备要求苛刻。 因此,更为绿色、高效、简便的合成砜类化合物的方法还有待开发。
微波通过物料分子在电场中的偶极极化作用和离子传导作用实现加热,是直接作用于物料分子的体相加热。 相比于需要温度梯度推动的常规热传导过程,微波技术可从物料内部使体系整体快速升温,几乎无传热阻力,大大提高了热传递的效率。 超声波形成的机械纵波可对液体造成压缩和稀疏的作用,使液体内部形成微小气泡和空穴,其体积受到强大拉应力的作用迅速膨胀和崩塌,形成强冲击波和微射流,可使液液非均相体系在无表面活性剂的条件下迅速乳化,从而增加两相接触面积,同时促进两相界面上的质量传递。 微波-超声辅助合成技术是将微波技术与超声技术复合运用,将两种物理能量场的优势有机结合,可同时强化热、质传递,可显著促进特定有机合成反应(特别是非均相有机反应)的进程[25,26]。 本课题组[27,28,29,30]报道了在微波-超声复合能量场下促进一系列非均相体系的合成反应。 本文运用微波-超声复合能量场技术,以取代芳甲基氯和取代苯亚磺酸钠为反应物,在仅用水作为溶剂且无相转移催化剂的条件下绿色高效地合成了一系列芳甲基苯基砜类化合物(Scheme 1)。
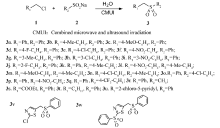 | Scheme 1 Combined microwave and ultrasound irradiation assisted synthesis of sulfones in aqueous media |
苯亚磺酸钠(分析纯)购自上海西陇生化科技有限公司;苄基氯(分析纯)购自阿拉丁试剂有限公司;其它试剂均为市售分析纯试剂。
MC8S-1A型微波合成仪(江苏南京汇研公司);BILON-650Y型超声波细胞粉碎机(上海比朗仪器制造有限公司);Bruker Magnet System 400MHz型核磁共振分析仪(NMR,美国布鲁克公司);GCT Premier型质谱分析仪(MS,美国Waters公司);Hewlett-Packard HP6890/5973型气-质联用仪(GC-MS,美国惠普公司);SRS EZ MELT-120型熔点仪(美国斯坦福研究系统公司)。
1.2.1 通用实验方法
将苯亚磺酸钠(15 mmol)和去离子水(10 mL)加入25 mL特制三口玻璃反应器中,待固体溶解后,加入芳甲基氯(5 mmol),将反应器置于微波合成仪中。 插入超声探头,使探头浸于液面下1~2 mm处。调节超声功率至50 W,微波功率至40 W,保持回流状态5 min。 冷却至室温,有固体析出。 过滤,用二氯甲烷(5 mL×2)萃取滤液,取萃取液与滤饼混合,蒸干溶剂,得到固体粗产物。 加入适量乙醇重结晶,抽滤,干燥后得晶体。 化合物性状及结构鉴定数据如下:
苄基苯基砜(3a)[31] 白色晶体;mp 146.8~147.5 ℃;1H NMR(400 MHz,CDCl3), δ:7.69~7.52(m,3H),7.43(t,J=7.7 Hz,2H),7.27(dt,J=24.4,7.2 Hz,3H),7.07(d,J=7.0 Hz,2H),4.30(s,2H);13C NMR (101 MHz,CDCl3), δ:137.84,133.76,130.84(2C),128.92(2C),128.77,128.61(2C),128.59(2C),128.13,62.86。
4-甲基苄基苯基砜(3b)[32] 白色晶体;mp 144.7~145.5 ℃;1H NMR(400 MHz,CDCl3), δ:7.67~7.62(m,2H),7.62~7.56(m,1H),7.48~7.41(m,2H),7.06(d,J=7.9 Hz,2H),6.96(d,J=8.0 Hz,2H),4.27(s,2H),2.31(s,3H);13C NMR(101 MHz,CDCl3), δ:138.72,138.01,133.65,130.69(2C),129.30(2C),128.88(2C),128.64(2C),124.96,62.58,21.22。
4-甲氧基苄基苯基砜(3c)[33] 白色晶体;mp 139.7~140.6 ℃;1H NMR(400 MHz,CDCl3), δ:7.67~7.62(m,2H),7.62~7.57(m,1H),7.49~7.42(m,2H),7.02~6.97(m,2H),6.81~6.75(m,2H),4.25(s,2H),3.78(s,3H);13C NMR(101 MHz,CDCl3), δ:160.01,137.96,133.65,132.03(2C),128.89(2C),128.64(2C),119.97,114.03(2C),62.21,55.27。
4-氟苄基苯基砜(3d)[33] 白色晶体;mp 166.8~167.6 ℃;1H NMR(400 MHz,CDCl3), δ:7.67~7.63(m,2H),7.63~7.58(m,1H),7.52~7.42(m,2H),7.10~7.02(m,2H),6.99~6.90(m,2H),4.28(s,2H);13C NMR(101 MHz,CDCl3), δ:163.06(d,J=248.6 Hz),137.70,133.86,132.58(d,J=8.5 Hz,2C),129.01(2C),128.55(2C),124.02(d,J=3.3 Hz),115.67(d,J=21.7 Hz,2C),61.97。
4-氯苄基苯基砜(3e)[34] 白色晶体;mp 190.4~191.2 ℃;1H NMR(400 MHz,CDCl3), δ:7.65(dd,J=8.2,1.1 Hz,2H),7.64~7.59(m,1H),7.51~7.43(m,2H),7.27~7.22(m,2H),7.05~6.98(m,2H),4.27(s,2H);13C NMR(101 MHz,CDCl3), δ:137.68,135.06,133.93,132.09(2C),129.06(2C),128.85(2C),128.60(2C),126.66,62.10。
4-硝基苄基苯基砜(3f)[35] 白色晶体;mp 204.5~205.5 ℃;1H NMR(400 MHz,DMSO), δ:8.24~8.13(m,2H),7.78~7.74(m,2H),7.73(d,J=1.4 Hz,1H),7.65~7.56(m,2H),7.49~7.41(m,2H),4.93(s,2H);13C NMR(101 MHz,DMSO), δ:147.41,138.03,136.38,134.10,132.26(2C),129.26(2C),128.01(2C),123.26(2C),59.84。
3-甲基苄基苯基砜(3g)[36] 白色晶体;mp 104.3~105.1 ℃;1H NMR(400 MHz,CDCl3), δ:7.66~7.62(m,2H),7.60(ddd,J=8.7,2.4,1.2 Hz,1H),7.49~7.42(m,2H),7.17~7.08(m,2H),6.90(s,1H),6.85 (td,J=5.6,2.7 Hz,1H),4.26(s,2H),2.26(s,3H);13C NMR(101 MHz,CDCl3), δ:138.31,137.96,133.67,131.58,129.52,128.84(2C),128.68(2C),128.42,127.91,127.87,62.90,21.22。
3-氯苄基苯基砜(3h)[36] 白色晶体;mp 100.6~101.3 ℃;1H NMR(400 MHz,CDCl3), δ:7.66(dt,J=8.5,1.6 Hz,2H),7.62(dt,J=2.5,1.5 Hz,1H),7.54~7.43(m,2H),7.32~7.26(m,1H),7.20(t,J=7.8 Hz,1H),7.06(t,J=1.8 Hz,1H),6.99(d,J=7.7 Hz,1H),4.27(s,2H);13C NMR(101 MHz,CDCl3), δ:137.62,134.40,134.00,130.83,130.03,129.81,129.06(2C),129.01,129.00,128.61(2C),62.27。
3-硝基苄基苯基砜(3i)[37] 白色晶体;mp 162.7~163.7 ℃;1H NMR(400 MHz,DMSO), δ:8.24~8.16(m,1H),8.04(s,1H),7.77~7.71(m,3H),7.65~7.58(m,4H),4.94(s,2H);13C NMR(101 MHz,DMSO), δ:147.37,137.84,137.58,134.08,131.02,129.81,129.24(2C),128.09(2C),125.53,123.29,59.48。
2-氟苄基苯基砜(3j)[37] 白色晶体;mp 138.9~139.8 ℃;1H NMR(400 MHz,CDCl3), δ:7.70~7.64(m,2H),7.64~7.58(m,1H),7.45(dd,J=10.8,4.9 Hz,2H),7.30(ddd,J=11.3,6.7,5.3 Hz,2H),7.15~7.08(m,1H),6.96~6.86(m,1H),4.40(s,2H);13C NMR(101 MHz,CDCl3), δ:161.15(d,J=249.8 Hz),137.92,133.88,132.69(d,J=2.8 Hz),130.95(d,J=8.3 Hz),128.93(2C),128.55(2C),124.38(d,J=3.7 Hz),115.80(d,J=14.6 Hz),115.44(d,J=21.7 Hz),55.69(d,J=2.5 Hz)。
苄基-4-甲基苯基砜(3k)[33] 白色晶体;mp 144.2~145.1 ℃;1H NMR(400 MHz,CDCl3), δ:7.53~7.46(m,2H),7.34~7.26(m,2H),7.26~7.20(m,3H),7.12~7.05(m,2H),4.28(s,2H),2.41(s,3H);13C NMR(101 MHz,CDCl3), δ:144.69,135.00,130.84(2C),129.52(2C),128.69,128.64(2C),128.55(2C),128.31,62.92,21.64。
4-硝基苄基-4-甲基苯基砜(3l)[38] 白色晶体;mp 188.3~189.3 ℃;1H NMR(400 MHz,DMSO), δ:8.23~8.13(m,2H),7.66~7.57(m,2H),7.48~7.43(m,2H),7.41(d,J=8.0 Hz,2H),4.89(s,2H),2.40(s,3H);13C NMR(101 MHz,DMSO), δ:147.37,144.64,136.51,135.24,132.24(2C),129.69(2C),128.04(2C),123.25(2C),59.94,21.05。
4-甲氧基苄基-4-甲基苯基砜(3m)[35] 白色晶体;mp 119.6~120.4 ℃;1H NMR(400 MHz,CDCl3), δ:7.51(d,J=8.2 Hz,2H),7.24(d,J=8.1 Hz,2H),7.03~6.97(m,2H),6.82~6.75(m,2H),4.23(s,2H),3.78(s,3H),2.42(s,3H);13C NMR(101 MHz,CDCl3), δ:159.95,144.59,135.08,132.03(2C),129.52(2C),128.64(2C),120.17,114.00(2C),62.23,55.27,21.64。
4-氯苄基-4-甲基苯基砜(3n)[38] 白色晶体;mp 169.9~170.7 ℃;1H NMR(400 MHz,CDCl3), δ:7.55~7.47(m,2H),7.27(s,2H),7.25~7.21(m,2H),7.06~6.98(m,2H),4.25(s,2H),2.42(s,3H);13C NMR(101 MHz,CDCl3), δ:144.96,134.96,134.77,132.11(2C),129.68(2C),128.81(2C),128.60(2C),126.86,62.12,21.67。
苄基-4-氯苯基砜(3o)[33] 白色晶体;mp 173.4~174.3 ℃;1H NMR(400 MHz,CDCl3), δ:7.56~7.50(m,2H),7.43~7.38(m,2H),7.36~7.24(m,3H),7.08(dd,J=5.2,3.3 Hz,2H),4.31(s,2H);13C NMR(101 MHz,CDCl3), δ:140.49,136.28,130.82(2C),130.15(2C),129.21(2C),128.96,128.72(2C),127.88,62.89。
苄基-4-硝基苯基砜(3p)[39] 淡黄色晶体;mp 169.5~170.5 ℃;1H NMR(400 MHz,DMSO), δ:8.45~8.33(m,2H),8.04~7.92(m,2H),7.39~7.26(m,3H),7.18(dd,J=7.8,1.6 Hz,2H),4.85(s,2H);13C NMR(101 MHz,DMSO), δ:150.46,143.68,131.04(2C),129.87(2C),128.58,128.40(2C),127.94,124.28(2C),60.22。
苄基甲基砜(3r)[31] 白色晶体;mp 127.5~128.3 ℃;1H NMR(400 MHz,CDCl3), δ:7.41(s,5H),4.25(s,2H),2.75(s,3H);13C NMR(101 MHz,CDCl3), δ:130.57(2C),129.15(3C),128.34,61.26,39.05。
苯磺酰乙酸乙酯(3s)[40] 白色晶体;mp 42.6~43.5 ℃;1H NMR(400 MHz,CDCl3), δ:7.96(dt,J=8.6,1.7 Hz,2H),7.73~7.67(m,1H),7.64~7.55(m,2H),4.28~4.01(m,4H),1.19(t,J=7.1 Hz,3H);13C NMR(101 MHz,CDCl3), δ:162.35,138.67,134.34,129.25(2C),128.57(2C),62.43,61.02,13.88。
己基苯基砜(3t)[41] 白色晶体;mp 21.7~22.4 ℃;1H NMR(400 MHz,CDCl3), δ:7.91(d,J=8.0 Hz,2H),7.66(t,J=7.2 Hz,1H),7.57(t,J=7.7 Hz,2H),3.19~2.97(m,2H),1.80~1.61(m,2H),1.35(dt,J=14.2,7.2 Hz,2H),1.25(dd,J=12.1,8.5 Hz,4H),0.85(t,J=6.7 Hz,3H);13C NMR(101 MHz,CDCl3), δ:139.17,133.63,129.25(2C),128.00(2C),56.26,31.13,27.89,22.58,22.25,13.90。
2-氯-5-[(苯磺酰基)-甲基]-吡啶(3u) 白色晶体;mp 138.9~139.9 ℃;1H NMR(400 MHz,CDCl3), δ:7.97(d,J=2.2 Hz,1H),7.67(dd,J=11.2,7.6 Hz,3H),7.60~7.48(m,3H),7.30(t,J=6.0 Hz,1H),4.30(s,2H);13C NMR(101 MHz,CDCl3), δ:152.09,151.05,140.84,137.25,134.39,129.40(2C),128.47(2C),124.36,123.48,59.12;HRMS(EI)计算值C12
2-氯-5-[(苯磺酰基)-甲基]-噻唑(3v) 白色晶体;mp 137.5~138.5 ℃;1H NMR(400 MHz,CDCl3), δ:7.81~7.74(m,2H),7.69(ddd,J=8.7,2.4,1.2 Hz,1H),7.60~7.51(m,2H),7.18(s,1H),4.47(s,2H);13C NMR(101 MHz,CDCl3), δ:153.80,143.08,136.82,134.55,129.46(2C),128.55(2C),126.31,54.68;HRMS(EI)计算值C10
2-苯磺酰基-5-[(苯磺酰基)-甲基]-噻唑(3w) 白色晶体;mp 147.6~148.5 ℃;1H NMR(400 MHz,DMSO), δ:8.04~7.96(m,2H),7.86~7.80(m,2H),7.80~7.69(m,5H),7.63~7.57(m,2H),5.27(s,2H);13C NMR(101 MHz,DMSO), δ:166.97,147.13,137.89,137.09,135.08,134.47,133.39,130.08(2C),129.40(2C),128.16(2C),128.07(2C),52.56;HRMS(EI)计算值C16H13NO4S3 379.0007,实测值379.0009。
1.2.2 水相苯亚磺酸钠回收套用实验
上一轮次反应结束后,回收含过量苯亚磺酸钠的水相滤液。 水相补充理论用量(5 mmol)的苯亚磺酸钠及5 mmol氯苄后,按前述通用实验方法进行下一轮次的水相套用实验。 如此重复套用5次,产率分别为83%、83%、82%、82%和82%,基本保持不变。
以苄基苯基砜的合成为模型反应,以 n(苄基氯): n(苯亚磺酸钠)=1:1.3,微波功率20 W,超声功率50 W,去离子水体积10 mL,反应时间5 min为起始条件,优化反应过程。 首先考察了微波功率和超声功率的影响。 实验结果显示,适当的增大微波和超声功率可以提高反应收率,但随着微波功率、超声功率继续增大,产率不再上升,反而略微下降。 这是由于过高的微波功率会使体系处于剧烈沸腾状态,造成液面波动并引起超声输出功率不稳定,影响超声效果;超声功率过高会使沸腾状态下大量反应液飞溅至容器壁,导致无法充分反应,从而使反应产率降低(表1,Entries 1~7)。进一步研究投料比、溶剂体积及反应时间对反应收率的影响,发现 n(苄基氯): n(苯亚磺酸钠)在1:1~1:3时,砜的产率随苯亚磺酸钠用量的增加而提高(表1,Entries 8~10),继续增加苯亚磺酸钠的用量,产率提升幅度很小(表1,Entry 11)。在同一反应装置中,溶剂的用量会影响反应体系对微波的吸收和油水两相的混合效果,故改变溶剂水的用量会在一定程度上影响反应速率(表1,Entries 12~15),在苄基氯的投料量为5 mmol时,水体积约为10 mL时砜的产率最高。 产率随反应时间的延长而增加,当反应时间超过5 min后,产率基本保持不变(表1,Entries 16~18),因此,5 min为最佳反应时间。 综上所述,最优的反应条件是:微波功率40 W,超声功率50 W, n(苄基氯): n(苯亚磺酸钠)=1:3,溶剂体积为10 mL,反应时间为5 min。
| 表1 苄基氯与苯亚磺酸钠反应条件的优化 Table 1 Optimization of conditions of the reaction between benzyl chloride and sodium benzenesulfonate |
以苄基苯基砜的合成为模型反应,分别考察了常规油浴回流、微波场、超声场和微波-超声复合场条件下的反应情况,结果如表2所示。
| 表2 不同条件下苄基苯基砜的合成 Table 2 Synthesis of benzyl phenyl sulfone under different conditions |
从表2可见,苄基苯基砜的合成效率在微波-超声复合能量场下有明显提升,约是常规条件下的42倍,约是微波条件下的6倍,约是超声条件下的6倍。 这是由于微波-超声复合能量场集合了微波能量场的强化传热作用和超声能量场的强化传质作用,且两种能量场的叠加体现出显著的协同强化效应。
在微波-超声复合能量场辅助合成苄基苯基砜的最优反应条件下,合成了一系列不同取代基的苄基苯基砜(表3,Entries 1~17),产率在69%~90%。 电子效应对该反应活性有一定影响:当苄基氯的苯环上连有强吸电子基时,目标化合物产率较高(表3,Entries 6,9,12),取代基为卤素时产率也较高(表3,Entries 4~5,8,10,14),苄基氯的苯环上连有供电子基时,延长反应时间至10 min后,可以中等产率得到目标产物(表3,Entries 2~3,7,13)。 当苯亚磺酸钠的苯环上连有供电子基时,目标化合物产率较高,卤素次之,含强吸电子基的苯亚磺酸钠为底物时,产物的产率很低(表3,Entries 11,15~16)。 当反应底物为4-三氟甲基苯亚磺酸钠时,通过GC-MS监测仅能观察到微量目标产物3q的生成(表3,Entry 17)。当底物为烷基磺酸钠时,也可得到较高的产率(表3,Entry 18)。 说明本文方法对芳甲基氯与苯(烷)基亚磺酸钠生成砜的反应具有比较宽的底物适应性。
此外,当底物为烷基氯或其他芳杂环化合物时,也可得到相应的产物(表3,Entries 19~23)。 我们意外地发现,当底物为2-氯-5-氯甲基噻唑时,若加入一定量的盐酸,则可同时得到一定比例的化合物3v和3w(表3,Entry 23);若不加入酸,则主要得到化合物3v(表3,Entry 22),说明酸性环境可以促进噻唑环上的亲核取代反应。 Maloney等[42]曾报道通过盐酸对含氮杂环上氮的质子化,可促进亲核取代反应的发生。据推测,本反应中噻唑环的活化可能与上述文献中描述的机理相似。
| 表3 微波-超声辅助合成各种砜类化合物 Table 3 Combined microwave-ultrasound assisted synthesis of various sulfones |
成功实现了微波-超声复合能量场作用下水介质砜类化合物的高效合成。 该方法比常规油浴回流条件下的反应速率提高了约42倍,比单微波条件下提高了约6倍,比单超声条件下提高了约6倍;优化了微波功率、超声功率、投料比、溶剂体积和反应时间等反应条件;并合成了一系列不同取代基的芳甲基苯基砜类衍生物,表明该方法具有良好的底物适应性。 与传统方法相比,本合成方法具有反应效率高、反应溶剂绿色、产物可直接析出分离、溶剂水与过量原料可回收套用、底物适应性良好等优势,具有良好的应用前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|


