为建立一种简单高效的中药活性成分的提取分离、定性鉴定、含量测定以及降血糖活性研究的新方法,采用绿色无毒的水提酸沉法提取了黄芩的活性成分—黄芩苷,通过薄层色谱法做定性鉴定和紫外分光光度法测定其含量,构建一个高效的电化学葡萄糖传感器,并建立一种基于电化学安培法的降血糖活性研究新方法。 以临床降糖药阿卡波糖论证了电化学安培法检测葡萄糖淀粉酶抑制活性的可靠性和稳定性,并成功应用于黄芩苷的降血糖活性研究。 结果表明,黄芩苷具有较好的葡萄糖淀粉酶抑制活性,其半数抑制浓度(IC50)为0.056 g/L。 本研究为从天然药物中提取分离降血糖活性成分提供了一种新颖的研究方法。
A novel method for the extraction, isolation, identification and determination of the active component of Chinese medicine and its inhibitory activity on glucoamylase in a simple and efficient way was developed. The active ingredient baicalin was extracted from Scutellaria baicalensis using green nontoxic water-extracting and acid-depositing method. It was identified qualitatively by thin layer chromatography and the content was determined by ultraviolet spectrophotometry. An effective electrochemical glucose sensor was fabricated and a new method of characterizing hypoglycemic activity was developed based on electrochemical amperometric detection. Acarbose(clinical antidiabetic drug) was further used to demonstrate the reliability and stability of determining the inhibitory activity of glucoamylase by electrochemical amperometry. The results show that the baicalin has a good inhibitory activity on glucoamylase with a half maximal inhibitory concentration(IC50) at 0.056 g/L. This study provides a novel method for the extraction and isolation of hypoglycemic components from natural medicines.
糖尿病是一种严重危害人类健康的慢性疾病。 近年来,糖尿病患者在不断上升,糖尿病已经被国家列为“新药创制科技重大专项”的十大人类重大疾病之一,研发新型的糖尿病治疗药物具有非常重要的意义[1,2]。 葡萄糖苷酶和淀粉酶抑制剂是临床上作为治疗糖尿病的药物,这些药物可以明显降2型糖尿病人餐后血糖水平,并能减少并发症的发生。 目前,治疗糖尿病的酶抑制剂主要是通过人工合成,这种化学合成药物不仅副作用较大,而且价格比较昂贵。 由于中药的毒副作用相对较小且疗效显著,研究人员开始热衷于从天然药物中提取葡萄糖苷酶或淀粉酶抑制剂作为候选的降血糖药物。
黄芩是唇形科黄芩属多年生草本植物,是我国传统的清热泻火药。 黄芩苷是黄芩的主要活性成分,它是一种针晶状淡黄色固体。 它难溶于水,可溶于有机溶剂和碱性溶液里,具有清热解毒、抗菌消炎、降血压等功效[3,4]。 目前,已有国外学者开始研究黄芩苷对脂肪酶的抑制作用[5],但有关黄芩苷对葡萄糖淀粉酶的抑制作用尚见相关的文献报道。
有关黄芩苷的提取分离方法已有不少报道,较常见的方法有:溶剂浸提、微波提取、超声萃取、超高压提取和连续萃取等[6]。 这些方法萃取效率比较高,但需要用到有机溶剂或昂贵的仪器设备。 为倡导绿色环保工艺,本文提出水提酸沉法提取黄芩苷,并通过薄层色谱做定性鉴定和紫外分光光度法测定其含量,建立简单高效的黄芩苷提取分离、定性鉴定与含量测定的分析方法。
葡萄糖淀粉酶抑制剂的活性是通过检测加入酶前后的底物生成葡萄糖的含量变化来确定的。 常用的降血糖药物筛选方法主要是碘量法和分光光度法,这两种方法均是基于显色反应原理,极易受到酶反应体系的背景颜色和溶液状态的影响,造成很大的实验误差。 由于中药提取物大部分具有较深的颜色,不可避免会严重干扰实验结果。 目前,已有不少文献[7,8,9]采用铜基纳米材料制备具有良好电催化性能的葡萄糖传感器,我们课题组曾成功研制出一种高选择性和高灵敏度的葡萄糖传感器,用于血液中葡萄糖的检测[10]。 在前期研究基础上,我们采用简单方便的电化学沉积法制备了一种非酶葡萄糖传感器,并首次应用于降血糖活性成分筛选研究。 本文旨在建立一种电化学测定葡萄糖淀粉酶抑制活性的新方法。 电化学安培筛选法相比传统的碘量法和分光光度法,操作简单、快速,准确度和精密度都得到很大的改善,特别适用于天然药物有效成分的降血糖活性快速筛选。
CS型电化学工作站 (武汉科恩特仪器有限公司);TU-1900型紫外可见分光光度计(北京普析通用仪器公司);玻碳电极、铂丝电极和Ag/AgCl电极(上海三麝仪器仪表公司)。
黄芩购自广州敦和路大森林药店,粉碎过四号筛;黄芩苷标准品购自上海伊卡生物技术有限公司;阿卡波糖购自德国拜耳公司(每片含阿卡波糖50 mg)。 葡萄糖淀粉酶、葡萄糖和淀粉购自上海伯奥生物科技有限公司;硝酸铜,分析纯,购自广州试剂厂。
黄芩苷的提取采用水提酸沉法。 称取黄芩粉末50.0 g于烧杯中,加入500 mL水,煮沸30 min,冷却过滤,滤渣继续加约10倍水煎煮30 min,合并提取液,恒温70~80 ℃,加入HCl调节pH值为1~2,静置1 d,过滤,滤渣加水搅拌形成混悬液,再加入质量分数20.0%NaOH水溶液调节pH值为7~7.5,使悬浮物溶解,然后加入与作用溶液相同体积的乙醇充分搅拌后静置12 h,过滤,滤液恒温80 ℃再加入HCl调节pH值为1~2,黄芩苷析出。 过滤得到沉淀,以20.0 mL 95%乙醇洗涤,干燥,得到较纯的黄芩苷提取物。
化学显色鉴别 分别称取约0.01 g黄芩苷标准品和提取物溶于1.0 mL乙醇中,加入约0.1 g镁粉,再滴加两滴浓盐酸,观察颜色变化。 再取产品溶液点于滤纸上,干燥后喷洒1.0%的醋酸镁甲醇溶液,在紫外灯照射下观察对照。
薄层色谱鉴定[11] 分别称取约0.01 g黄芩苷标准品和提取物,加1.0 mL甲醇超声溶解,配成适当浓度的甲醇溶液,用毛细管点在同一块硅胶板上,用乙酸乙酯,甲醇,甲酸和水(体积比7∶2∶0.5∶0.5)作展开剂,展开完毕,晾干。 最后分别喷洒质量分数为1.0%三氯化铁水溶液和醋酸铅溶液显色,对比二者的斑点位置和颜色。
精确称量黄芩苷标准品11.8 mg用50%乙醇水溶液溶解,定容到25.0 mL容量瓶,配成质量浓度为0.4700 g/L黄芩苷标准溶液。 吸取标准溶液0.75、1.00、1.25、1.50、1.75和2.00 mL于10.0 mL容量瓶中,用50.0%乙醇水溶液定容,紫外可见分光光度计于278 nm处测其吸光度,绘制标准曲线。
准确称量黄芩苷提取物10.0 mg,用50.0%乙醇水溶液溶解,定容在25.0 mL容量瓶中。 用滤纸过滤,舍弃初始的滤液,吸取续滤液5.0 mL于25.0 mL容量瓶中。 另取50.0%乙醇水溶液作为空白对照,于278 nm波长处测吸光度,根据回归方程式计算出对应浓度。 由对应浓度计算出粗产品黄芩苷的含量。 结果计算:
式中, w表示黄芩苷含量(质量分数%), ρx为根据回归方程计算的样品的质量浓度 (g/L),25为黄芩苷乙醇溶液的体积 V(mL), m为黄芩苷提取物的质量(mg)。
玻碳电极分别用1和0.05 μm的氧化铝粉末在麂皮上进行抛光处理,然后依次在丙酮、乙醇和去离子水中分别超声清洗1 min,于室温自然晾干备用。 使用电化学工作站进行恒电位极化,在参考文献[12]方法的基础上进行了一些改进,将氧化铜沉积在玻碳电极表面。 方法简述如下:采用三电极体系,以Ag/AgCl电极作为参比电极,铂丝电极作为对电极,在0.100 mol/L Cu(NO3)2(0.100 mol/L KCl作为支持电解质)溶液中对玻碳电极进行电沉积。 恒电位极化电位为-0.4 V,时间为3 min,玻碳电极沉积了一层薄薄的红色的金属铜,常温下晾干,然后设置电位为-0.5~0.3 V,在0.10 mol/L NaOH水溶液里循环伏安循环20圈,将Cu氧化成CuO。 以沉积了氧化铜的玻碳电极作为工作电极、铂丝电极作为辅助电极,Ag/AgCl电极作参比电极,构成一个简便的电化学葡萄糖传感器。
采用上述制备的葡萄糖传感器在0.10 mol/L NaOH水溶液中进行循环伏安和计时电流测量[13]。 循环伏安的检测条件:电位范围为0~0.8 V,扫描速率为100 mV/s,电流量程选择20 mA,检测葡萄糖浓度为0.005 mol/L。 计时电流测量条件:在磁力搅拌下,电位为0.6 V的工作条件下1000 s内实现葡萄糖从0.1~10.0 mmol/L的检测,每个浓度的电流响应进行3次重复测定。
1.6.1 底物溶液的配制
称取3.0 g可溶性淀粉,加少量蒸馏水溶解,随后一边搅拌,一边加入约80 mL热水中,继续煮沸3 min,静置冷却,加蒸馏水定容至100 mL,配成质量浓度为30.0 g/L。
1.6.2 葡萄糖淀粉酶液的配制
称取30 U/mg的葡萄糖淀粉酶0.0167 g,在50 mL的烧杯中,加入30 mL 0.100 mol/L pH=6.8的磷酸钠缓冲溶液,用玻璃棒搅拌溶解,将上清液小心倾入100 mL容量瓶中。 再往沉渣部分再加入少量的磷酸盐缓冲液,捣研3~4次,最后把全部溶液转移到容量瓶中,用缓冲溶液定容至刻度,摇匀,浓度为5 U/mL。 放在4 ℃冰箱内静置12 h,用4层纱布过滤,滤液作为供试液。 用移液枪移取0.20 mL母液到10.0 mL容量瓶中,用缓冲溶液定容至刻度,摇匀,配成0.1 U/mL的酶液。
1.6.3 酶抑制活性测定
取6支试管,分别标号A、B、C、D1、D2和D3 。 A为空白组,不加酶(以磷酸钠缓冲溶液代替),不加抑制剂;B为阴性对照组,加酶,不加抑制剂;C为阳性对照组,加酶,加0.10 mL阿卡波糖;D1、D2、D3为样品组,加酶,加0.10 mL不同浓度的药物溶液。 试剂加入的顺序为:酶液0.5 mL(空白组以磷酸钠缓冲溶液代替),pH=6.8的磷酸钠缓冲溶液2.5 mL,加入0.10 mL抑制剂,在37 ℃水浴中,10 min后,再加入30.0 g/L的可溶性淀粉溶液5 mL,置于37 ℃水浴中恒温20 min后,加入6.0 mL 0.50 mol/L的NaOH溶液终止反应。 迅速冷却至室温,再用蒸馏水定容到30.0 mL。 采用葡萄糖传感器检测各反应体系的葡萄糖含量。
1.6.4 酶抑制率的计算
根据抑制率的计算公式可求出黄芩苷对葡萄糖淀粉酶的抑制率,根据抑制率-浓度曲线求出IC50。
即
式中, I表示酶抑制率(%), cA为空白组测定的葡萄糖浓度(mol/L), cB为阴性对照组测定的葡萄糖浓度(mol/L), cD为样品组测定的葡萄糖浓度(mol/L)。
根据黄酮特有的显色反应可初步判断提取物是否为黄酮类物质。 提取物遇镁粉和浓盐酸会出现红色;再喷洒醋酸镁溶液,在紫外光下可观察到荧光。 两种反应呈阳性表明黄芩提取物含有黄酮。
采用薄层色谱法进一步鉴定所提取的黄酮是黄芩苷。 提取物和标准品均在薄层板的同一个位置出现斑点,喷三氯化铁反应显绿色;喷醋酸铅反应显橙红色。 以上实验结果证明所提取物是黄芩苷。
黄芩提取物中黄芩苷的含量通过紫外-可见分光光度法测定。 结果如表1所示。 由黄芩苷的质量浓度 ρ与吸光度 D可得线性关系 D=3.6232 ρ+0.5097,根据方程可求得样品质量浓度 ρX=0.071 g/L,由式(1)求得提取物黄芩苷质量分数为88.75%。
| 表1 黄岑苷的质量浓度与吸光度的关系 Table 1 Correlation between the mass concentration of baicalin and absorbance |
为了获得传感器的最佳测试条件,我们采用三电极体系,将电极置于不同浓度(0.02、0.05、0.10、0.20和0.50 mol/L)NaOH电解质溶液中进行循环伏安测试。 实验结果显示,随着NaOH浓度的增加,反应体系中的OH-含量增多,峰电流逐渐增大,且在NaOH浓度为0.10 mol/L时达到最大值。 这说明了NaOH溶液为0.10 mol/L时该传感器电催化氧化葡萄糖的性能最佳。 因此,整个实验过程中所用的电解液均是0.10 mol/L NaOH溶液。
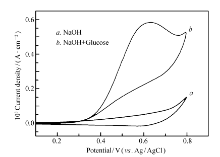
循环伏安法(CV)经常用来表征电化学葡萄糖传感器的适用性[14,15]。图1显示了基于氧化铜的葡萄糖传感器对葡萄糖的催化氧化情况,可以明显看出,加入了0.003 mol/L葡萄糖溶液后,循环伏安图的氧化峰电流明显增大,在0.6 V电位处出现明显的葡萄糖氧化峰,表明氧化铜电极对葡萄糖有良好的催化氧化效果,可以作为葡萄糖检测的有效工具。
电流响应与葡萄糖浓度的标准曲线通过计时电流法确定。 如图2所示,每隔50 s加入0.001 mol/L葡萄糖,电极对葡萄糖的响应电流呈阶梯式上升,且在一定的浓度范围内,响应电流与葡萄糖的浓度呈线性关系。 响应电流与葡萄糖浓度线性方程为 y= 0.1142 x+0.0876。
2.5.1 电化学葡萄糖传感器用于葡萄糖淀粉酶抑制活性研究的可靠性验证
为验证葡萄糖传感器测定酶抑制活性的可靠性,以临床常用降糖药—葡萄苷糖和淀粉酶抑制剂阿卡波糖作为阳性测试药物,分别采用电化学安培法和碘量法测定阿卡波糖对葡萄糖淀粉酶的抑制活性。 由于阿卡波糖溶液无颜色,不会干扰碘量法测定结果,从表2结果可以看出,两种方法测得的葡萄糖淀粉酶抑制率比较接近,且不同浓度的阿卡波糖溶液对葡萄糖淀粉酶呈现不同程度的抑制作用,在一定的浓度范围内,药物浓度与抑制率呈现正相关。 从电化学安培法和碘量法测得的葡萄糖淀粉酶抑制率对阿卡波糖浓度方程分别为: yA=839.71 x+14.55( r=0.991); yI=826.60 x+14.41( r=0.981),其IC50值(半数抑制浓度)分别为: 0.042和0.043 g/L。 两种实验方法均显示了阿卡波糖对葡萄糖淀粉酶具有很强的抑制活性,实验结果与临床效果吻合,两种方法测得的酶抑制率无明显差异。
| 表2 阿卡波糖浓度与抑制率的关系 Table 2 Relationship between mass concentration and inhibition rate of acarbose |
2.5.2 葡萄糖淀粉酶抑制活性的稳定性研究
为提高电化学葡萄糖传感器测定葡萄糖淀粉酶活的稳定性,本文分别研究了反应物加入顺序对酶活测定结果的影响。 重复5次实验发现:1)先加酶—再加抑制剂(0.060 g/L阿卡波糖)—最后加底物的加入顺序,抑制率分别为:62.75%、62.58%、62.61%、62.65%和62.65%;2)先加底物乳液—再加抑制剂(0.060 g/L阿卡波糖)—最后加酶的抑制率分别为:61.50%、62.09%、63.20%、62.40%和61.60%。 从实验结果来看,先加酶的抑制率比后加酶的要高,且先加酶反应体系的精密度也明显好于后加酶反应体系。 这个可能跟药物对酶的抑制机理有关,抑制剂与葡萄糖淀粉酶相互作用,从而阻碍了酶与底物的充分接触,使酶解产生的葡萄糖减少,从而达到抑制的效果。 先加入底物和抑制剂再加入酶,可能会导致酶与抑制剂不能充分反应,从而导致抑制剂对葡萄糖淀粉酶的抑制效果降低。 因此,为提高酶抑制活性实验的稳定性,采用先加葡萄糖淀粉酶、再加抑制剂、最后加底物的添加顺序。
2.5.3 电化学葡萄糖传感器的抗干扰性研究
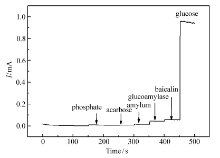
抗干扰性是电化学传感器检测葡萄糖的重要指标,为验证葡萄糖淀粉酶抑制活性筛选体系共存物质对葡萄糖传感器的干扰影响。 采用计时电流法,分别添加反应浓度的磷酸钠缓冲液、阿卡波糖、淀粉、葡萄糖淀粉酶、黄芩苷和葡萄糖溶液(5 mmol/L)。 结果如图3所示。 传感器对磷酸盐缓冲液、阿卡波糖、淀粉、葡萄糖淀粉酶、黄芩苷等物质无明显的响应电流,但加入葡萄糖后电流急剧上升。 实验结果证明,酶反应体系共存的物质对葡萄糖的检测无明显的干扰,说明本文构建的葡萄糖传感器适用于葡萄糖淀粉酶抑制活性研究。
2.5.4 黄芩苷的降血糖活性研究
采用电化学安培法研究黄芩的黄酮提取物黄芩苷对葡萄糖淀粉酶的抑制活性。 本实验所用的黄芩苷是经过提取分离并且纯化后的样品,杂质含量比较低,实验显示黄芩苷溶液在修饰电极上并无明显响应。表3分别列出了空白组、阴性对照组、阳性对照组、黄芩苷组的抑制率。 其中,0.060 g/L黄芩苷的抑制率为50.39% ,相同质量浓度的阿卡波糖的抑制率为62.65%。 根据黄芩苷质量浓度和抑制率可以求出黄芩苷对葡萄糖淀粉酶的IC50=0.056 g/L。
| 表3 黄芩苷的葡萄糖淀粉酶抑制率 Table 3 Inhibitory rate of baicalin on glucoamylase |
从实验结果来看,黄芩苷具有较好的葡萄糖淀粉酶的抑制活性,其抑制率相当于临床降糖药阿卡波糖的80%,且在一定浓度范围内呈现剂量依赖性。 由于黄芩苷是从常用中药中提取出来的天然产物,比人工合成药物的安全性更高,副作用更少。
本研究建立了一种基于电化学安培法的中药有效成分葡萄糖淀粉酶抑制活性筛选的新方法,以临床降糖药阿卡波糖验证了方法的可靠性和稳定性,并应用于中药提取物的酶抑制活性研究。 候选中药是选择从黄芩中提取分离黄酮成分黄芩苷;通过显色反应和薄层色谱法做定性鉴定;紫外分光光度法测定其含量。 本文采用简单快速的电化学沉积法构建了一个高灵敏度和选择性的氧化铜葡萄糖传感器,并应用于研究黄芩苷对葡萄糖淀粉酶的抑制作用。 研究结果表明,黄芩苷具有较好的葡萄糖淀粉酶抑制活性。 本研究为从天然产物中提取分离葡萄糖淀粉酶抑制剂作为新型降糖药提供了一种新颖的研究思路。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|