Sb基材料作为一类合金机制的锂离子电池负极材料,因具有比容量高、安全性好等优点受到广泛关注。 然而,由于Sb基负极材料在充放电过程中的体积效应和本身导电性较差等问题导致的循环性能不理想,制约了其作为锂离子电池负极材料的商业化应用。 本文综述了近年来在锂离子电池Sb基各类负极材料方面的研究进展,重点介绍了它们的反应机理、合成方法及电化学性能,并对Sb基负极材料的发展方向进行了展望。
As the typical anode material for lithium batteries, antimony-based materials have attracted much attention due to their high theoretical specific capacity and high safety performance. Nevertheless, antimony-based materials suffer significant capacity fading due to their large volume expansion in the charge-discharge process and poor electrical conductivity, which severely hinders their commercial applications in lithium batteries. The research progress of antimony-based anode materials in recent years is presented in this paper. Reaction mechanism, synthetic method and electrochemical performance are introduced and the research trend of antimony-based anode materials is prospected in the end.
锂离子电池作为新一代的电化学储能与转换器件,具有工作电压高、能量密度高、使用寿命长、无记忆效应和对环境友好等诸多优点,被人们广泛地应用于手机、笔记本电脑、电动工具、摄像机、照相机及电动车等领域,是现阶段实现商业化的综合性能最优的二次化学电源[1,2]。 锂离子电池负极材料是其重要的组成部分,作为储锂的主体,其性能高低直接决定了锂离子电池性能的优劣,目前商业化的锂离子电池一般使用石墨或者改性石墨作为负极材料,然而石墨的理论比容量仅为372 mA·h/g,难以满足市场对大型动力电池及储能电池的应用需求。 此外,石墨的嵌锂电位平台接近金属锂,当电池过充电时,电极表面易析出金属锂,形成锂枝晶造成电池短路[3]。 因此,开发具有高能量密度及安全性能好的新型负极材料成为锂离子电池领域的重要研究方向之一。 Sb基负极材料作为合金机制负极材料的典型代表,因其具有较高的理论比容量、原材料来源丰富、易于制备、安全性能好等优点,被认为是具有发展潜力的可替代石墨的负极材料之一。 但是,Sb基负极材料与Si、Ge、Sn等负极材料类似,在充放电过程中会产生严重的体积变化,导致其循环性能差,这也严重限制了其商业化应用。 近年来,国内外科研人员针对如何提高Sb基材料的电化学性能进行了广泛而深入的探索,并取得了诸多卓有成效的成果。 根据嵌锂类型不同,本文对近年来合金类型的Sb负极(包括纯的金属Sb、Sb基复合材料及Sb基合金),转换-合金类型的Sb基负极(包括Sb基氧化物、Sb基硫化物、Sb基硒化物)等Sb基负极材料的研究进展进行了系统性的概述,分析总结了各种Sb基负极材料的综合性能,并对今后锂离子电池Sb基负极材料的发展方向予以展望。
Sb基负极材料是合金机制负极材料的典型代表,金属Sb在脱嵌锂过程中能和锂发生可逆反应,生成Li-Sb合金储锂,即为合金化机理,具体如式(1)和(2)所示[4]:
Sb+Li++2e-
Li2Sb+ Li++e-
其中,当形成Li3Sb合金时,其理论嵌锂比容量为660 mA·h/g,为石墨负极储锂比容量的1.8倍,此外,Sb的嵌锂电位在0.8 V左右,能够有效地避免锂枝晶的出现,安全性能较高,并且脱嵌锂过程中电压平台非常平坦且相对较长,能够提供非常稳定的工作电压。 针对金属Sb负极材料脱嵌锂过程中的体积膨胀问题,制备不同结构的纳米Sb材料能明显改善其电化学性能。 材料纳米化可减轻Sb嵌锂过程的绝对体积变化,释放机械应力,抑制Sb的体积膨胀,提高Sb的循环性能,同时还可有效缩短锂离子在电极材料中的传输路径,提高电化学反应速率。 已报道过的Sb纳米材料主要有Sb纳米晶、Sb薄膜和Sb纳米球等[4,5,6,7,8]。
瑞士联邦理工学院的Kovalenko研究组[4]采用胶体化学合成的方法制备了尺寸为10和20 nm的单分散纳米晶,并对比了所制备纳米晶颗粒和微米级Sb颗粒作为锂离子电池负极材料时的电化学性能,研究结果表明,单分散纳米晶Sb颗粒用于锂离子电池负极材料时显示了优异的电化学循环稳定性;尤其是在大电流密度下循环充放电时,单分散纳米晶Sb颗粒表现出了明显优于微米级Sb颗粒的电化学性能(图1)。
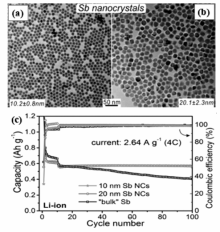 | 图1 Sb纳米晶透射电子显微镜照片(a,b) 和循环性能(c)[4]Fig.1 TEM images(a,b) and cycling performance(c) of Sb nanocrystals[4] |
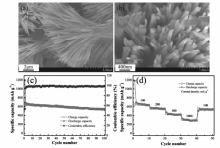
华南师范大学Zhao研究组[5,6]采用射频磁控溅射法制备了Sb薄膜,考察了不同溅射时间和溅射功率对Sb薄膜负极材料循环性能的影响,研究表明,随着溅射功率增加,Sb薄膜晶化程度加剧,结晶趋于完整,颗粒粗化。 在最优工艺条件下,以0.2 C进行循环充放电测试,循环20次后放电比容量依然能维持在323 mA·h/g。
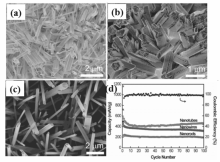
韩国汉阳大学Cho研究组[7]以SiO2微球为模板制备了空心Sb纳米球,该材料在0.2 C条件下充放电100次后仍可维持高达615 mA·h/g的放电比容量,明显优于纳米Sb颗粒的放电比容量。 此外,中南大学Ji研究组[8]以Ni纳米球为模板,通过置换反应制备了尺寸在70~100 nm之间的Sb空心球,该空心纳米球以100 mA/g电流密度充放电,循环50次后放电比容量维持在627.3 mA·h/g,接近金属Sb的理论比容量(660 mA·h/g);即使在1600 mA/g电流密度充放电,放电比容量依然高达435.6 mA·h/g,显示出优异的电化学性能(图2)。
 | 图2 Sb空心纳米球透射电子显微镜照片(a,b)、 循环性能(c)和倍率性能(d)[8]Fig.2 TEM images(a,b), cycling performance(c) and rate capability(d) of Sb hollow nanospheres[8] |
由此可见,制备纳米化金属Sb材料能有效提高电极材料的循环稳定性,但纳米化材料存在首次充放电循环不可逆容量大,实际应用过程中纳米化材料容易发生团聚,尤其是随着循环的进行,团聚现象愈加明显,纳米结构的优势也随之丧失,因此一般将纳米Sb材料与碳、TiO2等柔性材料进行复合,制备复合材料来提升电极材料的电化学性能。
目前,关于提高Sb基材料电化学循环稳定性报道最多的是广泛地引入各种碳材料、TiO2等柔性材料,制备Sb基复合材料。 以碳材料为例,碳材料可作为缓冲基质,缓解Sb负极材料脱嵌锂过程中的体积膨胀,提高循环稳定性,还可作为分散介质,防止Sb纳米颗粒发生团聚。 另外,碳材料还可作为电极材料与集流体接触的导电通道,起到增加电极材料导电性和稳定电极结构的作用,从而提高电极材料的循环性能。
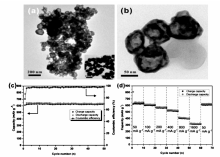
澳大利亚迪肯大学Glushenkov研究组[9]以Sb粉和石墨粉为原料,采用磁力球磨的方法制备了Sb-C复合材料,并比较了不同球磨方式对所制备复合材料性能的影响,最优工艺条件下制备的Sb-C复合材料在230 mA/g电流密度下,充放电循环250次后,依然能维持550 mA·h/g的高放电比容量,展示了良好的电化学循环稳定性。 中国科学技术大学Qian研究组[10]使用C2H2气体还原Sb2O3,同时C2H2分解,在还原得到的Sb表面沉积一层碳,一步法制备了微米棒状的Sb/C复合材料,该材料在100 mA/g电流密度下,充放电循环100次后可保持478.8 mA·h/g的比容量;此外,Sb/C复合材料也显示了优异的倍率充放电性能,即使在500 mA/g电流密度下,该材料依然能释放出369.7 mA·h/g的放电比容量(图3)。 华南理工大学Zhu研究组[11]以空心SnO2为内核,通过水热法在其表面包覆碳层,随后在Ar/H2混合气下热处理得到蛋黄-蛋壳结构的Sn@C空心球,然后在SbCl3溶液中发生置换反应,最终得到蛋黄-蛋壳结构Sb@C纳米空心球。 该纳米空心球在50 mA/g电流密度下充放电100次后,放电比容量保持在525 mA·h/g;即使在1000 mA/g电流密度下充放电300次后,该材料放电比容量依然能达到405 mA·h/g(图4),作者分析认为,该Sb@C纳米空心球优异的电化学性能主要得益于其巧妙的构造,能有效缓冲充放电过程中Sb的体积变化。 此外,碳纳米管、碳纳米纤维、石墨烯及无定形碳等碳材料也被应用于制备Sb-C复合材料,并且显示了较优异的电化学性能[12,13,14,15]。
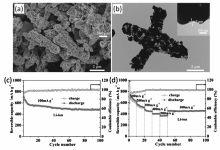 | 图3 微米棒状Sb-C复合材料扫描电子显微镜照片(a)、透射电子显微镜照片(b)、 循环性能(c)及倍率性能(d)[10]Fig.3 SEM image(a), TEM image(b), cycling performance(c) and rate capability(d) of rod-like Sb-C composite[10] |
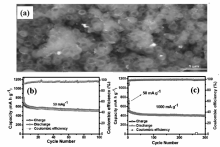 | 图4 蛋黄-蛋壳结构Sb@C纳米空心球扫描电子显微镜照片(a)和循环性能(b,c)[11]Fig.4 SEM image(a) and cycling performance(b,c) of hollow Sb@C yolk-shell nanospheres[11] |
由于TiO2在锂离子可逆嵌入和脱出时伴随很小的体积变化,且TiO2成本低、污染小,因此将TiO2与金属Sb进行复合也成为提高Sb基负极材料循环性能的途径之一[15,16,17]。 吉林大学Yi等[16]以商业Sb粉为原料,采用低温氧化、高温还原的方法,简单快速地制备了一维的豆荚状的Sb@TiO2复合材料,其中,不连续的Sb颗粒嵌入在一维连续的TiO2壳中,使得Sb颗粒间及Sb颗粒与TiO2壳之间存在大量空隙,能有效缓解Sb在脱嵌锂过程中的体积膨胀,提高循环稳定性。 该复合材料在100 mA/g电流密度下,100次循环后可维持450.2 mA·h/g放电比容量;此外,在2000 mA/g电流密度下,仍可释放出340.2 mA·h/g放电比容量。
此外,Al2O3和TiC等缓冲基质应用于Sb负极材料中也有报道[18,19,20],可以显著改善Sb负极材料的循环性能。
通过构建Sb-M合金,引入缓冲基质M来提升Sb负极材料的循环稳定性也是一种常规的方法,这里M可以是对锂惰性的金属,也可以是对锂活性的金属,当Sb与Li反应形成Li xSb合金时,M可以作为缓冲基质缓解Sb脱嵌锂过程中的体积变化。 目前,已报道的用于锂离子电池负极材料的Sb-M合金主要有Co-Sb[21,22,23]、Cu-Sb[24,25]、Ni-Sb[26,27,28]、Fe-Sb[26,29]、Mo-Sb[30,31]、Zn-Sb[32]、Sn-Sb[33,34,35]、In-Sb[36]、Al-Sb[37]等。
中南大学Ji研究组[28]以Ni纳米球为模板,利用置换反应制备NiSb合金的空心球,该空心球在50 mA/g的电流密度下,充放电循环50次后仍可保持420 mA·h/g的比容量,接近于其理论比容量446 mA·h/g;同时,该NiSb合金空心球也显示了优异的倍率充放电性能,在800 mA/g电流密度下,依然能维持352 mA·h/g的放电比容量(图5),作者分析认为,该材料优异的电化学循环稳定性主要归因于其独特的空心结构,能有效缓解充放电过程中产生的体积变化;此外,Ni的引入还可起到增加材料导电性及作为缓冲基体缓解体积膨胀的作用。 美国德克萨斯大学奥斯汀分校Manthiram研究组[31]通过机械合金化法制备了Mo3Sb7-C复合材料,该材料在100 mA/g电流密度下,循环充放电80次,放电质量比容量和体积比容量分别为518 mA·h/g和907 mA·h/cm3,体积比容量为石墨负极的3倍之多,显示出较优异的电化学性能。 复旦大学Zheng研究组[32]采用化学气相沉积(CVD)法直接在铜箔集流体上生长了一维的Zn4Sb3纳米结构,包括纳米管、纳米线和纳米棒等,其中Zn4Sb3纳米管显示出最优的电化学性能,在100 mA/g电流密度下,循环充放电100次,放电比容量依然能保持在450 mA·h/g(图6),优异的电化学性能主要由于一维结构及空心管结构,能有效缓解Sb脱嵌锂时的体积变化,此外,该方法制备的电极无需使用导电剂和粘结剂,还可用于制备其它锂离子电池负极材料。
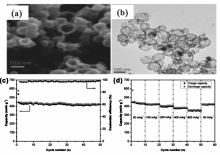 | 图5 NiSb纳米空心球扫描电子显微镜照片(a)、透射电子显微镜照片(b)、 循环性能(c)和倍率性能(d)[28]Fig.5 SEM image(a), TEM image(b), cycling performance(c) and rate capability(d) of NiSb hollow nanospheres[28] |
转换-合金类Sb基负极材料主要包括Sb基氧化物、Sb基硫化物以及Sb基硒化物,其嵌锂机制分为两步,第一步为转换反应,第二步为合金反应,反应式如式(3)和(4)所示:
SbxM+2Li++2e-→xSb+Li2M(M+O,S or Se, etc.)(3)
Sb+yLi++ye-
作为锂离子电池负极材料的Sb基氧化物主要是指Sb2
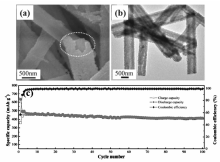 | 图7 Sb2O4空心管扫描电子显微镜照片(a)、 透射电子显微镜照片(b)和循环性能(c)[42]Fig.7 SEM image(a), TEM image(b), and cycling performance(c) of Sb2O4 hollow tubes[42] |
Sb基氧化物材料相比金属Sb具有更高的理论储锂比容量,且价格更加便宜,是一种极具应用潜力的锂离子电池负极材料。
硫化锑(Sb2S3)是辉锑矿的主要成分,一种重要的V~VI族直接带隙半导体材料。研究表明,锑的硫化物Sb2S3也具有储锂能力,储锂机理与Sb2O3类似,也是一类转换-合金机制的负极材料,1 mol的Sb2S3最多可与12 mol锂离子反应,由此可知Sb2S3的最高理论嵌锂比容量为947 mA·h/g。由于Sb2S3具有原料来源丰富,比容量高,易于制备等优点,是一种非常有潜力的锂离子电池负极材料,制备方法一般有水热(溶剂热)法[45,46,47,48]、回流法[49]、固相反应法[50]等。吉林大学Yi等[48]采用水热法制备了束状的Sb2S3材料,该材料是由大量的一维Sb2S3纳米线组合而成,作为锂离子电池负极材料时,该材料显示了优异的电化学性能。在100 mA/g电流密度下,循环充放电100次后,放电比容量维持在548 mA·h/g;即使在1000 mA/g电流密度下,依然能释放出300.5 mA·h/g的放电比容量(图8)。韩国首尔大学Park等[50]采用高能球磨法制备了Sb2S3和Sb2S3/C复合材料,其中Sb2S3/C复合材料在100 mA/g电流密度下,循环充放电100次后,放电比容量还能维持600 mA·h/g,显示了高容量特性。以色列耶路撒冷希伯莱大学Prikhodchenko等[51]首先通过H2S对制备的石墨烯-Sb5+溶液进行处理,然后热处理得到石墨烯包覆的Sb2S3@Graphene复合材料,该材料应用于锂离子电池负极材料时,在250 mA/g电流密度下,循环充放电50次后,放电比容量高达720 mA·h/g;即使在2000 mA/g电流密度下,放电比容量依然能有480 mA·h/g以上的放电比容量。该复合材料展现的高比容量和大电流充放电特性可归因于Sb2S3的纳米尺寸及石墨烯的高导电性和柔性性质,二者协同作用能有效提高复合材料的电化学性能。
与Sb2S3性质类似,Sb2Se3也是一种具有层状结构属于V~VI族直接带隙半导体材料,因具有光敏性、光电导性和热电效应等物理性质,在微波器件、热电和光电设计以及红外光谱等领域有着广泛的应用。 此外,Sb2Se3也具有较高的储锂比容量,在锂离子电池领域应用前景也比较广阔。Sb2Se3的储锂机理与Sb2O3、Sb2S3类似,反应过程中最多有12 mol的锂离子参与,由此计算得到Sb2Se3的最高理论储锂比容量为670 mA·h/g,为石墨负极材料的1.8倍,因此Sb2Se3材料在锂离子电池中的应用也得到了科研工作者的极大关注。
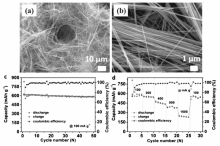 | 图9 Sb2Se3纳米线扫描电子显微镜照片(a,b)、 循环性能(c)和倍率性能(d)[52]Fig.9 SEM images(a,b), cycling performance(c), and rate capability(d) of Sb2Se3 nanowires[52] |
目前,报道的Sb2Se3的制备方法主要是水热(溶剂热)法[52,53]、脉冲激光沉积法[54,55]等。 武汉理工大学Luo等[52]采用水热法和真空抽滤过程,制备了超长Sb2Se3纳米线和由该纳米线组装的自支撑膜,该膜显示了极好的柔韧性和完整性。 作为锂离子电池负极材料时,该自支撑膜展现了出色的电化学性能,在100 mA/g电流密度下,循环充放电50次后,放电比容量还能保持584 mA·h/g;即使在1600 mA/g电流密度下,该材料依然能释放出255 mA·h/g的放电比容量(图9)。 复旦大学Xue等[54]通过脉冲激光沉积工艺制备了Sb2Se3薄膜,在100 mA/g电流密度下,循环充放电100次后,该Sb2Se3薄膜依然能维持530.5 mA·h/g的放电比容量。 分析认为,二维纳米薄膜材料能有效释放充放电过程中产生的机械应力,抑制体积膨胀,提高Sb2Se3的循环稳定性。
综上所述,Sb基材料作为一类合金机制(转换-合金机制)的锂离子电池负极材料,因具有储锂比容量高、原材料来源丰富、成本较低、易于合成且安全性好等优点受到广泛关注,但Sb基负极材料自身导电性差,充放电过程中体积膨胀明显,循环性能不理想等问题,直接限制了其商业化应用。 目前,通过优化材料结构、掺入基质、制备复合材料等途径改善Sb基负极材料的电化学性能,并取得了一定的研究成果,但是单一途径难以全面改善Sb基材料的性能,通过多种方法综合来改善Sb基材料的性能将成为今后研究工作的重点。 Sb基氧化物、Sb基硫化物等高比容量材料,由于第一步转换反应可逆程度较低,因此造成了首次充放电不可逆容量较大,如何提高第一步转换反应的可逆程度,从而最终达到较高的可逆充放电比容量也是今后研究的主要方向之一。 总之,作为极具应用潜力的锂离子电池负极材料,Sb基材料的研究工作还需进一步深入,使Sb基材料能早日满足动力锂离子电池负极的实际应用要求。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|