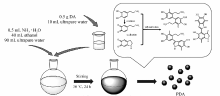
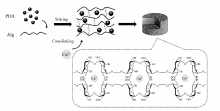
生物大分子海藻酸(Alg)由于其安全、无毒、可生物降解等特性而被广泛应用于组织工程领域。 受海洋贻贝蛋白结构的启发,多巴胺(DA)具有优异的粘附性能,在碱性水溶液条件下可发生氧化自聚形成聚多巴胺(PDA)。 以Alg为基体,加入PDA纳米粒子复合,并通过冷冻干燥法制备得到Alg/PDA多孔支架材料。 结果表明,Alg/PDA多孔支架材料具有较为规整的内部结构。 改变Alg质量浓度,Alg/PDA支架材料的孔径可控制在60~120 μm之间,孔隙率可控于80%~88%。 所得的支架材料具有适宜大小的孔径和孔隙率,结果表明支架材料对细胞无毒副作用。
Alginate(Alg) is widely used in the field of tissue engineering because of its safe, non-toxic and biodegradable properties. Inspired by mussel adhesive protein, dopamine(DA) has excellent adhesion property and can self-oxidize to polydopamine(PDA) in weak basic buffer solution. Alg/PDA porous scaffolds were prepared by freeze-dry of Alg and PDA mixture. The results show that Alg/PDA porous scaffolds have relatively homogeneous internal structure. By changing the mass concentration of Alg, the pore size of the Alg/PDA complex scaffolds can be limited to 60~120 μm, and the porosity of the scaffolds can be controlled in the range of 80%~88% which is appropriate for the growth of bond cells. The biocompatibility results indicate that the scaffolds show low cytotoxicity.
生物体的组织具有很好的再生和自我修复能力,小的缺损基本可以完全自我愈合。 但当缺损组织超出了一个临界极限,则不能完成自我修复,所以需要借助于外科手术进行植入治疗。 这种修复通常采用自体骨、异体骨、异种骨及其它人工材料来填充破损处以促进骨细胞的增长,加快愈合速度[1]。 然而,传统骨修复材料在实际应用中均有不同程度的缺陷,因而,研制理想的骨修复材料成为了当前生物材料学领域的研究重点。
现有的人工骨修复材料主要有金属材料、无机非金属材料和高分子材料。 然而,前二者存在生物相容性差、与周围组织界面的结合性差、降解等问题而受到限制。 生物大分子和合成高分子等高分子材料由于其较好的结构可调性、生物相容性和降解性等优点被广泛地用来构筑支架材料[2]。 科学家们制备了多种不同结构和性能的大分子支架材料,包括胶原、明胶、海藻酸(Alg)、壳聚糖等生物大分子和聚羟基脂肪酸酯(PHA)、聚乳酸(PLA)、聚乙醇酸(PGA)、聚已内酯(PCL)及其共聚物等合成高分子,以及它们与(非)金属的复合材料[3,4,5],研究了这些材料对细胞的黏附、增殖与分化性能及对缺损组织的再生性能,取得了较好的研究成果。 然而,构建一种与组织界面作用力强,支架的结构、力学强度、降解周期与周围组织相匹配的大分子支架材料还面临着极大的挑战。
Alg是一种从褐藻中提取出来的水溶性线性高分子,具有良好的吸水性、透氧性、生物相容性[6,7],它是由 β-D-甘露糖醛酸(M单元)与 α-L-古罗糖醛酸(G单元)通过 β-1,4-糖苷键连接并由不同比例的GM、MM和GG片段组成的共聚物[8],因此其降解产物为无毒的多糖。 Alg分子上的羧基可与Ca2+发生静电作用而交联,形成一种“蛋壳”结构[9];也可与二胺等物质发生化学交联形成多孔结构。 因而,Alg被广泛地应用于组织再生修复等领域[10]。 Wong等[11]曾将Alg多孔材料用作肝组织支架材料,结果表明肝细胞可以附着在支架材料上增殖分化。
但是,当单独用于组织工程材料时,Alg盐的强亲水性及缺乏表面活性而导致其与细胞的结合能力较差,将Alg与细胞粘附性较好的生物材料进行共混可有效改善该性能。 Florczyk等[12]将海藻酸钠与壳聚糖溶液混合,使用冷冻干燥法制备多孔支架材料,结果表明,支架具有良好的孔隙结构和细胞粘附性。 Sun等[13]将明胶混入甲基丙烯酸酯化的海藻酸钠构建支架材料,与单一的海藻酸钠支架相比,复合材料机械模量提高,细胞增殖速率提高。 Balakrishnan等[14]利用部分氧化的Alg和明胶在硼砂环境下的自交联制备水凝胶,实验表明,水凝胶与小鼠软骨细胞的相容性较好,能促进软骨细胞向体内生长。
海洋贻贝足腺细胞分泌的粘附蛋白具有超强的粘附性,可以紧密附着在各种基材的表面。 这种蛋白中存在约有质量分数30%的 L-多巴( L-DOPA)和质量分数15%的赖氨酸残基,是粘附蛋白具有超强粘附力的关键因素[15,16]。 多巴胺(dopamine,DA)结合了多巴中的邻苯二酚基团和赖氨酸的氨基基团,可与多种基材发生氢键、配位键、共价键作用,因而也具有优异的粘附性能。 在碱性水溶液条件下,DA可以被氧化发生自聚形成聚多巴胺纳米粒子(PDA)。 PDA具有良好的粘合性和生物相容性;而且,通过调节反应条件,可以调控PDA的粒径大小和分布[17]。 同时,大量研究已经证明DA及PDA对细胞有较好的亲和性,能较好的促进细胞的粘附与增殖。 Cui等[18]使用DA改性高碘酸盐氧化的Alg,在1-乙基-3-(3-二甲氨丙基)碳二亚胺盐酸盐/ N-羟基琥珀酰亚胺(EDC/NHS)的催化下Alg与胶原交联形成一种水凝胶生物粘合剂,结果显示DA的取代度对粘合剂的溶胀率、降解率均有改善作用。 Zhang等[19]发现,DA改性的Alg水凝胶能促进骨细胞的增殖与分化,可应用在骨修复领域中。 Scognamiglio等[20]研究发现,DA改性的Alg制备的多糖膜的粘附性和生物相容性有所改善。
本文首先通过调节DA的自聚反应条件,制备出粒径大小、分布可控的PDA纳米粒子。 然后,将PDA与Alg溶液混合进行共混改性,以改善Alg的细胞粘附性,同时一定程度上提高Alg的力学性能,通过冷冻干燥法制备得到PDA改性的Alg支架材料,并对其性能进行了详细研究。
多巴胺盐酸盐(DA·HCl)(≥98%)、海藻酸钠(Alg)和三(羟甲基)氨基甲烷(Tris)(≥99.9%)购自阿拉丁试剂(上海)有限公司);乙醇、氨水、盐酸、氯化钙、氯化钠、氯化钾、氧化镁、碳酸氢钠和碳酸钠均为分析纯,购自国药集团化学试剂有限公司。 所有试剂均直接使用。
DF-101B型集热式磁力加热搅拌器(金坛市医疗仪器厂);Coolsafe 110-4型冷冻干燥机(丹麦LaboGene公司);ZetaPALS型电位及纳米粒度分析仪(美国布鲁克海文仪器公司);S-100型扫描电子显微镜(SEM,日本日立株式会社);JEM-2100型透射电子显微镜(TEM,日本电子株式会社);VHX-1000C型超景深三维显微镜(基恩士(香港)有限公司);5967型万能试验机(英国英斯特朗有限公司)。
将0.5 mL的氨水加入到乙醇(40 mL)和超纯水(90 mL)的混合溶液中,在30 ℃下搅拌30 min,然后将0.5 g多巴胺溶解在10 mL超纯水中分别加入到以上溶液中,30 ℃下反应24 h,所得产物透析后冷冻干燥,标记为PDANPs-0.5。 如Scheme 1所示。
利用Zeta电位仪及纳米粒度分析仪对PDA NPs-0.5的粒径大小和分布进行测定,并用SEM和TEM对纳米粒子的形貌进行观测。
分别将0.6、0.9和1.2 g海藻酸(Alg)加入到30 mL超纯水中,待其完全溶解后,得到质量分数为2%、3%和4%的Alg水溶液;将15 mg PDA NPs分别加入到上述溶液中,超声搅拌24 h,所得产物冷冻干燥48 h,使用质量分数为1%、3%、5%和10%的CaCl2水溶液对产物进行交联,所得样品再次冷冻干燥48 h,最后得到均匀支架Alg- w/PDA。 其中 w为制备支架所用Alg溶液的质量分数。 如Scheme 2所示。
1)Alg/PDA多孔支架结构和机械性能分析
利用万能试验机对支架材料的机械性能进行测定,以1 mm/min的加载速度测试支架材料的压缩强度。 用超景深显微镜观察Alg/PDA多孔支架的内部结构与形貌。支架材料溶胀率的测定是将多孔支架材料分别浸入足量的蒸馏水中,每隔一定时间取出(20 min、40 min、1 h、2 h、3 h、4 h、5 h和6 h),用滤纸吸去支架材料表面多余的水分,称重并记录不同时间支架材料的质量。 通过式(1)可计算得到支架材料的溶胀率( SR):
式中, mt为支架材料在溶胀 t时的质量(g), m0为支架材料的初始质量(g)。
利用比重瓶法[21,22]测试Alg/PDA多孔支架的孔隙率,首先称量出待测支架的质量 m1(g),在比重瓶中装满去离子水称重为 m2(g);将样品放入比重瓶中,充分用水浸湿,然后再加满水,称重为 m3(g);将浸满了水的样品取出,称量剩余的水和比重计的质量为 m4(g)。 通过以上的数据可计算得到支架孔隙部分的总体积 Vp,支架实体部分总体积 Vs以及和支架孔隙率 ε,如式(2)所示。
2)Alg/PDA多孔支架的降解性与生物相容性
将Alg/PDA多孔支架材料置于SBF溶液中进行体外模拟降解实验以考察其生物降解性能(参照文献[23]配制SBF)。将支架材料用超纯水超声洗涤,60 ℃真空干燥箱中干燥24 h并用紫外灯照射30 min备用;将样品置于装有30 mL SBF溶液的离心管中,并将其放于水浴恒温振荡器中,37 ℃、100 r/min下进行体外模拟降解实验.每3天更换1次SBF模拟体液,每6 d取样,样品用超纯水洗涤后真空干燥24 h后称其干重。 降解率( DR)按照式(3)进行计算:
式中, m0为支架材料的初始质量(g), md为支架材料的降解后的质量(g)。
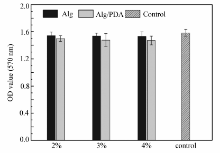
将Alg/PDA多孔材料与10 mL预先配制的基础培养液(含10%小牛血清和1%青霉素及链霉素)混合,在37 ℃、5%CO2、95%湿度的无菌环境下浸泡36 h,得到支架材料浸提液。 将L929细胞以1×104个/mL的密度接种于96孔细胞培养板中,每孔接种100 μL.分别设置实验组、阴性和空白组(空白组只加等量完全培养基),每组重复5孔。 在37 ℃、5%CO2、95%湿度的无菌环境中培养24 h后,吸出孔内培养液,实验组每孔分别加入100 μL Alg/PDA多孔支架材料浸提液,对照组直接加入100 μL 基础培养液,继续在无菌环境下培养24 h。 在96孔板的样品中加入20 μL MTT溶液,用锡纸包裹培养板,置于无菌环境继续培养4 h。 取出96孔板,小心清除孔内MTT溶液,再向各孔中加入150 μL的DMSO溶液,震荡10 min后,利用酶标仪测定式样组吸光度(OD值)。 测定波长为570 nm,参考波长为630 nm,测定结果取平均值。
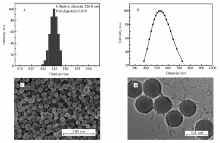
DA在碱性溶液中自聚形成PDA纳米粒子,用Zeta电位及纳米粒度分析仪对PDA NPs的粒径大小和粒径分布进行测定,并用SEM和TEM对PDA NPs形貌进行观测,如图1所示。图1 A和图1 B中可以看出,PDA NPs的粒径为526.8 nm,PDI为0.039,说明可以得到分布均匀的PDA NPs。 从图1 C中可知,制备得到的PDA NPs为均匀的球状粒子,其粒径约为450 nm。图1 D中可知,TEM照片测得PDA NPs的粒径为470 nm左右,与SEM测得的结果相近。 但SEM和TEM测试的是干态、无溶胀状态下的PDA NPs粒径,因而其测得的粒子尺寸较纳米粒度仪的测量小。
骨修复材料应能在细胞生长的初期为细胞提供支撑,所以支架材料的力学强度也是骨修复效果的一个重要条件。 使用万能试验机测试支架材料的压缩模量,从图2 B可以看出,交联剂质量分数为3%时,支架材料的压缩模量最大。 为了保证支架材料的强度,选用3%的CaCl2交联剂,以探究不同的Alg质量浓度对支架材料性能的影响。
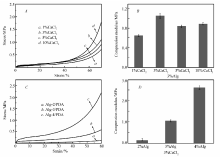 | 图2 不同Alg质量浓度支架材料的压缩模量Fig.2 The compression modulus of scaffolds with different Alg mass concentrations |
Alg-2/PDA、Alg-3/PDA和Alg-4/PDA的压缩模量分别为0.143、1.062和2.638 MPa,支架材料中Alg质量浓度越高,其压缩模量也越大。 Alg质量浓度增大,单位体积内海藻酸单元数量增多,体系的交联程度也增大,从而形成更为致密的交联网络状结构;而且致密度的增加还会使单位体积内海藻酸分子间的氢键增加,分子间不易滑移,抵抗外力的能力也相对增强,显示出较高的压缩模量。
骨修复中骨细胞可以粘附在支架材料的孔洞之中进行增殖、分化,并及时运输氧气、营养物质和代谢废物,因而,支架材料中连续贯通的孔结构对骨修复有重要作用。 为验证Alg-a/PDA支架材料的内部结构,用超景深显微镜对支架材料进行观察,结果如图3所示。 通过冷冻干燥法制备的支架材料内部充满大量相互连通的不规则孔洞,未加入PDA的支架材料孔径较大,在80~250 μm之间,但其网状结构存在较多缺损,孔径分布不均。 加入PDA的支架材料其孔径也与Alg的质量浓度有关,Alg-2/PDA、Alg-3/PDA和Alg-4/PDA的孔径分别为120、80和60 μm,说明孔径的大小随着海藻酸水溶液质量浓度的增加而减小。 海藻酸溶液在冷冻时,其中的水分凝固成冰晶,与Alg发生相分离,在冷冻干燥的过程中,冰晶直接升华成水蒸气,原冰晶的位置便形成了孔洞结构。 海藻酸溶液中的水为连续相,因此最终形成的孔洞之间也相互连通。 同时,海藻酸质量浓度的增加使其粘度也随之增加,阻碍了水分子移动,导致水结晶时无法形成较大的冰晶,因此孔径的大小与海藻酸溶液的质量浓度成负相关。 一般,成长中的骨细胞生长所需的孔径在75~250 μm之间[24],Alg/PDA的孔径范围是60~120 μm,满足骨细胞生长的要求。
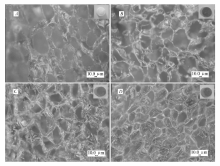 | 图3 3%CaCl2交联的支架材料的孔径 A.Alg; B.Alg-2/PDA; C.Alg-3/PDA; D.Alg-4/PDAFig.3 Pore size of scaffolds crosslinked by 3%CaCl2 |
除了孔径大小之外,孔隙率也是骨修复材料的重要指标之一[25,26]。 大的孔隙率可使支架材料的比表面积增加,有利于细胞大量地粘附、生长,支架材料内部细胞的物质交换也都依赖于高孔隙率的多孔结构。 因而,用比重瓶法对支架材料的孔隙率( ε)进行测定,结果如表1所示。 结果表明,与仅用Alg制备的支架材料相比,加入PDA制备的支架材料的孔隙率显著增大。 Alg-a/PDA支架材料的孔隙率在80%~88%之间,基本可以满足骨修复材料对孔隙率的要求。
| 表1 支架材料的孔隙率 Table 1 Porosity of scaffolds |
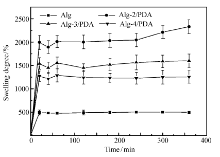
将支架材料置于去离子水中进行溶胀试验,溶胀率与时间的关系曲线如图4所示。 可见,PDA对支架材料的溶胀率有显著提升作用,加入PDA的支架材料的溶胀率均高于1200%,而只
用Alg制备的支架材料的溶胀率只有500%。 支架材料的溶胀率与支架内部的孔径大小和亲水基团的数量有关。 PDA的加入在将支架材料内部引入大量的亲水基团,同时Alg分子链上也含有大量的—OH、—COOH,可以与水分子之间形成氢键而吸收大量的水。 当亲水基团达到一定限度时,支架材料内部的孔洞体积将影响其溶胀率。 保持冻干前大分子溶液体积相同,但Alg质量浓度不同导致每个样品的含水量也不同,2%质量浓度的Alg溶液所制成的样品含水量最多,因而,所留下的孔洞体积最大,可以吸收更多的水分。 因此,支架材料的Alg质量浓度越低,其溶胀率越高。 由于支架材料具有互相连通的孔结构,去离子水可通过在连通孔中进行对流,从而快速充满支架材料内部,致使支架材料的溶胀速率迅速增大,在20 min以内就已经达到了溶胀平衡。
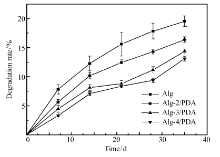
为考察支架材料的降解性,将支架材料置于SBF模拟体液中进行体外降解实验,结果如图5所示。 可见,随着降解时间延长,支架材料的降解率增大;未加入PDA的支架材料降解速率大于加入多巴胺的支架,且随着Alg质量浓度的增大,相同降解时间内支架材料的降解率逐渐减小。 这可能是因为低质量浓度Alg制成的支架孔径较大、溶胀率较高,导致SBF模拟体液更容易渗透到支架内部,更快地促使其降解。 在35 d后,Alg-a/PDA多孔支架的降解率均小于20%,说明支架材料在生理条件下可以保持较长时间的稳定以保证骨细胞生长所需。
利用多巴胺(DA)在碱性条件下的自聚得到粒径分布均匀的聚多巴胺(PDA)纳米粒子。 将PDA与海藻酸(Alg)复合,并用Ca2+进行交联后,制备了含有多孔结构的支架材料。 所得支架材料的溶胀率大于1200%,孔径大小可调控在60~120 μm范围,孔隙率在80%~88%;该支架材料有较高的压缩模量、可控的降解速度与生物相容性;且可通过调控Alg的质量浓度,实现对支架材料的结构与性能的控制,Alg质量浓度越大,支架材料的压缩模量越大而降解速度较慢。 支架材料对骨细胞的粘附、生长、分化以及在体内对骨修复的研究正在进行中。 所得的Alg/PDA支架材料有望在骨修复领域有潜在的应用价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|