石墨相氮化碳( g-C3N4)作为一种新型的非金属有机半导体材料在光催化领域受到了人们的广泛关注。 为进一步改善它的光电化学性能,本文利用种子生长法和一锅法相结合制备了Au纳米棒/ g-C3N4复合材料。 结果表明,金纳米棒降低了载流子的复合率,使复合材料表现出了较好的光电化学性能。 该材料光电流密度可达到17.18 μA/cm2(相对于可逆氢电极),是纯的石墨相氮化碳材料的2.5倍。
Graphite phase carbon nitride( g-C3N4), a new type and non-metallic organic semiconductor material has attracted widespread attention in the photocatalysis area. In this paper, we combined a seed-mediated growth way with one pot method to synthesize Au nanorods/ g-C3N4 composites to improve its photoelectrochemical properties. The results demonstrate that Au nanorods can decrease the recombination rate of photogenerated carriers. Therefore, the composites present excellent photoelectrochemical properties, and the photocurrent density can reach 17.18 μA/cm2( vs RHE)which is 2.5 times higher than that of pristine samples.
自Honda和Fujishima在光催化方面所做的开创性工作以来,在绿色能源生产方面,用光催化剂辅助太阳能光解水生产氢能源满足人们对于能源的需求已经变成了非常有吸引力的一个领域。 许多半导体材料具有紫外光或可见光活性[1],但是到目前为止,开发稳定性好,来源丰富,能在可见光下有效工作的光催化剂仍然是我们所面临的巨大挑战[2]。 为了构筑一种效率高、无污染的光催化剂,近些年来人们在利用非金属材料合成新的光催化剂方面做了大量的研究[3]。
作为石墨的类似物,石墨相氮化碳( g-C3N4)是一种带隙为2.7 eV的二维半导体聚合物,它是由碳和氮元素组成的一种可持续的、环境友好的有机半导体材料[4,5]。 由于原料便宜、丰富,因此可以很大程度地降低生产成本,另外它在可见光区具有很强的吸收,能高效地利用太阳光,提高光电转换效率[6,7]。 并且它的导带位置比较高,所以在很小的偏压下就能够产生光电流。 自福州大学王老师课题组首次报道将石墨相氮化碳作为光解水的半导体材料以来,人们就开始尝试通过热聚合的方法将各种富氮的有机物作为前驱体去合成氮化碳[8,9]。 通过大量的实验证明拥有共轭大 π体系的石墨相氮化碳有非常好的热力学和化学稳定性,因此,它是一种很有发展前景的光解水材料[10]。 从热力学角度来讲将水分解为H2气和O2气,其所需的吉布斯自由能为237 kJ/mol,下面的公式是其理论上可进行的反应:
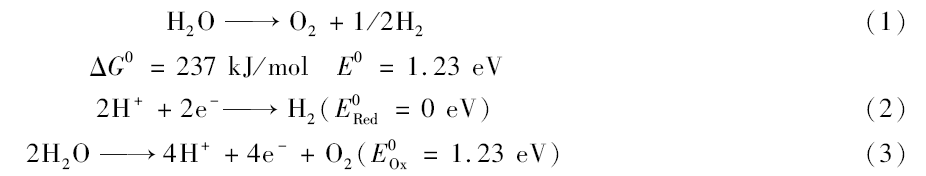
然而,由于石墨相氮化碳的导电性较差,光生电子-空穴复合速率较快,以及其水氧化动力学反应慢,使得氮化碳在光催化分解水方面的应用受到了限制[11]。 通过采用掺杂或改性等调控手段,提高窄禁带半导体材料的导电性,或者调节半导体材料的电子结构及能带结构,拓宽其对可见光光谱响应范围,可以进一步提高其光催化性能。 例如,通过在材料表面负载一些助催化剂可以有效地提升光生电子-空穴的分离[12]。 另外,也可以设计具有孔隙结构的,或者与其它过渡金属结合的复合光催化材料[13,14]进一步提高单一催化剂的光催化性能。 而贵金属纳米粒子,如Au、Ag、Pt等,因为它们具有强表面等离子效应(SPR),并可以通过改变其形貌、尺寸来调控,所以具有很强的可见光吸收能力[15,16]。 等离子体纳米结构兼具电磁场、散射电磁辐射或将光子的能量转换成热的独特能力使得它们适合于多种应用。 等离子体金属已经用于单分子光谱[17]、表面增强拉曼光谱[18]、生物系统中的分子传感检测[19]、太阳能电池[20]等方面。
本文研究了贵金属金对石墨相氮化碳光电化学性能的影响。 由于金纳米棒作为电子传输通道,加速了光生电子的转移,促进了石墨相氮化碳导带上的电子快速注入到金纳米棒,从而加快了载流子的分离。 在该复合体系中,电子将从费米能级较高的半导体材料跃迁到费米能级较低的贵金属金上,直到半导体与贵金属的费米能级相同为止,且会使该体系的整体的费米能级向电势更负的方向移动,提高复合系统的能量,这样就提高了界面电荷转移过程的效率,从而提高了催化剂的活性[21,22]。 因此,与单一的石墨相光催化体系对比而言,我们制备的复合光催化剂表现出了非常好的光电转换性能。 该研究对进一步有效地提高石墨相氮化碳材料的光电化学性能提供了新的方法和思路。
氯金酸(HAuCl4·4H2O)、硝酸银(AgNO3)、三聚氰酸(C3H3N3O3)、硼氢化钠(NaBH4)、十六烷基三甲基溴化铵(CTAB,C19H42BrN),纯度均为99%,上海广诺化学试剂有限公司。 抗坏血酸(C6H8O6)、2,4-二氨基-6-苯-1,3,5-三嗪均为分析纯,购买于国药集团化学试剂有限公司。 其它试剂均为分析纯,实验室用水为超纯水。
所有的电化学测试均是在CHI660型电化学工作站上完成的。 实验采用的是常规的三电极体系:生长有薄膜的导电玻璃作为工作电极,铂片是对电极,饱和甘汞电极是参比电极,采用的电解液为1 mol/L的氢氧化钠溶液,偏压为0.4 V(相对于可逆氢电极RHE)。 材料的形貌表征和元素分布测试用的是Carl Zeiss Ultra Plus型场发射扫描电子显微镜(SEM,德国蔡司公司)。 金纳米棒的透射表征用的是TECNAI G2 TF20型透射电子显微镜(TEM,美国FE公司)。 粉末单晶衍射分析采用PANalytical公司生产的X'Pert PRO射线衍射仪测试的。 采用的光源是配有AM1.5 G太阳光模拟片(HSX-F300,北京纽比特公司)的氙灯冷光源,光照强度为100 mW/cm2,使用前用标准晶体硅太阳能电池进行了校准。 红外光谱测定采用的是VERTEX-70型傅里叶红外光谱仪(FTIR,德国布鲁克公司)。 紫外吸收光谱(UV-Vis)是用Agilent-8453型紫外分光光度计(Agilent公司)在波长范围为200~800 nm测定的。 电化学阻抗光谱(EIS)测试频率范围为0.1 Hz~10 KHz, 荧光光谱(PL)测试的激发波长为365 nm,是在RF-540型荧光分光光度计(日本Shimazu公司)上完成的。 所有电化学测试的电极电势可用如下公式转换为可逆氢电极(RHE)的电势,具体转换公式如下: ERHE= ESCE+0.059pH+
1.2.1 Au种子液的制备 参照文献[23]方法准确量取浓度为10 mmol/L的氯金酸溶液125 μL,然后快速加入到已经配制好的浓度为100 mmol/L的5 mL CTAB溶液中,并将该混合溶液在30 ℃下搅拌均匀。 之后在搅拌的同时快速加入配制好的冰冷的0.3 mL 10 mmol/L的硼氢化钠溶液,将混合后的溶液搅拌均匀以后在30 ℃下存储备用。
1.2.2 制备Au纳米棒 参照文献[21]方法,分别量取浓度为10 mmol/L的氯金酸溶液2 mL,10 mmol/L的硝酸银溶液240 μL,100 mmol/L抗坏血酸溶液320 μL,48 μL的CTAB包裹的种子液按顺序加入到40 mL 100 mmol/L的CTAB溶液中,在30 ℃下混合搅拌均匀以后将其静置陈化2 h。 最后将上述溶液在12000 r/min转速下离心10 min,除去上清液以后,将底部沉淀分散于少量水中,即得到Au纳米棒的水溶液。
1.2.3 g-C3N4薄膜的制备 分别称量9 g的2,4-二氨基-6-苯-1,3,5-三嗪和6.5 g三聚氰酸前驱体粉末分散于200 mL的去离子水中,放置在室温下搅拌24 h,混合均匀以后,将其抽滤,并将抽滤以后的样品在80 ℃下烘干,研磨。 称取上述的混合物粉末1.3 g,均匀平铺在放有掺杂氟的SnO2透明导电玻璃(FTO)基底的坩埚中。 最后再将上述样品转移至管式炉中,快速通N2气30 min后在500 ℃下保持4 h,升温速率为2.3 ℃/min。 待管式炉降温至室温,取出样品,放在盛有蒸馏水的烧杯中超声处理,即可得到 g-C3N4薄膜。
1.2.4 Au/ g-C3N4复合薄膜的制备 称取1.3 g的2,4-二氨基-6-苯-1,3,5-三嗪和三聚氰酸的混合前驱体粉末,分散在制备好的浓度为7×10-4 mol/L的Au纳米棒水溶液中,搅拌均匀以后将其放置在烘箱中80 ℃条件下烘干研磨。 最后再称取一定量的上述混合粉末样品平铺在放有FTO基底的坩埚中。 其它的制备过程与上面制备纯的石墨相氮化碳薄膜的步骤相一致。 反应结束后即可得到Au/ g-C3N4复合薄膜。
制备的Au纳米棒的透射电子显微镜照片、扫描电子显微镜照片以及纯的石墨相氮化碳薄膜,Au与石墨相氮化碳薄膜的复合材料的扫描电子显微镜照片如图1所示。 由图1 A和1 B可见,制备的金纳米棒具有典型且规则的棒状结构,长度约为50 nm。图1 C是制备的纯石墨相氮化碳薄膜,这种薄膜呈现均一的大孔网状结构。 当进一步复合金纳米棒以后,该材料的形貌并未发生明显的变化,如图1 D所示。 为了进一步证明金纳米棒的存在,我们对所制备的样品做了能谱EDS元素分析,可以看到金纳米粒子是均匀分布在石墨相氮化碳材料上的,由于金的含量较少,所以金纳米粒子的分布是较为稀疏的,且无其它杂质元素的出现,说明我们成功制备了Au/ g-C3N4这种复合材料。
图2 A是制备的金纳米棒的液体紫外吸收光谱图。 由于不同粒径的金纳米粒子有不同的紫外吸收,随着长径比的增加会有两个不同的SPR吸收峰,横向SPR吸收峰(即短波长)约在510 nm处,而纵向SPR吸收峰在700 nm处。
 | 图2 制备的金纳米棒水溶液的紫外吸收( A)和不同样品的X射线电子衍射图( B),红外光谱图( C)Fig.2 Ultraviolet absorption of as-prepared gold nanorods water solution( A) and XRD patterns( B), FT-IR spectrua( C) of different samples |
为了进一步研究所制备的光催化材料的物质组成和晶体结构,我们对材料进行了XRD表征。 如图2 B所示,从图中可以看到,石墨相氮化碳在27.8°有明显的衍射峰,该衍射峰与石墨相氮化碳{002}晶面的衍射峰相对应。 复合Au纳米棒之后的石墨相氮化碳的衍射峰并没有发生明显的变化,且未观测到Au的衍射峰,这主要是由于在制备复合材料的过程中,Au纳米棒的含量很少(<5%),仪器检测不到。 但是复合了金纳米棒以后其衍射峰强度明显地减弱了,这主要是由于Au纳米棒的复合抑制了石墨相氮化碳纳米结构的生长。图2 C是制备的光催化材料的红外光谱图。 可以看到,在3200~3500 cm-1处有较宽的吸收峰,主要归因于N—H的伸缩振动模型和表面吸附的一些羟基官能团。 出现N—H伸缩振动表明,在氮化碳片层结构中有一些未完全聚合的氨基官能团存在。 在纯石墨相氮化碳中,1200~1650 cm-1处有一些强吸收峰,约在1241、1320、1405和1640 cm-1处,这些吸收峰可以与典型的C≡N杂环的伸缩振动模型相对应。 而在3290~3335 cm-1之间的吸收峰是N—H或C—H的伸缩振动模型,2161~2209 cm-1处的吸收峰是C≡N的振动模型,1570~1634 cm-1处的吸收峰是C=N的振动模型,810~880 cm-1的吸收峰是三嗪单元的CN杂环的平面外弯曲模式。 在复合了Au以后可以看到在818 cm-1处有明显的吸收峰,由于其它的Au—O振动峰与CN杂环的吸收峰相重合,所以没有额外的Au—O吸收峰出现。
2.2.1 光电流响应测试及分析图3分别是样品石墨相氮化碳薄膜,以及石墨相氮化碳与Au纳米棒复合以后的瞬态光电流测试曲线和 I-t曲线。 从图中可以看到,纯石墨相氮化碳的光生电子空穴复合率较高,因此光电流较小,约为7 μA(相对于可逆氢电极),在进一步复合了贵金属金纳米棒以后光电流有了明显的提高,是纯材料的2.5倍,可以达到17.18 μA(相对于可逆氢电极)。图3 B的 I-t曲线显示,在间隔光照的条件下,间隔时间为20 s,样品的光电流会迅速增大,主要是由于金纳米棒的复合使其能够捕获更多的太阳光,同时,金纳米棒可以提高氮化碳的导电性,可有效地促进光生载流子的分离,进而提高其光催化活性。 当无光照时,光电流急剧降低,光生电子空穴复合,使其光电流减小。 但是无论是在有光还是无光条件下,有金纳米棒复合的材料的光电流(图3曲线 b)均要比纯的石墨相氮化碳(图3曲线 a)的高,这也进一步说明了金纳米棒的复合有效地抑制了光生电子空穴的复合,使其光催化活性增加。
 | 图3 在可见光光照下得到的不同样品的光电流密度-电势( A)和 I-t曲线( B)Fig.3 The current density vs potential( A) and I-t( B) curves of g-C3N4( a) and Au/ g-C3N4( b) under light illumination(AM 1.5G 100 mW/cm2) |
2.2.2 光生电荷分离效率的测试及分析 为了更好地理解样品 g-C3N4以及Au/ g-C3N4的电荷动力学,我们用双氧水和亚硫酸钠两种空穴捕获剂(0.5 mol/L H2O2或者0.5 mol/L Na2SO3)加入到1 mol/L NaOH电解液中,对其电荷分离效率进行了测试。 整个光解水的光电流可以用以下公式描述:
Jabsorption是光子吸收速率的光电流密度, ηseparation是电荷载流子分离效率。
E( λ)是太阳光强,我们使用ASTM G-173-03作为太阳光强的参考, ηLH( λ)是光捕获效率,可以从光吸收计算出: ηLH=1-10-A。 当我们把空穴捕获剂(H2O2)加入到电解液之后,在水氧化的过程中,所有的空穴均到达电极与电解液界面( ηSurface Catalysis=1),因此,部分光生电子参加了水的氧化,如下公式:
因此,基于以上公式,我们很容易计算电荷分离效率:
如图4 A、4 B所示,在1.23 V( vs RHE)处,纯的 g-C3N4和Au/ g-C3N4的光电流密度分别为7.06和17.18 μA/cm2。 当向电解液中加入0.5 mol/L H2O2后,两种样品的光电流密度可达到7.29和41.44 μA/cm2(图4 A、4 B),通过对比可知,加入H2O2之后,样品的光电流密度均有所提高,因此可以表明H2O2是一个非常好的空穴捕获剂,它可收集光电阳极的光生空穴,减少空穴与电子的复合。 此外,当向电解液加入0.5 mol/L Na2SO3,两种样品的光电流密度分别为9.29和21.61 μA/cm2(图4 C、4 D),同样地,该空穴捕获剂提高了原始样品的光电流,而且使得原始样品的起始电势负移,表明该捕获剂减少了光生空穴与电子的界面复合,加速了载流子的转移,提高了光电化学性能。 当向电解液中加入双氧水后,两种样品的电荷分离效率分别为1.74%和17.25%(图4 E),而当加入亚硫酸钠后,电荷分离效率分别为2.27%和9%(图4 F)。 由数据可知,不管是加入哪一种空穴捕获剂,复合了金纳米棒的材料其电荷分离效率均远远高于原材料的,这也进一步说明金纳米棒的复合促进了光生电子-空穴对的有效分离。
2.2.3 材料的PL光谱和阻抗分析 为了进一步验证上面测试结果的合理性,对所制备的材料进行了荧光光谱和电化学阻抗测试。 而这两种表征手段有助于深入理解光生电子空穴对的迁移、分离、复合等过程。一种材料的荧光强弱可以反映出电子空穴对的复合过程,由图5 A可知,两种材料均呈现出一个宽荧光峰,约在480 nm处。 但是可以很明显地看到,在复合了金纳米棒以后,与纯的石墨相氮化碳材料相比,其荧光强度猝灭了,因此可以判断:将金纳米棒复合在石墨相氮化碳的片层结构中,抑制了光生电子-空穴的复合,提高了整体的催化性能。图5 B阻抗图也有力地证实了以上结论。 因为电化学阻抗测试能反映出光生电荷迁移的阻力,阻力越小说明材料性能越好,对应的在图中半圆的半径越小。图5 B可以明显看出,复合了金纳米棒的半圆半径要比纯材料的半径小,说明复合了金纳米棒电子传递阻力减小,即增强了材料的导电性,使电子空穴复合几率降低了。
 | 图5 纯 g-C3N4和Au/ g-C3N4的荧光光谱( A)和阻抗图( B)Fig.5 PL spectra at λex=365 nm( A) and electrochemical impedance spectroscopy(EIS) Nyquist plots( B) of g-C3N4( a), Au/ g-C3N4( b) samples |
2.2.4 Voc decay(开路电压衰减)测试和分析 光催化材料的光生载流子的动力学性质可以通过测试其开路电压衰减曲线和由衰减曲线计算出的电子寿命来评估。 在稳定的100 s光照射以后再关灯就可以测出如图6 A所示的开路电压衰减曲线。 再根据电势与时间的关系,可以求得如图6 B所示的电子寿命。 我们可以看出,在相同电势下,Au纳米棒与石墨相氮化碳的复合光催化材料表现出了更长的光生电子寿命,也就说明光生电子在与空穴复合以前存在的时间更长,电子的转移更快,这也恰好与我们前面测试结果(复合材料具有更好的光催化活性)相对应。 因此,能够说明有Au纳米棒复合的材料光电转换活性远远高于纯材料的。
为探究贵金属金对石墨相氮化碳的光电化学性能的影响,我们首先利用种子生长的方法合成了Au纳米棒,然后用一锅法合成了Au和石墨相氮化碳的复合材料。 实验结果表明,引入金纳米棒以后,金纳米棒提高了氮化碳的导电性,加速了光生电荷的传输和分离,因此复合材料表现出了非常好的光电化学性能,光电流强度是单一的石墨相氮化碳材料的2.5倍左右。 因此,该种方法对进一步提高石墨相氮化碳光催化性能有潜在意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|






