以2,3,4-三甲氧基苯甲醛为原料,经脱甲基、Knoevenagel缩合、亲核加成等反应合成了2个香豆素基Schiff碱类化合物,其结构经核磁共振谱(1H NMR))和质谱(MS)确证。 并采用淬灭二苯代苦味肼基自由基(DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)和羟自由基等方法对其体外抗氧化性能进行了表征。 结果表明,目标化合物对3种自由基均具有一定的淬灭活性,其中对DPPH和羟自由基的淬灭活性高于母体化合物7,8-二甲氧基-3-氨基香豆素,具有较高的抗氧化活性。
Two Coumarin Schiff base derivatives were synthesized from 2,3,4-trimethoxybenzaldehyde by demethylation, Knoevenagel and nucleophilic addition reaction. Structures of the corresponding products were elucidated through the analysis of1H NMR and MS spectra. The antioxidant activities of two derivatives were evaluated by quenching 2,2'-diphenyl-1-picrylhydrazyl radical(DPPH), 2,2'-azinobis(3-ethylbenzothiazoline-6-sulphonate) ammonium salt cationic radical(ABTS), and hydroxyl free radical. The result shows that the target compounds can quench the three types of free radicals. Compared to 7,8-dimethoxy-3-aminocoumarin, two coumarin Schiff base derivatives have higher quenching activity for DPPH and hydroxyl free radical and have higher antioxidant activity.
香豆素是一类广泛存在于自然界中的有机杂环化合物,研究表明此类化合物具有多种生理活性,如抗肿瘤[1]、抗氧化[2]、抗HIV[3]、免疫调节[4]、抗菌[5]、抗炎[6]、抗凝血[7]等。 这类化合物具有相对分子质量小,合成路线简单,药理作用广泛,生物利用度高,毒性小等特点,是一种重要的药物先导化合物。
自由基在生命进程中发挥着重要的作用,并与一些疾病如衰老[8]、心血管疾病[9]、神经系统疾病[10]、肿瘤[11]等的发生密切相关。 合理地摄入外源性抗氧化剂可以在生理上和药理水平上有效降低或控制生物机体的衰老,并在预防疾病和调节免疫能力的过程中起到重要作用[12]。 因此,寻找发现具有良好抗氧化活性的先导化合物具有重要的意义。
近年来,诸多研究均表明,香豆素类化合物具有很好的抗氧化活性,并且,Nicolaides等[13]认为增大香豆素的共轭体系可提高其衍生物的抗氧化活性。 Schiff碱可与过渡区金属离子形成配合物,此类配合物具有显著的生物活性,在抗病毒、抗肿瘤、抗氧化、抗菌等方面发挥重要作用[14]。 因此,我们设想将香豆素与Schiff两个结构片段连接在一起,设计合成新型的香豆素基Schiff碱类化合物,有望实现生物活性的叠加,而在香豆素母核上引入C=N基团,增大了香豆素的共轭体系,有利于此类化合物抗氧化性能的提高。 与传统的酚类抗氧化剂相比,新型的香豆素基Schiff碱类化合物中,因Schiff碱官能团的存在,其抗氧化机制为螯合机制,通过对人体内阳离子进行螯合,间接减少羟自由基的产生,达到抗氧化的作用,是近年的抗氧化剂的研究热点之一。 通过与抗坏血酸对照,在淬灭二苯代苦味肼基自由基(DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)及羟自由基实验体系上评价了目标化合物的抗氧化性能。
Acquity UPLC-Q-Tof Micro型液相色谱质谱联用仪(美国Waters公司);BRUKER AV400型核磁共振仪(德国Bruker公司);UV-2550型紫外可见分光光度计(日本岛津公司);DLSB-5/20型低温冷却液循环泵(巩义市予华仪器有限责任公司);DZF-6201型真空恒温干燥箱(上海一恒科学仪器有限公司);X-4型数字显示显微熔点仪(北京泰克仪器有限公司)。
2,3,4-三甲氧基苯甲醛(≥98%,武汉远成共创科技有限公司);对甲基苯甲醛(≥98%,比利时ACROS Organics公司);2-呋喃甲醛(≥97%,天津市福晨化学试剂厂);1,1-二苯基-2-苦肼基(DPPH,≥99%,南京奥多福尼生物科技有限公司);2,2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS,≥98%,南京奥多福尼生物科技有限公司);柱层析用硅胶和薄层层析用硅胶皆为青岛海洋化工产品;其它实验所用试剂均为市售分析纯,直接使用。
1.2.1 2-羟基-3,4-二甲氧基苯甲醛2的合成
称取12 g 2,3,4-三甲氧基苯甲醛加入250 mL三颈瓶中,加入75 mL甲苯溶解,搅拌下加入8.2 g无水三氯化铝,80 ℃,反应6 h,待反应液冷却至室温时,加入50 mL 5 mol/L盐酸,搅拌。分离甲苯相,水相以二氯甲烷(20 mL×3)萃取,有机相依次以40 mL饱和NaHCO3及30 mL饱和NaCl溶液洗涤,无水MgSO4干燥。 抽滤,滤液浓缩后冷却析晶,得到黄色固体, V(乙醇)∶ V(水)=1:1混合溶剂重结晶,得到浅黄色针状晶体6.4 g,产率57.5%,mp 70~72 ℃(文献[15]值69~70 ℃);IR, σ/cm-1:3500~3200,1643,1624,1504,1451,1429,1390,1291,1264,1108;1H NMR(400 MHz,CDCl3), δ:3.92(s,3H,OCH3),3.96(s,3H,OCH3),6.61(d, J=9.0 Hz,1H,H-5),7.30(d, J=9.0 Hz,1H,H-6),9.76(s,1H,CHO),11.20(s,1H,OH)。
1.2.2 3-乙酰氨基-7,8-二甲氧基香豆素3的制备
分别称取2.4 g(13.2 mmol)化合物2和2.1 g(17.9 mmol)乙酰甘氨酸加入到150 mL三颈瓶中,再加入7 mL乙酸酐、18 mL N, N-二甲基甲酰胺(DMF)及适量的哌啶,150 ℃,反应3 h。 待反应液冷却后,加入200 mL水,并用饱和碳酸氢钠溶液调节pH=7,放置冷却后,抽滤,干燥, V(三氯甲烷)∶ V(乙醇)=2:1混合溶剂重结晶,得到橙黄色固体2.71 g,收率77.9%,mp 225~227 ℃。1H NMR(400 MHz,CDCl3), δ:8.65(s,1H,CONH),8.02(s,1H,C=CH),7.23(d, J=8.7 Hz,1H,Ar—H),6.94(d, J=8.7 Hz,1H,Ar—H),4.01(s,3H,OCH3),3.97(s,3H,OCH3),2.25(s,3H,CH3);ESI-MS( m/z):286(M+Na)+。
1.2.3 3-氨基-7,8-二甲氧基香豆素4的制备
称取0.5 g(1.89 mmol)化合物3加入到150 mL三颈瓶中,以25 mL甲醇溶解,再加入1 mL浓盐酸,回流2 h。 冷却后,用饱和碳酸钠溶液调节pH值为8。放置冷却后,抽滤,干燥, V(氯仿)∶ V(乙醇)=2:1混合溶剂重结晶,得到0.35 g黄色固体,收率83.33%,mp 177~180 ℃(文献[16]值177~180 ℃)。1H NMR(500 MHz,CDCl3), δ:6.95(d, J=8.6 Hz,1H,Ar—H),6.81(d, J=8.6 Hz,1H,Ar—H),6.65(s,1H,C=CH),4.08(s,2H,NH2),3.96(s,3H,CH3),3.88(s,3H,CH3);ESI-MS( m/z):344(M+ Na)+。
1.2.4 目标化合物的合成
化合物5a 分别称取0.3 g(1.36 mmol)化合物4、对甲基苯甲醛0.24 g(2.03 mmol)加入到三颈瓶中,20 mL无水乙醇,滴加6滴冰乙酸,加热回流3 h,冷却,得到橙黄色固体,抽滤,无水乙醇洗涤后干燥,三氯甲烷-乙醇体积比为5:1的混合溶剂重结晶,得到黄色固体0.35 g,收率78.7%。 mp 187~189 ℃;1H NMR(500 MHz,CDCl3), δ:9.16(s,1H, N=CH),7.82(d, J=8.1 Hz,2H,Ar—H),7.56(s,1H, C=CH),7.28(d, J=8.0 Hz,2H,Ar—H),7.22(d, J=8.7 Hz,1H,Ar—H),6.91(d, J=8.7 Hz,1H,Ar—H),4.03(s,3H,OCH3),3.97(s,3H,OCH3),2.43(s,3H,CH3);ESI-MS( m/z):324(M+H)+。
化合物5b 照上述方法合成,得黄色固体0.28 g,收率73.8%,mp 175~178 ℃;1H NMR(500 MHz,CDCl3), δ:9.30(s,1H,N=CH),7.76(s,1H,CH=C),7.64(d, J=1.7 Hz,1H,O=CH),7.23(d, J=8.7 Hz,1H,Ar—H),7.00(d, J=3.5 Hz,1H,C=CH),6.91(d, J=8.7 Hz,1H,Ar—H),6.57(dd, J=3.5,1.7 Hz,1H,C=CH),4.02(s,3H,OCH3),3.97(s,3H,OCH3);ESI-MS( m/z):300 (M+H)+。
1.3.1 DPPH自由基清除实验
首先配置80 mg/L的DPPH自由基甲醇溶液[17],避光保存。 再分别配制4 g/L的受试物乙腈溶液,并逐步稀释得到质量浓度分别为2、1、0.5、0.125、0.0625 g/L的受试物溶液。
3 mL DPPH溶液分别与上述各质量浓度的受试物溶液1 mL混合后,室温避光放置30 min,于517 nm处测其吸光度,甲醇做空白对照。 抗坏血酸作为阳性对照。 按式(1)计算DPPH自由基清除率:
式中, A0为空白组吸光度, A1为实验组吸光度。
1.3.2 ABTS自由基清除活性测试
配制50 mL 2 mmol的ABTS标准液[18],用pH=7.4的磷酸缓冲液(PBS)定容,然后将此溶液与50 mL过硫酸钾(70 mmol/L)溶液充分混合,置于暗处放置12~16 h。 测定前,用PBS稀释混合液使其在波长734 nm处吸光度为0.700±0.005,得ABTS自由基阳离子工作液。
分别取0.1 mL质量浓度为2、1、0.5、0.25、0.125、0.0625 g/L的受试物溶液同3.90 mL上述工作液混合,暗处放置3 min后测定其在734 nm处的吸光度,PBS做空白对照。 ABTS自由基阳离子清除率的计算方法如式(2):
式中, A0为空白组吸光度, A1为实验组吸光度。
1.3.3 羟自由基清除实验
1 mL(9.00 mmol/L)硫酸亚铁(FeSO4·7H2O)溶液、1 mL(10 mmol/L)过氧化氢溶液分别与质量浓度为2、1、0.5、0.25、0.125、0.0625 g/L的受试物溶液各1 mL充分混匀[19],37 ℃,放置10 min,加入1 mL(9 mmol/L)水杨酸溶液,混匀后,37 ℃,放置30 min,于510 nm处测定反应溶液的吸光度,纯水做空白对照。 羟自由基清除率计算如式(3):
式中, A0为空白组吸光度, A1为实验组吸光度。
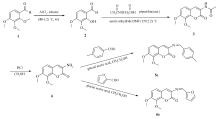
以2,3,4-三甲氧基苯甲醛1为原料,经过脱甲氧基反应、Knoevenagel缩合反应、水解反应,得到关键中间产物7,8-二甲氧基-3-氨基香豆素4,并以其为母体,通过与不同的芳醛进行亲核加成反应,得到2个香豆素基Schiff碱化合物,合成路线如Scheme 1所示。
合成目标化合物的关键是香豆素母核的构筑,在研究过程中,我们发现采用化合物2与乙酰甘氨酸在哌啶催化下,进行Knoevenagel缩合反应可以高效的制得关键中间体化合物4。 在合成过程中,分别选择乙酸乙酯、乙酸酐、DMF作为溶剂进行考察,结果发现单一溶剂的效果不够理想,经实验探索,将乙酸酐与DMF配成体积比为1:3的混合溶剂,既有利于发挥乙酸酐的脱水作用,又可以抑制酸酐过量引发的副反应,反应效果较好。
2.2.1 淬灭DPPH自由基清除活性
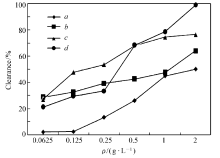
化合物4、5a及5b对DPPH自由基清除实验的结果见图1。 化合物5a、5b对DPPH均有一定的清除效果,化合物5a在低质量浓度(0.0625、0.125和0.25 g/L)时,对DPPH的清除活性高于母体化合物4;化合物5b在低质量浓度时(0.0625、0.125和0.25 g/L)时,清除活性高于化合物4和对照物,并且较快达到50%,表明其对DPPH自由基的清除作用是快速进行的,因此在低质量浓度时,将化合物4的氨基衍生化后得到香豆素基Schiff碱类化合物,能增强淬灭DPPH自由基的清除作用。
 | 图1 DPPH自由基清除实验结果 a.compound 4; b.compound 5a; c.compound 5b; d.compound VcFig.1 Scavenging results of DPPH radical |
2.2.2 淬灭ABTS自由基清除活性
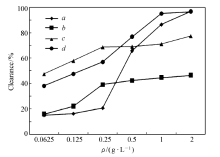
化合物4、5a及5b对ABTS自由基清除实验结果见图2。 化合物5a在各个质量浓度下,其清除活性都低于对照品和母体化合物4,表明其对ABTS的清除活性不佳。 化合物5b对ABTS的清除在低质量浓度时(0.25 g/L)就达到了50%,且高于对照品,清除活性较强且清除作用是快速进行的。 但与母体化合物4相比,化合物5a和5b在各个质量浓度下对ABTS的清除活性均不足,表明将氨基衍生后,得到的香豆素基Schiff碱类化合物对ABTS的清除活性不足。
 | 图2 ABTS自由基清除实验结果 a.compound 4; b.compound 5a; c.compound 5b; d.compound VcFig.2 Results of ABTS free radical scavenging |
2.2.3 淬灭羟自由基清除活性
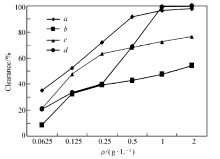
化合物4、5a及5b对羟自由基清除实验结果见图3。 由图3可知,化合物5a,5b均表现出一定的羟自由基清除活性。 其中化合物5a和5b,在低质量浓度时,对羟自由基的清除活性均高于对照品,且化合物5b在低质量浓度(0.25 g/L)时,对羟基自由基的清除率已达到50%,清除作用是快速进行的。 与化合物4相比,化合物5a和5b在各个质量浓度下的羟自由基清除活性均强于化合物4,均显示出较强的羟自由基清除活性,表明新型香豆素基Schiff碱类化合物能增强羟自由基的清除作用。 由于目标化合物中的Schiff碱部分可通过与体内的过渡金属阳离子螯合,阻止金属离子对羟自由基和氧自由基生成的催化作用,从而达到抗氧化功效。 因此,在目标化合物淬灭3种自由基的清除活性实验中,化合物5a和5b均对羟自由基表现出最佳的清除活性,验证了此类化合物的抗氧化机制。
合成了2个香豆素基Schiff碱类衍生物。 体外抗氧化实验结果显示,2个香豆素基Schiff碱化合物均具有较高的淬灭二苯代苦味肼基自由基(DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)及羟自由基的活性,表明在香豆素基团上引入Schiff碱官能团可能改善化合物的抗氧化活性,以Schiff碱基团扩展了香豆素的共轭体系之后,提高了向N中心自由基以及羟基自由基提供电子的能力,反之,其还原自由基的能力并未提高。 受化合物数量的限制,将母体化合物的氨基衍生化后,对其抗氧化功效的影响还不能得到更为精准的结论,仍需进一步研究。 本文提供了一种新型的提高抗氧化淬灭自由基能力的方法,可以避免使用酚羟基自由基,将为基于螯合机制的香豆素Schiff碱类抗氧化剂的应用提供一定的研究基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|