热化学硫碘(S-I)循环分解水是目前有较高效率且可以在相对较低温度条件下进行的制氢方法之一。 其中的Bunsen反应作为循环的核心步骤尤为重要。 为了更方便有效地分离Bunsen反应的生成物硫酸与氢碘酸,许多学者研究了Bunsen反应的新方法。 本文对非水溶剂中的Bunsen反应和电化学Bunsen反应两种新方法进行了综述。 讨论了非水溶剂中实现反应生成物分离的方法,对比了各种非水溶剂的性质及其优缺点。 目前,所发现的溶剂在分离生成物方面已达到要求,可用于Bunsen反应,但溶剂的回收再利用比较困难。 概述了电化学Bunsen反应的研究现状,对目前在电化学Bunsen反应中有突破进展的两个团队的工作进行了对比。 现今对该方法的探讨主要集中在反应基础特性方面,未来可以加强电化学Bunsen反应机理、反应电池结构设计与优化、以及新型S-I循环系统构造的研究。
The sulfur-iodine(S-I) thermochemical water-splitting cycle is one of the high-efficient methods for hydrogen production, which can be carried out at relatively low temperatures. The Bunsen reaction is particularly important as the core step of the cycle. In order to facilitate the effective separation of Bunsen reaction products, i.e., sulfuric acid and hydroiodic acid, new methods for carrying out Bunsen reaction have been studied by many scholars. In this paper, two new Bunsen reaction routes, including Bunsen reaction in non-aqueous solvents and electrochemical Bunsen reaction were reviewed. The separation of reaction products in non-aqueous solvents was discussed.The properties, advantages and disadvantages of various non-aqueous solvents were compared. It is found that the solvents adopted at present have met the requirements for the separation of Bunsen reaction products, and can be used for the Bunsen reaction, but the recovery and reuse of the solvents are difficult. The research status of electrochemical Bunsen reaction, and the comparison between the progress of two typical research teams were also summarized in this work. Most efforts have been made on the fundamental characteristics of the reaction, further attention can be paid to the electrochemical Bunsen reaction mechanism, cell structure design and optimization, and even construction of novel S-I cycle system.
由于不可再生的化石能源对环境的不利因素,可再生能源的使用每天均在增加,但化石能源仍然是能源生产的主要来源,约占总能源产量的80%[1]。 氢气为一种高质量的能量载体,被认为是未来的替代燃料[2,3]。 并且氢气拥有许多优良的性能,对比太阳能等新能源,氢能具有可储存及运输等优点;而对比核能,则相对比较安全且来源广。 由美国GA公司[4]提出的热化学S-I循环分解水制氢则是目前关注较多且研究发展比较成熟的制氢方法之一。 该方法主要由以下3个反应组成:
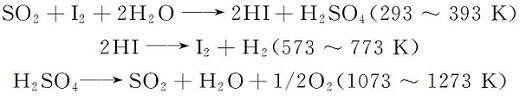
硫碘循环基于本生(Bunsen)反应(1)、HI分解反应(2)和H2SO4分解反应(3)这3步相关联的热化学反应,中间物质SO2和I2循环利用,实现了较低温度条件下的水分解,热效率较高,可匹配太阳能或核能等新能源,实现大规模制氢[5,6]。 硫碘循环制氢由于具有诸多优点而备受重视,美国、德国、法国以及中日韩等国家的科研机构均在积极研发,并将其作为今后与可再生能源相结合的首选流程[7]。 硫碘循环的研究涉及三步基础反应与系统流程[8],具体包括了Bunsen反应动力学过程、液相分层特性、副反应发生,H2SO4和HI分解的催化剂开发与利用,硫碘循环系统的流程设计与优化等。
Bunsen反应(1)作为硫碘循环核心反应,其反应条件、转化率和生成物的分离与提取对整个硫碘循环均有重要的影响。 针对生成物的分离与提取,GA公司[9]提出加入过量碘使两种酸自发分层的方法。 在加入过量碘后,碘与氢碘酸络合,增加了HI溶液密度,促使两种酸溶液分离。 在此基础上许多学者对Bunsen反应进行了研究[10,11]。 但此传统方法要使用大量过量碘和水,且在H2SO4相和HI x相中均含有少量杂质,因此,需要后续的纯化、浓缩、分离及精馏等工序[12,13],进一步增加了整个循环系统的操作过程和能耗,这对硫碘循环系统的发展不利。 对这种情况,许多学者考虑到开发其它的Bunsen反应方法来提高循环系统效率。 De Beni等[14]最早提出使用一种其它溶剂代替过量水。 这种方法可大量减少水和碘的使用,增加硫碘循环的热效率和抑制碘腐蚀。 而Nomura等[15]则考虑在电化学电池中进行Bunsen反应,该法可以直接对生成物进行分离,简化了Bunsen反应的工序。 本文对以上两种方法的最新研究进展进行了综述,并提出了其今后发展和研究方向。
在传统Bunsen反应中,水既是反应物也是溶剂,但过量水稀释了酸溶液,增加了后续浓缩和分离过程的能耗,降低了整个S-I循环的热效率[16,17,18]。 如果有一种溶剂只能溶解一种生成物且与水不互溶,就能简单地使两种生成物分离。 选择的溶剂需要有疏水性、热稳定性,并且能方便地分离硫酸和氢碘酸,此外还要容易回收。 目前,认为适用于Bunsen反应的溶剂主要从以下3种溶剂中筛选。
De Beni等[14]最先提出选用TBP(Tri- n-butyl- phosphate,磷酸三正丁酯)作为反应溶剂,TBP是一种与水不互溶的溶剂,可以与HI发生配合,然后从生成物中提取出HI,促使其与H2SO4分离。 在此之后,Giaconia等[19]和Taylor等[20,21]对TBP作为反应溶剂的可行性做了进一步研究。 两个课题组均在TBP溶剂中通入SO2至饱和并加入少量的水和碘,混合均匀后待TBP相彻底澄清或透亮表示反应完成。 Giaconia等[19]实验表明,反应完成后,TBP相基本澄清,经分析其中含有残留的SO2和碘化合物,并且得到的HI与H2O摩尔比约为1:3。 而硫酸由于较重处于TBP相的下方。 Taylor等[21]的实验在反应完成后却有不同的现象,在将碘加入到TBP中时,会伴随有气体释放,且在反应完成后TBP相为亮橙色,经分析这是溶剂中过量的SO2与反应生成物HI配合物的颜色,这无疑对之后从溶剂中回收HI会造成较大的影响。 由于TBP溶剂加热时会发生降解,因此,通过热回收HI是不可取的。 另一种回收HI的方法是用水反萃取,虽然这种方法几乎可以从TBP中完全回收HI,但是这种方法需要大量的水并稀释了最终HI的浓度,而接下来对HI溶液的浓缩和提取则需要大量的热能[20]。
根据TBP的性质,Taylor等[20,21]发现了DBBP(丁基磷酸二丁酯)和Cyanex®923(三己基和三辛基氧化膦的混合物)两种溶剂,他们分别使用两种溶剂对HI溶液提取3次,提取数据如表1所示。 从表1中可以得到:这两种溶剂均有不弱于TBP提取HI的结果,证明这两种溶剂均有在Bunsen反应中使用的潜力。 DBBP在提取HI酸的同时会吸收大量水,而Cyanex®923反而会发生脱水现象(水提取率为负值)。 随后在进行HI加热回收中,DBBP与TBP均会在50 ℃以上时发生分解,Cyanex®923表现出良好的热稳定性,但在进行Bunsen反应时,与TBP相同,由于过量SO2的存在而发生HI与SO2的配合,表现为亮橙色。 而在进行热回收时发现溶剂由亮橙色变为深棕色,这表明发生了逆Bunsen反应,因此,Cyanex®923也不宜采用热回收HI的方法。 而在使用水反萃取回收HI时,虽在仅有HI溶液的初步实验中显示HI几乎全部回收,但在Bunsen反应中,因 SO2和HI的配合物形成,使用水反萃取回收的方法是困难的,仅能回收一部分HI。 不过Cyanex®923依然是一种比TBP更适用于Bunsen反应的溶剂。
与TBP不同,Barbarossa等[23]研究了PSDVB溶剂(聚苯乙烯-二乙烯基苯)通过如Scheme 1所示的磺化反应吸收H2SO4生成S-PSDVB(磺基聚苯乙烯-二乙烯基苯)的过程。因S-PSDVB与水不相溶,达到分离H2SO4和HI的目的。 研究表明升温使磺化程度增加,即增加硫酸的吸收率。 在对于不含聚合物和具有聚合物的Bunsen溶液中碘化物和硫酸盐的量的对比中,发现在反应溶液中加入聚合物后,可以有效减少其中的硫酸量(56%),表明PSDVB对Bunsen反应生成物的分离有一定的作用,但这种方法未能彻底地分离硫酸和氢碘酸,需多次吸收才能从反应液中吸收完硫酸,且在随后的脱磺化反应中,对于聚合物的回收和重复利用的可能性并不理想,这可能与聚合物的芳香族部分对试剂较不易接近的结构特征有关。 因此,在之后的研究中应该考虑使磺化反应和芳烃聚合物的回收更易进行。
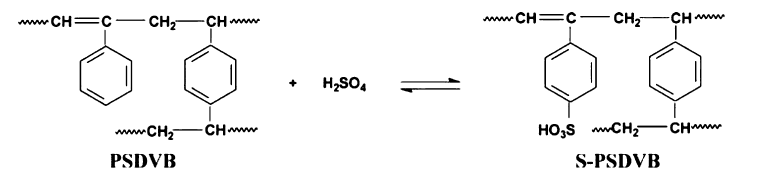 | Scheme 1 PSDVB sulfonation reaction[23] |
近年来,离子液体作为优良的溶剂已经用于绿色化学领域。 离子液体是非挥发性、不可燃和热稳定的溶剂,是非常有希望的传统挥发性有机溶剂的替代品[24,25,26]。 Taylor等[22]将离子溶剂应用于Bunsen反应,研究了[Tf2N]-(双(三氟甲基磺酰基)酰亚胺)、[FAP]-(三(全氟烷基)三氟磷)和[TMPP]-(双(2,4,4-三甲基戊基)次膦酸酯)3种离子溶剂。 3种溶剂对HI的提取测试结果如表2所示。 其中 [FAP]-离子溶剂几乎无提取HI的能力,而[TMPP]-有非常明显的质量平衡差,这表明在溶剂中发生了复杂的反应,而具体原因尚待进一步的研究。 因此,这两种离子溶剂暂时不能用于Bunsen反应。 对于[Tf2N]-离子液体,有机相的质子和碘化物含量是不等的,这表明存在I-与溶剂中的阳离子自由组合并脱离溶剂转移到水相中,当将烷基链长度从C5增加到C10时,观察到离子交换的减少,然而离子液体的损失仍然发生[26]。 阳离子到水相的损失明显损害溶剂的完整性,除非可以找到不存在溶剂损失的方法,否则[Tf2N]-离子液体是不适合Bunsen反应的。 虽然目前发现的几种离子溶剂不适用于Bunsen反应,但是理论上离子液体的物理和化学性质可以通过调节阳离子和阴离子来定制,因此离子溶剂可以适用于大部分条件,不过需要通过实验来找出最佳的阴离子和阳离子的搭配方式。
| 表2 离子液体的HI提取结果[22] Table 2 Hydriodic acid extraction results with ionic liquids |
由Nomura等[15]提出的电化学Bunsen反应原理如图1所示,通电后,在阳极中SO2被氧化失去电子与水生成硫酸溶液,多余的氢离子通过质子交换膜进入阴极,而阴极液中的I2被还原生成I-与多余的氢离子组成Bunsen反应产物HI。 阳极和阴极的反应如下:
Anode:SO2 + 2H2O- 2e- →H2SO4+2H+
Cathode:I2 + 2H+ + 2e- →2HI
Nomura等针对工况参数对反应的影响[15]和电流-电压特性[27]等做了研究,之后还探讨了对Bunsen反应中参数优化的问题[28]。 近年来,对电化学Bunsen反应进行深入研究的主要有Immanuel等和Ying等两个团队,接下来本文将对两个团队的主要研究成果和进展进行对比分析。
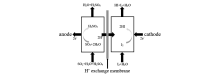 | 图1 电化学Bunsen反应原理示意图[15]Fig.1 A schematic diagram of the membrane electrolysis cell used for Bunsen reaction[15] |
Immanuel等[29,30]的实验方法是保持电极入口处的溶液不变,将反应后的溶液流入另一容器中等待测量,该实验方法最大的好处是可以保持电阻基本恒定,从而使电压变动不大(电流密度恒定),因此可以直接表示工况参数变化时电压的变化,直观地表示工况参数变化时消耗的电能量变化。 而Ying等[31]采用循环的方法,即溶液在经过电池反应后重新返回原料池中混合进行进一步反应,这种实验方法得到反应溶液浓度和电压随时间的变化,可以反映Bunsen反应的速率和阻抗变化,并且得到的反应溶液浓度较高,节省后续浓缩和分离步骤的能耗。 Immanuel等[29,30]及Ying等[31]的研究均表明,电池电压随着电流密度的增加而线性增加,这表明对于工作中使用的电流密度值,传质电阻不是电池总电阻的主要影响因素。 由于硫酸溶液中SO2的溶解度会降低,增加初始阳极硫酸的浓度会抑制Bunsen反应的进行。 而在阴极溶液增加HI浓度和I2/HI的摩尔比均可以促进反应进行,这可能是因为HI溶液的浓度越高,溶解的I2越多,但是I2/HI的摩尔比不宜过大,以防止未溶解的I2在阴极电池中造成堵塞和腐蚀。 另外,Immanuel 等证明,改变两极的压力在压力较小时对电压影响明显,而随着压力增大,电压(电流逐渐增加时)无明显变化,可能是由于增加初始压力可以适当增加SO2的溶解度,因此减小了电阻。 Ying等则认为,升高温度既提高电极反应速率也降低SO2溶解度,对H2SO4浓度的变化产生双向影响,但在阴极由于Bunsen反应是放热反应,当温度升高时会抑制I2的转换。
质子交换膜作为反应电池内的重要组成部分,既能传递氢离子,同时分隔两极溶液,因此,有必要对其性质进行研究。 Immanuel等[32]对质子交换膜在高浓度酸溶液中的性质进行了研究,Ying等[33]则对Nafion 117和Nafion 115两种质子交换膜进行了对比研究。 Immanuel等的研究表明,Nafion 117质子交换膜的电阻随温度、HI浓度和I2/HI摩尔比的变化很小,但是在H2SO4浓度升高时,Nafion 117质子交换膜的表面电阻显著升高。 这在Ying等的研究中得到了验证,当H2SO4浓度为13~16 mol/k
在电化学Bunsen反应中,由于质子交换膜没有100%的选择性,使电池两极溶质交换引起电池阳极电解液和阴极电解液之间的交叉污染。 交叉污染的存在无疑对电化学Bunsen反应的发展是不利的。对交叉污染的研究中,Immanuel等[32]和Ying等[33]均发现电流密度、温度和I2/HI摩尔比升高会使两极交叉污染更严重,而两极压力增加时,对交叉污染无明显影响。 增加初始H2SO4的浓度,会促进H2SO4向阴极传递并抑制HI向阳极渗透,增加初始HI浓度时结果相反。 并且Ying等还证明传递到阳极侧的HI浓度比阴极侧的H2SO4浓度高2~10倍。
在确定电化学Bunsen反应可以顺利进行后,对其两极的反应机理研究就显得尤为重要。 Immanuel等[34]和Ying等[35]均采用了循环伏安法(Cyclic Voltammetry,CV)得到电流-电势的 i-E曲线,并对其进行了分析。 Immanuel等[34]分别对含有饱和SO2与没有SO2时铂和石墨两种电极在相同条件下的反应机理进行了对比,Ying等[35]研究了不同H2SO4浓度和HI浓度时的反应机理。 研究表明,随着H2SO4溶液的浓度提高会增大传质电阻,进一步验证了电化学Bunsen反应中H2SO4溶液的浓度不能过高。 并且两个团队均证明阳极反应是完全不可逆的,同时电池阴极的I2还原反应也是不可逆的。 HI浓度从6 mol/k
Ying等[36-37]]使用极化曲线测量和电化学理论研究了电化学Bunsen反应的动力学。 结果表明,阳极电解液中的SO2浓度和阴极电解液中的I2浓度的增加可以降低反应活化能,有助于阳极和阴极反应的进行。 阳极的反应速率远远低于阴极反应,并且H2SO4浓度为13 mol/k
硫碘循环制氢法目前已成为最有发展前景的制氢方法之一,而Bunsen反应作为连接枢纽对其整体连续稳定操作的重要性不言而喻。 传统Bunsen反应存在物料(如碘和水)消耗量大、分离工艺复杂、能耗高等问题,非水溶剂中Bunsen反应和电化学Bunsen反应新工艺的研究为解决这些问题提供了新的思路。 在选择非水溶剂中,经实验表明,许多溶剂对Bunsen反应生成物的分离程度是令人满意的,但在之后溶剂的回收再利用却还没有达到要求。 而电化学Bunsen反应可以很好的对生成物分离并直接进行下一步反应,但反应过程消耗电能较多,并且反应后溶液浓度不高,后续还要消耗大量热能。 因此,Bunsen反应新方法还需要进一步的研究发展。 对非水溶剂中Bunsen反应,鉴于过量的SO2与HI会发生配合,因此新溶剂要求能吸收和解吸SO2,以保证溶剂中HI的纯度。 而针对电化学Bunsen反应消耗电能的问题,可以考虑优化反应电池结构来降低电阻。 此外,还可以使两种新方法结合,将电化学中电解质的溶剂用离子液体代替。
本文属于开放获取期刊,遵循CCAL协议,使用请注明出处。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|


