熔盐电解法是一种高效制备镁稀土合金的方法,工艺流程简便易于连续生产,而且制备的镁稀土合金成分均匀,不偏析。 不同稀土元素的熔盐体系也有所区别,重稀土元素一般采用氧化物电解法,而轻稀土元素则采用氯化物电解法。 针对以上不同的电解方法,本文从电解原料、电解槽结构、电极过程、电解工艺、尾气处理等多方面详细阐述了制备镁稀土合金的现状,并对电解法制备镁稀土合金的未来提出发展方向。
It is a high efficient method to prepare Mg-RE(rare earth) alloys in molten salt electrochemical process for its easy mass production and simple procedure. The RE element distributes uniformly and continuously in prepared Mg alloys. The heavy and light RE elements are extracted by electrolyzing from fluoride fusion and chloride fusion, respectively. Recent advances in preparation of Mg-RE alloys in molten salt electrochemical process are elaborately discussed from materials, electrolytic tank, electrode process, technical parameters and anodic gas absorption, and some beneficial advices focused on future developments about preparation of Mg-RE alloy are indicated.
镁合金具有质量轻、高比刚度、高阻尼、减振降噪、抗电磁波辐射、加工及回收时不产生污染等特点,而且镁资源丰富,利于可持续发展,因此镁合金被誉为“21世纪轻质、绿色结构材料”[1]。 现在,镁合金已经被广泛应用于航空、航天、电子、通讯和汽车制造业等领域[2]。 传统镁合金存在易氧化燃烧、不耐蚀、抗高温蠕变能力差和高温强度低等弱点,必须通过添加其它合金化元素来提高镁合金的性能。 稀土是镁合金中最具使用价值和发展潜力的合金化元素,稀土通过细晶强化、固溶强化、弥散强化和时效沉淀强化中的一种或几种强化机理来提高镁合金的性能[1]。
我国镁资源占世界总储量的22.5%,主要来源于菱镁矿、白云石、盐湖区镁盐以及海水等,是世界上镁储量最为丰富的国家之一[2]。 稀土元素包括钇(Y)、钪(Sc)和镧系15个元素,常用符号“RE”或“R”表示。 我国稀土资源储量丰富,已探明的稀土资源储量约6588万吨,而且具有稀土元素齐全、稀土品位及矿点分布合理等优点,为我国稀土工业的发展奠定了坚实的基础[1]。
近年来国内科研工作者利用这两大资源优势,对含稀土镁合金进行了系统和深入的研究,改善了镁合金自身强度不高、耐蚀性差等缺陷,充分发挥了镁合金质轻、抗疲劳、良好的铸造和加工性能、易于回收利用等优点,并致力于开发低成本、高性能的新型稀土镁合金,对镁合金材料及稀土材料的发展起到极大的推动作用[3,4,5,6,7,8,9,10,11,12,13]。 制备镁稀土合金,一般采用对掺法[1],即在熔融条件下,将稀土元素添加到镁合金熔体中,但是由于稀土与镁的熔点和密度相差较大,稀土金属很难均匀地熔解在合金熔体中,造成镁稀土合金成分不均匀,偏析严重,因此需要先将稀土元素做成镁稀土中间合金,然后再添加到熔体中。 熔盐电解法就是一种很好的制备镁稀土中间合金的方法,与对掺法相比,该方法简化了工艺流程,节省了能源消耗,而且制备出的稀土镁中间合金成分均匀,无偏析;通过调节电解工艺参数可以控制合金产品中的稀土含量,为镁合金的推广和应用提供了良好的基础[14,15]。
根据使用原料的不同,制备稀土镁中间合金的电解工艺,可以分为氧化物电解法和氯化物电解法。 氧化物电解法主要用于制备熔点和沸点均高的中重稀土镁中间合金,例如Gd-Mg、Y-Mg和富Y-Mg等中间合金。 氯化物电解法主要用于制备熔点低、沸点高的轻稀土镁中间合金,例如La-Mg、Ce-Mg、Pr-Mg、富Ce-Mg等中间合金。 针对不同的稀土元素,需要采用相应的电解法来生产制备。
1.1.1 电解原料 该工艺是以粉末状的稀土氧化物(RE2O3)和氧化镁(MgO)为熔质,以同种稀土元素的氟化物为主要熔剂,氟化锂、氟化钡为混合熔盐的添加成分。 氟化锂的作用在于提高电解质的导电性,降低熔体的初晶温度和电解质的密度。 氟化钡可以降低混合熔盐的熔点,抑制氟化锂的挥发,同时在电解过程中,不会与金属发生作用,能起到稳定电解质的效果。 因此,电解熔盐组成一般采用三元(3种氟化物)体系(以Gd为例):GdF3-LiF-BaF2(质量比为65:20:15),熔质为Gd2O3和MgO(质量比为80:20)[16]。
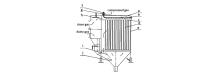
1.1.2 电解槽结构 氧化物电解法一般采用石墨坩埚做电解槽,钼坩埚做金属接收器,阴极材料一般采用钨棒或钼棒,阳极材料则使用石墨块,电解槽结构如图1[16]和图2[17]所示。图1为制取Mg-Gd中间合金电解槽示意图,在收集合金时,需要把钼坩埚取出然后浇铸合金;图2为铈电解槽示意图,也可用于氧化物电解制取Mg-RE合金,合金达到一定量时可以从钼管放出并浇铸成锭。 赣南师范学院和中国科学院长春应用化学研究所制备Mg-Gd、Mg-Y合金时,均采用图1电解槽结构。
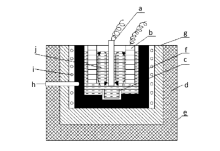 | 图1 Mg-Gd中间合金电解槽示意图[16]Fig 1 Electrolytic tank for producing Mg-Gd master alloy[16] a.Mo cathode; b.carbon anode; c.Mo crucible; d.thermal insulation material e.furnace cover; f.carbon electrolytic tank; g.fireproofing; h.thermcouple; i.heating element; j.molten salts |
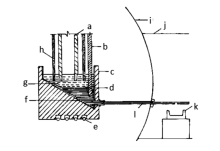 | 图2 铈电解槽示意图[17]Fig 2 Electrolytic tank for producing Ce metal[17] a.anode; b.Mo stick; c.carbon crucible; d.liquid metal; e.heating element; f.Mo scaleboard; g.electroysis; h.Mo cathode; i.main room; j.casting room; k.molder; l.Mo pipe |
1.1.3 电极过程 电解过程中,在阳极区域氧离子放电形成O2,或者与石墨阳极反应形成CO或CO2。 在阴极区域,稀土离子与镁离子共同得到电子,从而形成Mg-RE合金。
阳极过程:
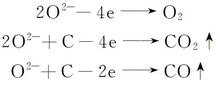
阴极过程:
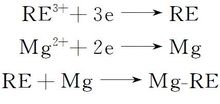
1.1.4 电解工艺条件 氧化物电解制备Mg-RE合金时,可以参照电解稀土金属的工艺条件,如表1所示[17]。 优选的电解工艺条件为:电解温度在950~1050 ℃之间,可以保证电解顺利进行,还不会造成电解质的过度挥发;电压约为10 V,电流在1000~2000 A之间,这两项指标主要取决于整流设备的总功率,电流越大,制备的金属或合金越快;阴极电流密度为6~8 A/cm2,阳极电流密度约为1 A/cm2,这两项指标的高低主要由电解电流大小和电极材料本身决定,阴极电流密度大,金属析出的速度快,制备的金属或合金表面粗糙,而阳极电流密度过大则容易发生阳极效应[20]。
| 表1 La、Ce、Pr、Nd电解操作参数[17] Table 1 Electrolytic parameters of producing Ce, Pr and Nd metals[17] |
1.1.5 电解尾气处理 由于电解槽采用敞开式结构,电解槽排出的尾气中大部分为CO2、CO和空气,还含有少量的氟化氢、氟碳化合物和部分挥发的氟化物熔盐(主要是LiF)。 含氟化合物的产生有两种情况,一是在电解过程中,加入电解槽中的氧化物或电解质等物料是潮湿的,所含水分与熔体中的氟离子发生如下作用:
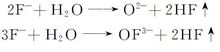
二是当阳极表面上含氧离子不足时,出现氟离子在碳阳极上放电,发生如下反应:
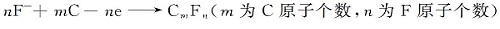
因此,电解尾气需要经过尾气净化设备处理后才能排空。 中国科学院长春应用化学研究所仿照工业电解铝的尾气处理方法——采用布袋除尘器,如图3所示。 电解一段时间后,布袋上粘附的粉尘通过脉冲反吹即可收集到灰斗中,布袋则可以继续粘附灰尘;与电解铝尾气处理方法的区别在于吸收HF的是MgO而不是Al2O3。 使用一段时间以后,尾气净化设备收集的挥发物和吸收HF的MgO物料,可以转入电解槽内,继续做为电解原料使用。
1.1.6 中试规模试验成果 彭光怀等[16]开展了共电沉积法制备Gd-Mg中间合金的研究,他们采用GdF3-LiF-BaF2-CaF2熔盐体系,以Gd2O3-MgO为熔质,在石墨坩埚中成功电解出Gd质量分数大于80%的Gd-Mg中间合金。 同时,研究了电解温度、熔质中Gd的含量、体电流密度对电流效率的影响,如图4所示,发现3个因素对电流效率的影响都是先升后降,当电解温度为1050 ℃,熔质中Gd的质量分数为86%,体电流密度为0.1 A/cm2时,电流效率达到最佳。
 | 图4 电解温度、熔质中Gd的含量、体电流密度对电流效率的影响[16]Fig.4 Current efficiency vs. temperature, Gd content in electrolysis and current density, respectively[16] |
本研究小组开展了“氟化体系电解制备钆镁和富钇镁合金3000 A的扩大试验”,采用GdF3(YF3)-LiF-BaF2熔盐电解体系,在1000~1100 ℃下,分别电解工作25 d和36 d,制备出Gd-Mg中间合金(Gd质量分数≥90%)955 kg和富Y-Mg中间合金(富Y质量分数≥85%)852 kg,合金中杂质含量低,统计结果显示稀土直收率大于80%,电流效率大于60%。 整套电解工艺成熟稳定,能连续不间断生产,保证了镁稀土中间合金持续供应,并为开发低成本、高性能的稀土镁合金产品提供保障。
近年来,采用氯化物原料,电解镁和镁稀土合金的研究比较活跃[18,19,20,21,22,23,24,25,26,27,28,29,30,31],主要集中在原料脱水、电解工艺改进、电解过程机理分析等方面,目的是为了进一步简化电解制备镁稀土合金的工艺条件,易于在工业级规模下推广应用,批量生产出高质量的镁稀土合金,同时要解决电解尾气的环保处理问题,达到国家安全排放的标准。
1.2.1 原料及脱水方法 电解质的组成与性质是决定电解过程各项指标的基本因素。 目前,氯化物体系电解制备稀土镁合金常用的原料包括:氯化钾、氯化钠、氯化钙、氯化钡、氯化镁、氯化稀土及少量氟化钠或氟化钙。
氯化镁和氯化稀土是电解法制备镁稀土中间合金的主要原料。 市售的氯化镁和氯化稀土均含有6个左右结晶水,若选用这类MgCl2·6H2O和RECl3·6H2O结晶料为原料,通常需要进行完全脱水或不完全脱水,也有人用结晶料不脱水进行电解。 包头稀土研究院任永红等[19]采用氯化稀土结晶料,在800 A规模下电解,制备出镁质量分数为40%~60%的合金。
MgCl2·6H2O脱水,脱掉前4个结晶水可以通过浓缩的方法:上世纪40年代,美国专利商标局就公开了美国迈森碱厂(Mathieson AlkallWors)关于MgCl2·6H2O脱掉前4个结晶水的浓缩方法及设备[32];而脱掉后2个结晶水,浓缩方法已经不再有效,会产生水解反应,会生成MgO。 MgCl2·6H2O中的6个结晶水中的最后2个结晶水完全脱掉,往往需要很高的成本。美国通用公司在上世纪末电解生产镁过程中,电解生产金属镁锭的50%成本和能耗来源于对氯化镁原料的完全脱水[33]。 80年来,以降低MgCl2·6H2O脱水成本为中心的改进研究与新方法研究一直没有间断。
中科院青海盐湖所发明的“两段六室流化床”脱水制取无水氯化镁的方法[34],脱掉前4个结晶水采用100~190 ℃;第二阶段将二水合氯化镁脱水至无水氯化镁的流化床温度210~320 ℃,每个阶段的流化床都分为3个室。 该方法技术关键是“制备无水氯化镁过程中脱水尾气中水分的除去”[35],其采用无水氯化钙为吸附剂,在吸湿反应床中,使脱水尾气进行接触吸附反应,除去尾气中的水分,成为干燥的气体。 其对应设备情况在文献[36]中有介绍。
利用有机物反应脱水进展很大。 澳大利亚联邦科学及工业研究组织与澳大利亚镁制品经营有限责任公司联合开发的利用“甘油、液氨与氯化镁结晶料反应、形成含有氯化镁六氨合物的沉淀物”,加热反应式洗涤该沉淀物即得到无水的氯化镁[37]。 清华大学采用盐酸苯胺与水氯镁石反应生成盐酸苯胺—六水氯化镁复盐,然后通过喷雾法将复盐干燥并造粒形成适合流态化的复盐颗粒,最后依次通过流化床脱去结晶水和盐酸苯胺,得到无水氯化镁产品的方法[38];南开大学采用乙酸异丁酯回流脱水,制得粉末状的二水氯化镁方法[39]等。 华东理工大学以水氯镁石制取MgCl2·6NH3,再经脱NH3制取无水氯化镁[23]:将MgCl2·6H2O溶于乙二醇中除水,反应为:

上述产物通入NH3气转变成MgCl2·6NH3,经不同温度下分段脱去NH3,得到无水氯化镁产品。
RECl3·6H2O的脱水与MgCl2·6H2O脱水比较类似,其专用脱水设备也已公布[40]。 无水RECl3的制备—采用RE2O3和NH4Cl为原料的干法氯化,其工艺和设备在文献[41]中有详细介绍。
氯化物体系电解制备镁稀土中间合金,除氯化镁和氯化稀土需要分步脱水外,其它辅助性的熔盐炉料简单烘干即可。
1.2.2 电解槽结构 采用氯化物熔盐体系制备镁稀土合金时,由于电解工艺条件的不同,所选用的电解槽结构也有所区别,主要有以下几种电解槽结构,如图5A和5B[1]、5C和5D[42]所示。
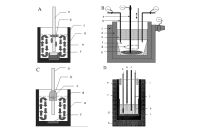 | 图5 下沉液态阴极法电解槽(A);共电沉积镁稀土合金电解槽(B)[1];上浮镁稀土合金电解槽(C);电解镁稀土合金机理研究电解槽(D)[42]Fig.5 Electrolytic tank with depositing liquid cathode(A); Electrolytic tank for co-depositing Mg-RE alloy(B)[1]; Electrolytic tank for floating Mg-RE alloy(C); Electrolytic cell for researching electrochemical theory(D)[42] A:a.Mo cathode, b.liquid cathode, c.molten salts; B:a.cathode, b.heating probes, c.shell, d.carbon anode, e.molten salts, d.carbon crucible & anode, e.Mg alloy, f.Mo crucible f-alumia crucible, g.agitated machine, h.liquid cathod; C:a.cathode, b.alumia tube, c.Mg alloy, d.molten salts; D:a.referrent electrode, b.working electrode, c.counter electrode, e.carbon crucible & anode, f.insulating trip; d.Ar inlet, e.carbon crucible, f.quartz tube, g.furnace, h.Ar outlet, i.thermcouple, j.molten salts, k.alumia crucible |
1.2.3 电解过程及电解工艺 氯化物体系电解制备镁稀土合金的工艺是个逐渐演化的过程,由最初的下沉液态阴极法,发展到后来的共电沉积法、上浮镁稀土合金电解法等,不同的电解工艺有不同的优缺点,可以因地制宜地选择。 电解法制备镁稀土合金的工艺,如果按照电解稀土金属的工艺条件,则演变成下沉液态阴极法和共电沉积法,而如果从电解镁金属的工艺条件出发,则发展成上浮镁稀土合金电解法。 不同的电解工艺对应不同的电极过程和不同原料选择,所采用的电解工艺参数以及制备的镁稀土合金也有所区别。
1)下沉液态阴极法;下沉液态阴极法[43]是由本研究小组率先提出,电解主要原料为无水RECl3(RE为镧镨铈混合稀土)和Mg-RE合金,电极过程为稀土离子在阴极上得电子形成金属并进入Mg-RE合金,阳极上氯离子放电形成氯气。
下沉液态阴极法电解槽结构如图5A所示,所用熔盐组成为KCl-NaCl-RECl3,熔质为无水RECl3,导电阴极为钼棒,液态阴极组成为质量分数5%~8%的Mg-RE合金,电解温度在700~900 ℃。 电解初期,由于Mg-RE合金的密度小于熔盐密度,漂浮在熔盐表面,被翻滚的电解液推动并聚集在钼阴极附近而形成液态阴极,随着电解时间的加长,陆续被电解出的稀土金属扩散进入Mg-RE合金中,使得Mg-RE合金的密度变大,超过熔盐密度时,就会逐渐下沉到金属承受器中,得到RE质量分数为15%~30%的镁稀土中间合金。 此方法已经在江苏宜兴田园轻合金材料有限公司推广使用,该方法技术成熟,工艺可靠,现已批量生产。
2)共电沉积法:本研究小组在下沉液态阴极法的基础上又研发出共电沉积法的新工艺,其电解主要原料为氯化稀土和氯化镁,电解槽结构如图5B所示。 共电沉积法主要用于生产高稀土含量的Mg-RE中间合金(其中RE代表单一的La、Ce、Pr、Nd元素或者富Ce、镧镨铈等混合稀土),电解出的合金中稀土质量分数也提高到30%~60%。 此法是目前电解生产镁稀土中间合金的主要方法。 共电沉积法的电极过程为稀土离子和镁离子在阴极上共同得电子形成Mg-RE中间合金,阳极上氯离子放电形成氯气。
共电沉积法所用的原料最初为无水氯化镁和无水氯化稀土,随后改进为采用部分脱水氯化镁(含1~2个结晶水)和部分脱水氯化稀土(含1~2个结晶水),其主要原因是:
①六水氯化镁脱水制备无水氯化镁的过程中,前面4个结晶水的脱除比较容易,后面两个结晶水的脱除很困难,要在较高温度下,在强腐蚀性气体(一般为HCl气体)的保护下脱水,才能得到无水氯化镁,否则会产生氧化镁和碱式氯化镁杂质,进而在电解过程中造渣,危害电解过程。因此脱除最后2个结晶水消耗大量能源,对设备耐腐蚀性要求高,因此造成无水氯化镁生产成本高,进而导致电解金属镁的成本偏高。
②用熔融氯化物电解制取稀土金属,过去也都是采用无水氯化稀土为原料。六水氯化稀土的完全脱水跟制取无水氯化镁一样困难,生产成本较高;同时也会形成氧氯化稀土(REOCl),在电解过程中造渣,影响电解效果。
③采用部分脱水原料共电沉积法制备镁稀土合金时,一方面降低了完全脱水制备无水料的成本,另一方面使用石墨坩埚做阳极兼做电解槽,则可以消除MgO和REOCl对电解过程的危害,减少电解过程造渣,使电解过程可以顺利进行。具体的消渣过程[44]如下:
氯化镁水解:
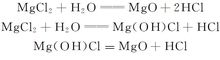
氧化镁和碱式氯化镁转化:

氧氯化稀土在石墨电极上转化成氯化稀土:
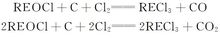
在采用部分脱水原料共电沉积制备镁稀土合金的基础上,中国科学院青海盐湖所又开发出不脱水原料直接进行电解,即使用六水氯化镁和六水氯化稀土原料电解制备镁稀土合金的新工艺,该工艺由于原料含水太多,电流空耗大,电流效率不高。
共电沉积法采用的熔盐体系主要由KCl、NaCl、RECl3和CaCl2等组成,添加的电解质不管是无水氯化物、部分脱水氯化物,还是不脱水氯化物,整个电解工艺过程比较接近,电解温度在800~950 ℃之间,阴极电流密度为6~8 A/cm2,阳极电流密度约为1 A/cm2,制备的镁稀土合金中稀土质量分数为30%~60%,合金中杂质含量低。
3)上浮镁稀土合金电解法:前述下沉液态阴极法和共电沉积法,均是从电解稀土金属的工艺演变而来,制备出的合金中稀土质量分数较高(≥30 %),一般作为镁稀土中间合金使用。而我们在民用产品中使用的镁合金,添加稀土元素的质量分数都比较低(<5%),只是为了改善镁合金的某些方面性能,例如AZ91D+1%La(质量分数)合金[45],合金在常温下的抗拉强度和延伸率分别增大21%和101.2%,并且腐蚀速率下降为原AZ91D的47.2%;AZ91+0.8%Ce(质量分数)合金[46],由于Ce的添加,使得合金中 β相分布减少,降低了 β相与基体 α相的电偶腐蚀,另外由于Ce的添加形成CeO2保护膜,降低了合金表面被进一步腐蚀。 民用产品中使用低稀土含量的另外一个原因是成本考虑,因此民用产品中稀土质量分数均小于5%,有的质量分数甚至低于1%。
基于以上原因,如果可以在电解过程中,直接制备出稀土质量分数<10%(含量可以控制)的镁稀土合金,则可以大幅简化应用合金的熔炼工艺过程节约成本。 但是镁稀土合金中的稀土质量分数<10%,合金密度就小于熔盐的密度,制备的合金就漂浮在电解槽的上部,与电解镁过程中镁漂浮在熔盐表面一样,因此可以在电解镁工艺过程中,通过适当调整电解质组成和电解条件,就可以采用现有的镁电解槽结构,一步制备出稀土质量分数<10%的镁稀土合金。向制备的镁稀土合金中添加已经熔融好的其它合金化元素,例如Al、Zn、Mn等,就可以直接配制成镁稀土应用合金产品,大幅节约成本。
上浮镁稀土合金电解法[14,15]是从电解金属镁的工艺发展而来,所用电解槽结构如图5C所示,此法目前只在实验室规模下进行研究。 采用自行设计的小电解槽,模拟电解镁的工艺条件,电解电压在6~8 V,电流在200~300 A,电解温度在650~750 ℃,电解时间为2 h,电解出的镁稀土合金全部上浮,完全可以在现有镁电解槽中实现此工艺,而不需要重新设计电解槽结构。 电解出的合金中稀土质量分数在1%~5%,调整电解条件可制备10%以下的镁稀土合金产品。整个电解过程的电流效率在50%~70%,稀土直收率为60%,镁直收率为80%。 电解质组成和电解参数对电流效率和合金中稀土含量的影响如图6所示。
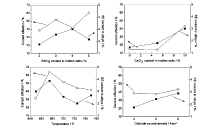 | 图6 RECl3含量、CaCl2含量、电解温度、阴极电流密度对电流效率和稀土含量的影响[47]Fig.6 Current efficiency and RE content in alloys vs. RECl3 and CaCl2 content in molten salts, temperature, cathode current density, respectively[47] |
通过电化学研究[47]发现,上浮镁稀土合金的电解机理不是RE3+和Mg2+的共电沉积,而是在阴极上先电解出金属镁,而后部分金属镁去还原氯化稀土,置换出稀土元素,从而形成镁稀土合金。
1.2.4 电解尾气处理 含氯体积分数10%~30%的电解尾气,可以采用适当的溶剂(如四氯化碳)吸附尾气中的氯,然后将含氯的溶剂加热或减压,使氯气解析出来,成为高浓度的氯气进行利用。 对含氯体积分数小于10%的电解尾气的吸收方法则有两种:一是使含氯尾气通过灼热的铁屑制取三氯化铁;二是使含氯尾气通入氢氧化钠或石灰水溶液中,回收次氯酸钠或漂白粉[17]。
本研究小组发明了一套新型处理电解熔融氯化物阳极产生的氯气吸收装置[48,49],如图7所示,其主要工作原理是:
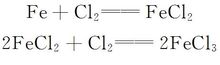
三氯化铁质量分数小于40%时,氯气吸收效果好;三氯化铁质量分数在40%~60%之间,氯气吸收效果一般;如果三氯化铁质量分数超过60%,不再能吸收氯气时,可以补加铁粉,进行还原再生,反应方程式为:
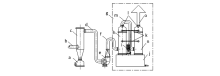 | 图7 电解熔融氯化物阳极产生的氯气吸收装置示意图[48,49]Fig.7 The structural diagram of an absorption device for chlorine produced by chloride electrolysis[48-49] a.dust collector; b.chlorine inlet; c.dust wiper; d. middle pipes; e.draught fan; f.jiont pipes; g.cell; h.purification tower; i.pumps; j.reservoir; k. pipes; l.gas and water seperator; m.pipes; n.purification tower; o.chlorine outlet |
该装置的优点在于,在尾气进入净化塔之前,采用旋风除尘器,把气体和粉尘分离,避免粉尘进入储液箱和净化塔;还原剂则采用铁粉代替以往通常采用的铁屑,减小了铁屑对电机的破坏;可以视氯气产量的多少和氯气被吸收效果的不同情况,增加高效净化塔的数量。 整套设备氯气吸收率高,废气中的氯含量<3 mg/L,达到国家排放标准。
2.2.5 中试试验成果 氯化物电解制备镁稀土合金的方法:下沉液态阴极法和共电沉积法已经进行了中试规模生产,而上浮镁稀土合金电解法则处于实验室研发阶段。
江苏宜兴田园轻合金材料有限公司应用 “下沉液态阴极法电解生产镁稀土中间”技术,于2005年在500吨/年生产能力的电解槽上经3个月的连续运转试验,成功生产力3个品种的稀土镁中间合金,其电解工艺指标达到:稀土质量分数10%~15%,15%~25%(质量比),成分均匀,稀土收率≥90%,电流效率≥60%。
本研究小组采用无水氯化物和部分含水氯化物原料,共电沉积法电解工艺技术指标:电压 U=10~12 V,电流 I=1500~2500 A,电解温度 t=850~950 ℃,连续电解生产24 d,共生产稀土镁中间合金产品371 kg,制备的稀土镁合金中稀土质量分数30%~70%,合金中杂质含量低,电流效率60%~80%,稀土收率60%~70%,镁收率90%以上。 中国科学院青海盐湖所采用不脱水的氯化物原料也进行了中试,试验效果良好。
2.2.6 超轻合金Mg-Li-RE合金电解机理研究 采用氯化物电解制备镁稀土合金的研究中,哈尔滨工程大学的张密林、韩伟教授等把工作主要集中在制备含锂的三元镁合金和铝合金[50,51,52,53,54,55,56,57,58]上,并深入研究了电化学反应机理。研究的三元系镁合金合金包括Mg-Li-La[59]、Mg-Li-Yb[60]、Mg-Li-Y[61]、Mg-Li-Ce[62]、Mg-Li-Er[63]、Mg-Li-Gd[64]、Mg-Li-Sm[65]、Mg-Li-Pr[66]、Mg-Li-Dy[58]和Mg-Li-Ho[53]等,所用的电解质组成为KCl-LiCl-MgCl2-RECl3等,电解温度在550~700 ℃之间,电化学实验装置如图5D所示,制备出的合金中Li质量分数为20%~50%,RE质量分数为1%~15%。 同时采用循环伏安法、计时电位法、计时电流法等研究了Mg-Li-RE共电沉积的机理。
现将以上4种镁稀土合金电解工艺方法进行总结对比,如表2所示。
| 表2 4种镁稀土合金电解工艺方法对比 Table 2 Comparison of 4 different methods to producing Mg-RE alloys |
含有不同稀土元素的镁合金的性能差别很大,应用也有所区别。 例如,在军工、航空航天领域应用的镁合金[1]:WE54(Mg-5.4Y-2.3Nd-1.6Gd-0.5Zr)镁合金,具有良好的浇铸、时效硬化及高温抗蠕变性能;Mg-8Gd-HRE(重稀土HRE:Y、Dy、Ho、Er)系镁合金中,HRE在镁合金中有很大的固溶度,易取代Gd在基体中的位置,利于提高Gd的时效硬化作用,从而提高合金的力学性能和耐热性;这些含重稀土的镁合金适宜采用氧化物电解法制备中间合金(Mg-Gd,Mg-Y等),但是这些重稀土元素含量高的镁合金,造价很高,只能用于军工或航空航天领域。
民用市场需要适用廉价的稀土镁合金:1)国内外公认稀土是提升镁合金综合性能的最有效、最具发展潜力的合金化元素,但许多科技人员又公认为稀土价太贵用不起,还担心稀土能否持续供应。而且多年来,稀土产业发展的瓶颈问题是稀土元素产销不平衡,即:轻稀土中的Pr、Nd紧缺,发展迅速,带来大量LaCe剩余物积压,亟待开发应用。 2)青海察尔汗盐湖区是我国正在开发的钾肥工业基地,该湖区中氯化镁的储量达16.2亿吨。 在钾肥生产过程中,每生产1吨氯化钾可副产8~10吨氯化镁。 目前,副产的氯化镁没有回收利用,而是随老卤直接排放到了盐湖中,这既造成了资源浪费,又有可能会破坏盐湖的资源结构乃至生态平衡,影响盐湖资源的可持续开发利用,因而盐湖中氯化镁的综合利用急需解决。 因此,无论采用共电沉积法还是上浮镁稀土合金电解法,制备Mg-LaCe合金都可以解决LaCe稀土资源和氯化镁资源的积压问题,而且可以开发出低成本的Mg-LaCe合金,不必担心资源持续供应问题,可以促进稀土镁合金持续发展,为镁稀土合金在交通运输、通信信息、3C产业等民用领域的广泛使用提供保障。
将电解制备镁稀土合金的方法从实验室规模扩大到中试试验,将中试实验规模推广到工业化生产,这是今后电解法制备镁稀土合金的主要工作。 同时,继续加强电解制备镁稀土合金的机理研究,优化稀土的加入工艺,为军工、航空航天事业开发更高性能的镁稀土合金,为民用产品开发低成本的镁稀土合金,共同为镁稀土合金在各领域的广泛使用奠定基础。
本文属于开放获取期刊,遵循CCAL协议,使用请注明出处。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|