采用等体积浸渍煅烧法制备钴改性活性焦(Co-AC),并采用BET、XRD等分析手段进行表征。 利用固定床吸附实验台,研究了模拟煤气(N2、H2、CO、H2S)气氛下汞的吸附特性,重点关注H2S对汞吸附的影响。 结果表明,5%负载量的Co-AC在120 ℃和H2S作用下具有优异的脱汞能力,2 h内平均脱汞效率高达97.8%。 此外基于密度泛函理论,首先计算了H2S、HS及S在Co3O4(110)表面的吸附能及键长,通过比较H—S键键长的变化得出H2S会逐步解离成HS与S,然后将优化后的S-Co3O4(110)作为Hg的吸附基底,研究其吸附特性,得出Hg与S反应生成稳定的HgS,吸附能为-3.503 eV,证明了汞的吸附遵循Eley-Rideal机制。 Co-AC吸附剂在高温下脱汞性能受到极大的抑制,因为随吸附温度升高,表面活性硫的减少及硫和汞的反应平衡常数下降显著,导致汞的脱除能力下降。 本文采用了实验加模拟的手段,探明了H2S存在时Hg0在钴基吸附剂表面的反应机理,为协同脱除煤气中的H2S和Hg0提供了理论指导。
Activated coke modified with cobalt(Co-AC) were prepared through impregnation and high temperature calcination method, and then characterized by BET(Brunauer-Emmett-Teller), XRD(X-ray diffraction) analysis. The adsorption of gas-phase elemental mercury by Co-AC under nitrogen and simulated syngas(N2, H2, CO, H2S) was studied on a bench-scale fixed-bed apparatus and focus on the influence of H2S. The results show that 5%Co-AC exhibits excellent Hg0 removal capacity at 120 ℃ and 97.8% of Hg0 can be removed in the presence of H2S. In addition, based on the density functional theory, the adsorption energy and bond length of H2S, HS and S on Co3O4 (110) surface were calculated. Firstly, H2S will dissociate into HS and S in turn by comparing the bond length of H—S. Secondly the adsorption characteristic of Hg was calculated on S-Co3O4(110 ). The results indicate that Hg reacts with S to form a stable HgS with an adsorption energy of -3.503 eV and the adsorption of Hg follows Eley-Rideal mechanism.With an elevated temperature, mercury removal is suppressed, because the amount of active sulfurs on the surface decreases and the interaction between Hg and S is weakened. The reaction mechanism of Hg0 removal on the surface of cobalt-based adsorbents in the presence of H2S was proved. This provides a theoretical guidance for synergistic removal of H2S and Hg0 in coal gas.
我国作为能源消费大国,尤其是化石燃料煤的大量燃烧,使得汞污染日益严重,汞的控制越来越受到重视。 汞具有高挥发性、剧毒性和生物沉积性,严重威胁着人类的健康[1]。 因此,为了减少燃煤造成的汞污染,促进能源与环境的绿色可持续发展,煤炭的清洁利用变得尤为重要。
煤气化作为一种高效、清洁的煤利用技术,是发展煤基化学品合成、液体燃料合成、多联产系统等重要工业的基础[2]。 但煤气化过程中仍会释放污染物重金属汞,且汞的释放量高于燃煤烟气中的汞含量,其中大约93%~99%为零价汞[3],而煤气的还原性气氛不利于零价汞的氧化脱除。 目前关于汞排放和控制的研究主要集中在燃煤烟气中,而煤气中脱汞的研究则相对较少。 随着煤气化技术快速发展,加强煤气化过程中汞污染控制的基础研究,开发经济、高效的煤气中汞污染控制技术显得尤为重要[4]。
目前,脱汞吸附剂的研究尚未成熟,仍存在一定的问题。 如部分贵金属通过汞齐反应在200~400 ℃具有较好的汞脱除效果,但受煤气中H2S和HCl等气体的影响较大,且制作成本较高,能否应用于实际运行中还有待证实[5,6,7]。 Wu等[8]研究了还原性气氛下氧化铁改性吸附剂对汞的脱除效率,得出60~100 ℃是最佳脱汞温度,H2S能极大地促进对汞的吸附。 活性焦作为一种炭基吸附剂,原料易得、廉价,有着发达的初始微、介孔结构和丰富的官能团,作为负载材料具有一定的优势[9]。 又由于本身较大的比表面积使其具备一定的吸附能力,通过负载金属氧化物不仅可以增强吸附剂的热稳定性从而提高汞的吸附温度[10,11],同时又能极大地提高汞的脱除性能[12]。 四氧化三钴在CO和NO x的催化氧化过程中表现出强大的氧化能力,推断钴基吸附剂能在还原性气氛下提供充足的活性氧,将较难脱除的Hg0氧化成易被吸附的二价汞化合物。 本文通过等体积浸渍法,制备出高分散性的钴改性活性焦。 在固定床反应器上研究不同气氛、不同温度、不同负载量对脱汞性能的影响,并结合VASP软件的计算共同揭示了在H2S存在时,钴改性活性焦脱汞的吸附机理。
六水合硝酸钴为分析纯试剂,购置于国药集团化学试剂有限公司。 N2(99.99%)、H2(99.99%)、Co(99.99%)均购自杭州金工气体有限公司,H2S(1%)购自杭州新世纪气体有限公司。 原料半焦取自浙江大学煤炭分级转化清洁发电循环流化床热解炉,热解温度为600~700 ℃。表1为半焦的工业和元素分析结果。
| 表1 原料半焦的工业分析和元素分析结果 Table 1 Proximate and ultimate analysis results of raw semi-coke |
样品的比表面积和孔结构采用ASAP2020型比表面和孔径分布测定仪(美国麦克公司)进行测定;样品物相结构由X'Pert Powder型X射线衍射仪(XRD,荷兰帕纳科公司)测定。 实验过程中汞浓度由美国Tekran公司生产的3310Xi烟气汞在线监测系统实时监测。
首先将半焦置于固定床中,以10 ℃/min的升温速率至600 ℃,在N2气气氛中炭化30 min。 随后继续升温至900 ℃,以CO2作为活化气体保持120 min,制得活性焦(AC)。 本实验采用等体积浸渍法制备吸附剂,先取一定质量的活性焦,按照负载比例配置不同浓度的硝酸钴溶液,将溶液与活性焦充分混合,搅拌30 min,再经超声波震荡30 min,然后在105 ℃下干燥12 h,再置于N2气气氛500 ℃下煅烧3 h,随后在300 ℃的空气气氛中保持1 h,待冷却后研磨至250 μm,密封保存,记为 w%Co-AC, w表示Co3O4相对AC的质量分数。
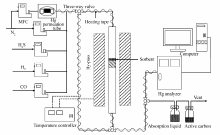
实验固定床吸附系统示意图见图1,主要包括5个部分:配气系统、汞蒸气发生器系统、石英管反应系统、气体分析系统和尾气处理系统。
实验过程中,气体总流量为1.5 L/min,由高纯N2气通入含有汞渗透管(美国VICI公司生产)的蒸汽发生器携带出Hg0蒸气,并与其余气体混合。 根据实验要求,将反应器入口的单质汞质量浓度控制在40 μg/m3左右。 同时,为了避免汞蒸气在管路上的冷凝,系统管路全采用聚四氟乙烯材料管,并通过伴热控温在120 ℃以上。 每次实验取0.2 g吸附剂。 本实验定义某时刻吸附剂对汞的脱除效率为:
式中, ρout和 ρin分别为反应器出口及入口总Hg的质量浓度(μg/m3)。
表2为活性焦负载不同比例Co3O4的物理结构性质。 由表2中的数据可以看出,负载量为5%和10%的活性焦,其比表面积、总孔容和平均孔径均有增大,其主要原因是Co-AC高温煅烧,导致Co(NO3)2·6H2O在分解过程中与活性焦表面发生反应,具有开孔的效果。 但是,当Co3O4负载量达到15%时,Co xO y在活性焦表面发生团聚现象(可以从图2看出),导致孔结构被堵塞,从而使比表面积变小。
| 表2 吸附剂的物性参数 Table 2 Properties of sorbents |
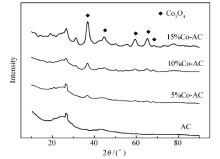
图2为不同负载量Co-AC吸附剂样品的XRD图。 由图2可知,除活性焦本身的衍射峰外,在37°、45°、59°、65°和69°附近出现了Co3O4的衍射峰,且随着Co3O4的质量分数从5%上升到15%,其衍射峰面积增加,半宽高变窄,说明结晶度越高,晶粒尺寸越大。 而质量分数5%负载量的衍射峰相对不明显,说明Co3O4在样品表面的分散性较好。
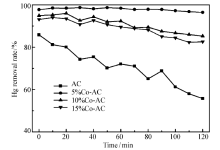
为了研究钴负载量对汞脱除效率的影响,将上述制得的不同负载量的活性焦置于N2和0.04%H2S的气氛下进行汞吸附实验,床层温度控制在120 ℃,结果见图3。 由图3可知,未负载的活性焦2 h内平均脱汞效率为67.5%,且吸附剂失活速度较快;而负载Co3O4的活性焦能长时间保持较高的脱汞性能,且5%负载量的吸附效果最好,一方面是因为比表面积增加加强了物理吸附能力,另一方面提供了活性氧使得化学吸附能力提升,2 h内平均脱汞效率高达97.8%,效率提升了30.3%。 当Co3O4负载量增加至10%时,比表面积和总孔容下降,削弱了吸附剂的脱汞能力,且削弱幅度要大于活性氧数量增加的促进幅度。 继续增至15%时,效率几乎不发生变化,说明二者影响效果相互抵消。
原始活性焦具有一定脱汞能力的主要原因有两个:一是其本身具有较大的比表面积,在较低的温度下通过物理吸附能脱除一部分的汞;二是因为活性炭本身存在着含氧官能团,如羰基和脂基具有较强的氧化性[13],且羰基官能团中的氧原子含有孤对电子,呈一定的碱性,能够增强对H2S气体的吸附能力,同时,也能够为Hg提供活性位[8]。 而负载了5%Co3O4的活性焦除了进一步增加比表面积,增强物理吸附的同时,又提供了充足的晶格氧,加强了对Hg的化学吸附。 因此,后续实验选取5%Co-AC作为研究对象。
图4 A、4 B分别为H2S对AC和5%Co-AC脱汞效率的影响曲线图。 本实验选取的反应温度为120 ℃。 由图4可知,在N2气气氛下,Co-AC具有一定的脱汞能力,2 h内平均脱汞效率为51.4%。 主要由两方面体现:一是未负载活性焦因其高比表面积具备了一定的吸附能力,2 h内平均脱汞效率为35.3%;二是根据Mars-Maessen机理[14,15],负载的Co3O4提供了能氧化单质汞的晶格氧,使得脱汞效率提升了16.1%。 化学反应式如下:
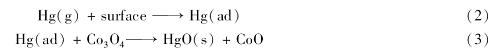
式中,Hg(ad)表示吸附剂表面的吸附态汞.。
 | 图4 H2S对不同吸附剂脱汞效率的影响Fig.4 Effect of H2S on Hg0 adsorption capacity of different sorbents A.AC; B.5%Co-AC |
此外,从图4 B中可看出,在添加H2S后,吸附剂的脱汞能力显著提升,2 h内平均脱汞效率从51.4%上升到97.8%,极有可能存在着新的不同的吸附机理。 为了探究新的机理,设置了一组对吸附剂进行H2S预处理的实验,即在120 ℃、将流量为1.5 L/min的N2+0.04%H2S气体通入装有5%Co-AC的反应器,反应20 min后通N2气吹扫,随后再进行吸附实验。 由图4可知,H2S预处理后的吸附剂在N2气气氛下相较于未处理的能保持较长时间的高效脱汞,说明在吸附过程中很可能存在Hg与S的非均相气固反应。 因此,推测H2S存在时,Co-AC吸附剂脱汞反应很可能符合Eley-Rideal机制[16],即H2S在吸附剂表面氧化生成活性的Sad,Sad再与气体中的Hg0发生氧化还原反应生成HgS。 反应式如下:

式中,O*表示吸附剂表面的晶格氧以及吸附态氧,Sad表示吸附剂表面的活性单质硫。
本小节采用基于密度泛函理论的VASP(Vienna ab-initio simulation package)[17]软件包进行。 电子的交换关联势采用广义梯度近似GGA(Generalized Gradient Approximation simulation package)下的PW91(Perdew-Wang 1991)泛函来进行描述[18,19]。 离子实采用PAW方法进行描述,价电子用平面波基组扩展[20,21]。 本计算过程中采用的平面波截断动能(ENCUT)为400 eV。 高斯展开参数Sigma设定为0.2 eV,k点采用Monhkorst-Pack方法生成,网格设置为8×8×8。 引入Hubbard U参数来消除由于Co3O4的高度电子相关态所引起的误差。 为了更好地确定表面结构和能量性质,计算过程中采用( U- J)=3.3 eV[22]的计算参数。 基于自旋极化方法考虑了Co原子的自旋。 优化过程中参数保持不变,并设置力的收敛精度为0.2 eV/nm。 晶胞优化后参数 a= b= c=0.8072 nm,计算值与实验值相吻合。
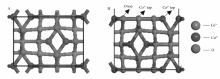
本小节主要研究Co3O4(110)面上3个不同位点(Co2+顶位、Co3+顶位、O顶位)的吸附行为,如图5所示。 对于Co3O4(110)面,设定真空高度为1.5 nm,布里渊区采用了3×4×1的网格。
定义物种Y在Co3O4表面的吸附能 Eads为:
式中,Y为吸附物种。 E(slab+Y)为体系吸附Y物种后的总能量(eV); E(slab)为吸附前基底总能量(eV); E(Y)为Y物种的基态能量。 计算出的吸附能为负值,负值越大,说明吸附作用越强,吸附体系越稳定。
2.4.1 H2S在Co3O4(110)面的吸附
H2S在Co3O4(110)面上的吸附能和主要参数如表3所示,优化后结构如图6所示。 由表3可知,H2S化学吸附在Co3O4(110)表面上,Co2+顶位构型吸附最为稳定,吸附能为-1.717 eV,S到表面的距离为0.1644 nm ,H2S分子的S—H键键长分别是0.1357和0.2270 nm,其中一个键长远大于吸附前H2S分子的S—H键长0.1348nm,说明H2S在吸附过程中有一个S—H键发生断裂。 即H2S在Co3O4表面吸附时发生解离,生成了HS+H。
| 表3 H2S在Co3O4(110)面的吸附能和主要参数 Table 3 Adsorption energy and main parameters of H2S on Co3O4(110) |
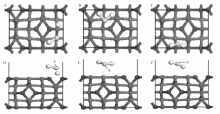 | 图6 H2S在Co3O4(110)面不同位点的吸附结构Fig.6 Structures of adsorbed H2S at different sites on Co3O4(110) A, B, C are the top view of Co2+ top, Co3+ top, O top; D, E, F are the corresponding side view |
2.4.2 HS在Co3O4(110)面的吸附
H2S在Co3O4(110)面上的吸附能和主要参数如表4所示,优化后结构如图7所示。 由表4 可知,HS同样化学吸附在Co3O4(110)表面上,且在Co3+顶位构型吸附最为稳定,吸附能为-2.778 eV,S到表面的距离为0.1612 nm,S—H键键长是0.1762nm,大于基态HS分子的S—H键长0.1350 nm,说明HS在吸附过程中S—H键发生断裂。 即HS在Co3O4表面进一步发生解离,生成了S+H。
| 表4 HS在Co3O4(110)面的吸附能和主要参数 Table 4 Adsorption energy and main parameters of HS on Co3O4(110) |
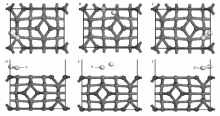 | 图7 HS在Co3O4(110)面不同位点的吸附结构Fig.7 Structures of adsorbed HS at different sites on Co3O4(110) A, B, C are the top view of Co2+ top, Co3+ top, O top; D, E, F are the corresponding side view |
2.4.3 S在Co3O4(110)面的吸附
S在Co3O4(110)面上的吸附能和主要参数如表5所示,优化后结构如图8所示。 由表5可知,3个吸附构型中Co2+顶位优化得到的最为稳定,吸附能为-3.422 eV,S到表面的距离为0.1200 nm。
| 表5 S在Co3O4(110)面的吸附能和主要参数 Table 5 Adsorption energy and main parameters of S on Co3O4(110) |
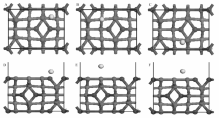 | 图8 S在Co3O4(110)面不同位点的吸附结构Fig.8 Structures of adsorbed S at different sites on Co3O4(110) A, B, C are the top view of Co2+ top, Co3+ top, O top; D, E, F are the corresponding side view |
2.4.4 Hg在S-Co3O4(110)面的吸附
由以上计算结果可知,H2S在Co3O4(110)表面发生了解离吸附,具体表现为S—H键出现较大地增长,反应式如下:
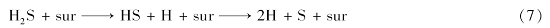
式中,sur代表Co3O4(110)面。 继而本节选取了S-Co3O4(110)面最稳定吸附构型作为Hg的吸附基底,选取S顶位为Hg吸附位点,来考察S-Co3O4(110)面对Hg的吸附性能究竟如何。 优化后的吸附能及主要参数如表6所示,吸附结构如图9所示。 由表6可以看出,Hg在S-Co3O4(110)面的吸附能为-3.503 eV,为较强的化学吸附,说明Hg与单质S反应形成了较为稳定的HgS,而S—Hg键键长为0.2293 nm,相较于基态的HgS键长0.2279 nm来说,键长有所增加。证明了2.3小节的猜想,符合Eley-Rideal机制。
| 表6 Hg在S-Co3O4(110)面的吸附能和主要参数 Table 6 Adsorption energy and main parameters of Hg on Co3O4(110) |
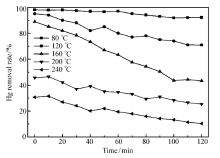
吸附剂的脱汞效率与温度关系密切,因此研究温度的影响十分必要。 实验选取80、120、160、200和240 ℃共5种温度来研究其对Co-AC脱汞性能的影响,实验气氛为N2+30%H2+20%CO+0.04%H2S。 结果见图10。
由图10可知,随着床层温度的升高,5%Co-AC吸附剂的脱汞效率呈下降的趋势。 当吸附温度为80 ℃时,脱汞效果最好,2 h内平均脱汞效率为95.1%,随着时间的增加脱汞性能有所下降。 从图10中还能看出,当吸附温度达到240 ℃时,平均脱汞效率显著地下降到了19.8%。
主要原因可能如下:1)由上述计算结果可知H2S会在 Co3O4表面解离生成Sad,再与Hg反应生成HgS,通过表7可知,随着反应温度的升高,平衡常数 K显著下降,正向反应受到极大地抑制,导致高温下吸附剂的脱汞效率有所降低;2)此外硫单质的熔点仅为112.8℃,当温度较高时导致吸附剂表面部分Sad熔化甚至升华从而被气流给带走,使得活性硫减少,脱汞性能下降。 实验过程中吸附温度超过160 ℃时,石英管壁出现明显的黄色物质,推测为硫单质;3)根据WU等[8]的研究,发现HgS的分解温度在180~350 ℃,可知高温下HgS不稳定,极易分解,这也是导致200 ℃以上脱汞效率低的原因之一。
钴改性活性焦极大地提高了活性焦的脱汞性能,在120 ℃、N2+0.04%H2S的气氛下,负载5%钴的活性焦较原始活性焦2 h内平均脱汞效率提高了30.3%;对于Co-AC吸附剂,H2S对于脱汞起着决定性的作用,在纯N2气氛中添加0.04%H2S,使得脱汞效率从51.4%上升到了97.8%。 通过实验和模拟相结合发现,H2S在Co3O4表面解离生成活性Sad,进一步与气态Hg反应生成HgS,符合Eley-Rideal机制;高温极大地抑制了Co-AC吸附剂脱汞,在200 ℃以上脱汞性能显著下降,主要原因:首先S单质熔点较低导致表面部分活性S损失;其次活性S和Hg的反应平衡常数随温度上升下降明显;最后生成的HgS在高温下容易分解。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|