三维光学断层成像(Three Dimensional Optical Tomography Imaging)是以光学探针标记的分子或细胞为成像源,在外部光源的激发下产生发射光,通过测量组织边界处的光强,结合光子在组织中的传播模型,来重建出组织内部发射光分布图像以及组织光学参数。 三维光学断层成像能够提供目标物在生物体内的分布信息,克服平面成像的局限性。因此,在肿瘤检测、基因表达、蛋白质分子检测、揭示机体功能变化等方面有着很大的应用潜力。 本文总结了光学相干断层成像(Optical Coherence Tomography,OCT)、荧光分子断层成像(Fluorescent Molecular Tomography,FMT)、生物自发光断层成像(Bioluminescence Tomography,BLT)、切伦科夫荧光断层成像(Cerenkov Luminescence Tomography,CLT)等三维光学断层活体成像技术的新进展,分析了其在实际应用中所面临的技术挑战并探讨了相应的解决方案。
During three dimensional optical tomography bioimaging, the imaging targets( e.g., cells or tissues) were labeled by optical probes that can emit luminescence or generate strong light scattering under the excitation of an external light source. The three dimensional bioimage including the distribution of emission light in tissue and optical parameters of tissues can be reconstructed by combination of light intensity at the tissue boundary and the model of the photon propagating in the tissue. Three-dimensional optical tomography can provide the distribution information of target in the organism, overcome the limitation of plane imaging, and have great potential in tumor detection, gene expression, protein molecular detection, and revealing the change of body function. Through analyzing the recently published research results, the review summarizes the recent progress of three-dimensional optical tomography imaging technologies including optical coherence tomography(OCT), fluorescent molecular tomography(FMT), bioluminescence tomography(BLT) and Cerenkov luminescence tomography(CLT) in the biomedical and bioanalytical fields. The technical challenges faced in practical applications are analyzed, and the corresponding solutions are discussed.
光学分子影像学技术是一种采用生物发光(Bioluminescence,BL)和荧光(Fluorescence)进行活体动物体内成像的一种技术,是现在生物医学研究的重要手段之一[1,2,3,4,5]。 相对于其它分子影像技术(磁共振成像(Magnetic Resonance Imaging,MRI)、电子计算机断层扫描(Computed Tomography,CT)、放射性核素成像(正电子发射型计算机断层显像(Positron Emission Computed Tomography,PET)和单光子发射计算机断层成像术(Single-Photon Emission Computed Tomography,SPECT)等),光学分子影像具有高度灵敏、实时直观、成像快速、操作简便、成本低、无放射性危害且可同时观测多分子事件等优点。 尽管光学分子影像学技术已被广泛应用于药物开发、肿瘤早期诊断及复发监测、辅助治疗、预后判断等生物医学领域;但是其也具有荧光分子的不稳定性所导致的重现性差、光在体内散射使探测深度表浅等不足。 由于空间分辨率相对较差并缺乏深度信息,常规平面光学成像不能用于定位组织深处的光学探针,因此难以通过其获得特定分子或目标在组织内的空间分布信息。
近年来,多功能光学分子探针[6,7,8,9,10,11]和各种三维光学断层成像技术,包括光学相干断层成像(Optical Coherence Tomography,OCT)[12,13,14]、荧光分子断层成像(Fluorescent Molecular Tomography,FMT)[15,16,17,18]、生物自发光断层成像(Bioluminescence Tomography,BLT)[19,20,21,22,23]、切伦科夫荧光断层成像(Cerenkov Luminescence Tomography,CLT)[24,25,26,27,28,29,30,31]等新技术的发展,提高了光学成像的灵敏性和特异性,探测深度、范围和空间分辨率,使光学分子影像技术在生物医学的基础和应用研究中展现出良好的前景。 本文通过分析最近发表的一系列有关三维光学断层活体成像技术和多功能纳米探针制备的研究结果,探讨了三维光学断层活体成像在临床分析中的应用前景与技术局限。
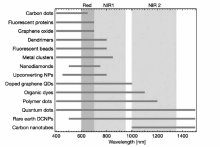
光在生物组织散射现象、生物组织的自发荧光和血红蛋白等在可见光波段的高吸收是活体光学成像的3个基本障碍[32,33,34,35,36]。 光学分子探针在光学成像中起着至关重要的作用,由于性能优良的光学分子探针必须具备良好的生物相容性、高灵敏度、充分有效的组织穿透性和高分辨率等特点,因此设计和制作适用于体内成像光学探针具有很大的挑战性。 目前,光学探针主要包括两大类:1)传统的小分子有机荧光染料;2)纳米发光材料,如量子点(Quantum Dots,QD)、碳点(Carbon Dots,CD)、聚合物点(Polymer Dots,PD)、荧光贵金属簇(Fluorescent Noble Metal Clusters)、稀土掺杂的上转换纳米粒子(Rare Earth Doped Upconverting Nanoparticles,UCNPs)等[6,7,8,9,10,11,37,38,39,40,41,42,43,44,45]。 主要光学探针的发射光性质如图1所示[40]。 近年来,随着材料化学尤其是纳米技术的发展,出现了大量新型光学多功能纳米探针,推动了光学成像在生物医学多个领域中的应用,并向多参数成像、疾病诊疗一体等方向发展。 与小分子有机荧光染料探针相比,纳米光学探针具有:1)大的反斯托克斯位移可以轻易地将发射与激发光区分开,能够有效消除激发光导致的背景干扰;2)窄的发射带宽适合多路成像;3)无光漂白,可以进行长时间重复成像;4)能够通过增强渗透和保留(Enhanced Permeability and Retention,EPR)效应实现在病变(如肿瘤等)部位被动积累,从而极大地提高了其成像灵敏度等优点。 另外,纳米光学探针易与分子靶向配体、其它造影剂组合,实现纳米光学探针的主动肿瘤靶向性和多功能性,从而提高诊断的选择性和准确性。 如我们课题组[46,47,48]构建了系列基于UCNPs的纳米探针应用于活体多模态(上转换荧光/MRI/CT)成像及分子影像指导下的肿瘤光热-化学联合治疗。 最近,我们[48]使用凝集素UEA-1修饰的UCNPs成功地实现了对结直肠肿瘤SW480的特异性多模态成像。
光学相干断层扫描技术/光学相干层析成像(OCT)是从光学相干域反射仪(或光学低相干反射仪)发展而来的一种成像技术[12,13,14]。 OCT利用弱相干光干涉仪的基本原理,检测生物组织不同深度层面对入射弱相干光的背向反射或几次散射信号,实现对生物组织高分辨非侵入层析测量。 OCT能够通过对不同组织层面的光学扫描获得生物组织二维或三维结构图像。 1991年,Huang等[49]在Science上首先报道了OCT技术之后,1994年,Schmitt等[50]又将OCT用于生物组织光学特性参数测量。 继1996年OCT被应用于眼科疾病的临床检测以来,OCT逐渐被应用于皮肤科、心血管、消化道和泌尿系统等疾病的检查[12,51]。 目前,光学活体组织活检(Optical in Vivo Biopsy)是OCT应用中最具挑战性的领域之一。 相对于其它光学成像技术,OCT光学活检具有微米级分辨率、穿透能力较强等特点,可用于原位评估组织和细胞功能及形态。 近来,Li等[52]通过研究小鼠脑内动脉生成证明OCT有助于揭示动脉生成过程中的包括侧支血管主动扩张、血流量增加等综合信息;并且能够获得动脉的横截面结构图像和淋巴管造影用于评估闭塞性血管疾病(如卒中等)所引起的组织炎症。
纳米探针的应用不仅使OCT的分辨率、灵敏度有了进一步的提高,而且能够实现OCT与其它成像技术的联用[53,54,55]。 Boppart等[54,55]率先将20 nm Fe3O4纳米粒子(Magnetic nanoparticles,MNPs)应用于OCT体外和体内成像(如图2所示)。 与常规OCT相比,基于磁性纳米粒子的磁动势模式OCT(MM-OCT)对肿瘤组织的定位较准确并能够实现与MRI的联用。 Zhou等[56,57]以金三角纳米(Gold Triangular Nanoprism,GTNPS)为探针,利用GTNPS在近红外光区的强光散射能力,开发了一种高分辨率OCT系统应用于研究眼睛对O3和pH的响应。 该研究组证明,基于GTNPS的三维OCT成像适用于指示和估算O3对眼组织的穿透深度以及对组织微环境pH三维成像。 另外,由于GTNPS具有良好的光热转换效应,因此基于GTNPS的三维OCT有望实现与其它技术如红外成像、热成像等的连用,实现分子、离子等在生物组织内分布以及扩散的实时监测。 目前,OCT技术日趋成熟,已经可以用于阐明疾病所引起的生物组织形态变化,在疾病(特别是眼科疾病)临床诊断中发挥巨大的作用,然而,OCT的检测灵敏度和分辨率仍有待进一步提高。
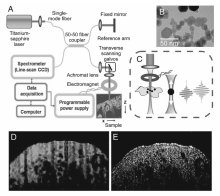 | 图2 MCM-OCT原理[55]Fig.2 MM-OCT principle[55] (A)Schematic of the experimental setup; (B)TEM of the MNPs used in the study; (C)Close-up of the sample arm with focusing lens, electromagnet, and specimen showing axial magnetomotive displacements of MNPs and corresponding change in the OCT interferogram. In vivo (D)MM-OCT and (E)OCT images of livers from MNP-injected mice. In (D) MM-OCT signal(green channel) is superposed on the OCT signal(red channel) |
与传统光纤相比,光子晶体光纤具有易耦合、色散可调、高功率导光等特点。 超荧光纤维源不仅能够减少光极化耦合、瑞利后向散射、光学克尔效应等引起的相干误差和噪声,而且具有光谱宽、功率谱密度大和长期稳定性好等优点。 我们认为,若将光子晶体光纤、超荧光纤维源、高性能纳米光学探针等应用于OCT技术,则能够极大改善其活体成像的灵敏度和分辨率,从而实现OCT在包括肿瘤、心血管等重大疾病的早期诊断中的应用。
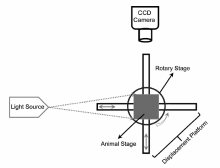
FMT以荧光探针标记的分子或细胞为成像源,在外部光源的激发下产生荧光,通过测量组织边界处的荧光光强,结合光子在组织中传播的模型,来重建出组织内部的荧光光学特性的分布图像以及组织光学参数[15,16,17,18]。 FMT能够提供目标物在生物体内的分布信息,克服平面荧光成像的局限性,在肿瘤检测、基因表达、蛋白质分子检测、揭示机体功能变化等方面有着很大的应用潜力。 FMT仪器系统的结构与CT类似,主要包括激发光源和信号探测器两大部分,根据光源模式的不同,FMT可分为时域(Time Domain,TD)、频域(Frequency Domain,FD)及连续波(Continuous Wave,CW)等。 相比于FD和TD两种模式,基于CW的FMT在仪器制造成本、动物实验的普适性等方面具有显著优势。 信号探测器由支持多视点成像的镜组或旋转台和高灵敏CCD构成(如图3所示)。 早期的FMT主要通过对强散射介质中的荧光强度和荧光寿命进行直接重建而获得肿瘤内部特定分子的代谢水平。 2002年,Ntziachristos等[15]研发了第一代基于光纤接触式的FMT系统,实现了裸鼠脑部神经胶质瘤的在体成像,并获得了一种与肿瘤密切相关的组织蛋白酶的三维分布。
近年来,由于多功能纳米光学探针制备方法、仪器硬件系统和相关图像重构技术的迅速发展,从而使FMT的成像质量、成像时间、图像空间分辨率等有了显著改善;使其在临床前研究中表现出巨大的活力[48,58,59]。 Xi等[58]以含有马来酰亚胺基团的近红外染料NIR-830 标记HER-2亲和性配体(anti-HER-2 affibody)并与氧化铁纳米粒子(Iron Oxide Nanoparticle,IONP)反应制备纳米探针。 使用该纳米探针和手持式FMT系统,该研究组在2 min内成功实现了深度达10 mm的20×20 mm2成像区域的卵巢肿瘤三维非侵入性成像。 借助原始同步启发聚类算法(Original Synchronization-Inspired Clustering Algorithm,OSC),Wu等[59]发展了一种基于同步聚类算法(Synchronization-Based Clustering Algorithm)的FMT技术(SC-FMT)。 该技术具有较好的定位精度,能够通过不同荧光探针的同时定位实现不同疾病相关分子事件的同时监测。 尽管FMT在基础生物医学研究中已取得了一定成果;但是受限于采样质量,FMT的空间分辨率较差,难以实现对散射介质边缘的特定功能分子的监测。 结合高荧光量子产率的近红外光学探针、高精度光学切片技术和EMCCD(Electron Multiplying CCD)等高灵敏成像单元以获得高质量的平面荧光图像,进一步借鉴CT重构技术构建新的算法模型实现FMT图像的三维重构,将能够提高FMT的空间分辨率和灵敏度,从而最终实现临床应用。
Wang等[19]在21世纪初研制出第一台能够采集多视角、多谱段的数据的BLT原型机并在2004年通过专利申请。 与FMT类似,BLT能够通过计算光源在活体动物中的分布来确定光源(如荧光素酶标记的细胞或生物分子)的位置,从而半定量地揭示体内分子和细胞活性,实现疾病的早期诊断、疗效评估和新药开发[19,20,21,22,23,60,61,62,63]。 成像算法和仪器平台研制是BLT研究的两个主要方向。 通常采用蒙特卡洛(MC)方法和数值分析方法两种数学模型来模拟BLT算法的前向问题和逆向问题,其中逆向问题是BLT算法研究的重点。 2006年,Wang等[62]使用所研制的BLT的原型机成功地实现了小鼠体内的生物发光源的定位和量化并应用于肾肿瘤的诊断。 最近,Shi等[63]将BLT用于指导辐射传输和放射治疗疗效评估。 研究结果表明,BLT对裸鼠原位接种4T1乳腺肿瘤的定位精度可达到亚毫米级,并能够提供三维肿瘤信息应用于优化放射治疗所使用的辐射剂量。 尽管BLT在疾病动物模型研究中已取得了一定的研究成果,但其相关技术仍处于发展的初期,有待进一步发展完善。 将BLT与其它活体成像技术相结合能够提高其成像精度。如与小动物CT相结合,Ma等[64]使用BLT对裸鼠肝肿瘤模型内生发光源三维信息进行了重建。 研究结果证明,抗体SM5-1修饰的金纳米粒子能够引起肿瘤细胞膜蛋白P30的过表达,从而有效地增加了肝细胞性肝癌的生长抑制率。 另外,绿色荧光蛋白融合技术、基因转染等在活体成像中的应用也有助于提高BLT的信号强度和特异性,从而改善BLT的准确性和灵敏度[65]。
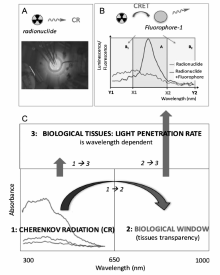
2009年,Robertson等[24]利用放射性核素的切伦科夫辐射(Cerenkov Radiation,CR)产生可见光的现象,使用高灵敏度CCD摄像机首次实现了尾静脉注射18F-FDG裸鼠的切伦科夫荧光成像(Cerenkov Luminescence Imaging,CLI)。 随后,来自于同一研究组的Li等[25,26,27]采用模拟切伦科夫光子在体内的传播及预处理的共轭梯度法,重建了仿体内光源的位置,并与CT图像融合,成功实现了CLT并进行了裸鼠模型实验验证和成像灵敏度优化。 随着所使用的医用同位素范围的扩大,大量的临床研究证明,CLT对浅表结构的成像是非常有用的,而且比任何其它核成像方式(PET等)具有更好的分辨率。 近年来,CLT已成功地应用于小动物和人类的甲状腺及淋巴病变的诊断、治疗监测和术中导航[66,67,68,69]。 中科院自动化所田捷教授课题组[28,30]构建多种CLI纳米探针(如18F标记的Gd2O2S:Tb、Eu2O3等纳米粒子)并发展了一种基于放射性药物激发荧光成像(Radiopharmaceutical-Excited Fluorescence Imaging,REFI)的CLT技术应用于肿瘤术中导航、抗药性胃癌对化疗药物响应等研究。 如以18F标记的Eu2O3纳米粒子为CLT探针实现了直径小于1 mm的超小原位/异位肝肿瘤的可视化[69,70]。 由于切伦科夫荧光的组织穿透能力较弱,CLT难以实现深层组织的图像采集和重建。 构建荧光纳米粒子-核素切伦科夫能量转移(Cerenkov radiation energy transfer,CRET)体系有望改善CLT的信号强度和成像质量(如图4所示)[29,71,72]。 如Volotskova等[71]发现18F和90Y与金纳米族之间的CRET能够显著增强CR的信号强度。 合成对疾病微环境具有智能化响应的CLT探针并研制PET-CLT等多模态成像仪器系统将进一步拓展CLT技术在临床前研究和临床诊断中的应用。
在活体全组织或全器官范围内实时监测特定分子(如蛋白酶、激酶等)的活性水平和空间分布对重大疾病的早期诊断及精准治疗具有积极意义。 尽管使用荧光标记结合光学断层成像的方法在解析局部基因表达、蛋白质分子分布、分子代谢水平等方面取得了较大的进展,但是生物组织的背景荧光干扰和对激发光散射导致以微米分辨率在活体全组织或全器官尺度获取特定分子的三维分布仍然极具挑战。 如何以微米级的分辨率、高选择性在几厘米到十几厘米的空间尺度上快速成像荧光标记探针,是高分辨获取特定分子在活体全组织或全器官的三维分布结构图的难点之一。 与可见光相比,I区(波长范围700~900 nm)和II区(波长范围1000~1350 nm)的近红外光(Near infrared light,NIR)具有较强的生物组织的穿透能力;如近红外荧光最大可穿透12 cm的肺/乳腺组织、6 cm的肌肉组织、5 cm的脑组织[73,74,75,76,77,78,79]。 制备疾病生物标志修饰或组织微环境响应的高性能NIR荧光探针(如上转换纳米粒子、NIR有机荧光染料等)并构建荧光共振能量转移(Fluorescent Resonance Energy Transfer,FRET)体系应用于光学断层成像,将有助于获得选择性好、信噪比高的三维图像,实现深层组织中特定分子事件的实时监测。 将高速、高灵敏CCD成像技术与先进光源和光学传输技术相结合,研制高性能的断层成像系统。 进一步构建分子靶向多模态探针,将NIR光学断层成像技术与其它活体影像技术相结合,提高光学断层成像技术的定位精度和诊断准确度;从而推动光学断层成像技术在肿瘤和心血管疾病诊断、脑组织成像、深层部位干细胞和免疫细胞运动成像、药物研发等生物医学中的应用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|