葡萄糖响应凝胶纤维在血糖监测传感器开发中有着潜在的应用前景。 本文基于微流控纺丝方法和自由基聚合反应制备了化学交联和物理交联的葡萄糖响应聚( N-异丙基丙烯酰胺/3-丙烯酰胺基苯硼酸)(P(NIPAM- co-AAPBA))凝胶纤维。 通过傅里叶变换红外光谱、扫描电子显微镜和力学性能测试等技术手段表征了凝胶纤维的结构和形态、力学性能、溶胀度动力学与葡萄糖响应性。 结果表明,凝胶纤维具有多孔的微观结构,通过改变芯层与壳层溶液的流速可以调控凝胶纤维的直径。 随着AAPBA质量分数的增加,凝胶纤维的溶胀速率和平衡溶胀度均有所降低,但葡萄糖响应性能提高。 与化学交联的凝胶纤维相比,物理交联的凝胶纤维具有良好的力学性能。
Glucose responsive gel fibers have potential application prospects in the development of glucose sensors for monitoring blood glucose levels. In this work, poly( N-ispropylacrylamide/3-acrylamidophenylboronic acid)(P(NIPAM- co-AAPBA)) glucose sensitive hydrogel fibers were fabricated via microfluidic spinning and off-chip free radical polymerization reaction. The structure and morphology, mechanical properties, swelling kinetics and glucose responsiveness of the gel fibers were characterized by Fourier transform infrared spectrometer(FTIR), scanning electron microscopy(SEM) and mechanical test. The results show that the gel fibers have porous microstructures, and their diameters could be controlled by changing the flow rates of the core and sheath layer solution. With the increase of AAPBA mass fraction, the swelling rate and equilibrium swelling degree of the gel fibers are decreased, but the glucose response performance is improved. Compared with the chemically cross-linked gel fibers, the physically cross-linked gel fibers have good mechanical properties.
检测与控制血糖浓度在糖尿病治疗中十分重要[1]。 葡萄糖响应性水凝胶的体积可以在不同浓度的葡萄糖溶液中发生可逆变化[2],将其转化为电信号或光学信号,则有望实现血糖的实时监测[3]。 与大块凝胶相比,葡萄糖响应微凝胶具有更快的响应速度[4],并且有望直接注射于体内以监测血糖浓度[5]。 Shibata等[6]制备了小尺寸的含苯硼酸的荧光水凝胶微球,可连续监测血糖浓度,但微球会从植入部位分散开来,难以固定及去除。 Heo等[7]制备了含苯硼酸的荧光水凝胶纤维,实时检测血糖。 凝胶纤维直径小,具有良好的葡萄糖响应性能,易于注射植入体内,在植入点易固定且方便去除,满足长期稳定的血糖监测的要求。
2004年,Jeong等[8]首次提出了微流控即时纺丝概念,为制备凝胶纤维提供了新途径。 Shin等[9]利用同轴层流微流控装置,将海藻酸钠溶液导入芯层,CaCl2溶液导入壳层,制备连续海藻酸钙纤维,发现通过改变微流道尺寸及其溶液的流速可以精确调控纤维的尺寸。 Lim等[10]通过微流控与光催化制备聚 N-异丙基丙烯酰胺(PNIPAM)凝胶纤维,制备过程中,纤维成型稳定,制备时间较短。
迄今很少见到葡萄糖响应性凝胶纤维方面的报道。 本文报道了基于微流控即时纺丝方法和光引发自由基聚合反应制备 N, N'-亚甲基双丙烯酰胺(BIS)化学交联和无机粘土(Clay)物理交联的连续葡萄糖响应P(NIPAM- co-AAPBA)凝胶纤维。 研究AAPAB(3-丙烯酰胺基苯硼酸)质量分数对水凝胶纤维结构和形态,溶胀度动力学与葡萄糖响应性的影响,并表征了Clay交联凝胶纤维的力学性能。
N-异丙基丙烯酰胺(NIPAM)购自于东京化成公司,甲苯-环己烷(体积比60:40)混合溶剂重结晶; AAPBA按照参考文献[11]合成; N, N'-亚甲基双丙烯酰胺(BIS)购自于美国Fluka公司,采用甲醇重结晶;无机粘土(Clay)“Laponite XLG”:[Mg5.34Li0.66Si8O20(OH)4]Na0.66购自于美国Rockwood公司; N, N, N', N'-四甲基己二胺(TEMED),生化试剂,购自于上海化学试剂公司;安息香二甲醚(BDK)、2-羟基-4'-(2-羟乙氧基)-2-甲基苯丙酮(Irgacure 2959)及海藻酸钠(SA)均购于阿拉丁试剂有限公司;无水氯化钙(CaCl2)购自于上海凌峰化学试剂有限公司。 除特别说明外,以上试剂均为分析纯。
PHD ULTRA型Harvard超级注射泵(北京友诚生物有限公司);UV点光源照射系统(昆山日昌华欣有限公司);XSP-17C型双目倒置生物显微镜(上海光密仪器有限公司);5969型电子万能材料试验机(美国INSTRON公司)。
单体(NIPAM、AAPBA)、光引发剂Irgacure 2959和催化剂TEMED的摩尔比为100:0.852:0.735。 单体与溶剂质量比为1:7.36。 海藻酸钠SA与溶剂质量比为1:100。 BIS质量与单体(NIPAM+AAPBA)总质量比值为2%(BIS质量占单体总质量百分数),Clay质量与单体(NIPAM+AAPBA)总质量比值为32.5%(Clay质量占单体总质量百分数)。 为进行比较,分别标记BIS交联PNA(B)- X凝胶纤维和Clay交联PNA(C) Y凝胶纤维。 X表示AAPBA摩尔数相对于单体总摩尔的摩尔分数。 Y表示添加AAPBA单体质量(mg),与BIS交联体系中单体总质量一致。
微流控纺丝制备凝胶纤维的纺丝过程如Scheme 1所示[12]。 壳层为0.2 mol/L的CaCl2水溶液,芯层为单体NIPAM和AAPBA、SA、交联剂(BIS或者Clay)、TEMED、Irgacure 2959和去离子水组成的凝胶前驱体溶液。
如Scheme 1所示,通过超级注射泵将上述凝胶前驱体溶液和CaCl2溶液分别注入微流控芯片中。 当二者相互接触时,前驱体溶液中的海藻酸钠与CaCl2迅速反应,固化为海藻酸钙,形成连续的初生凝胶纤维(图1C),由卷绕装置收集。初生凝胶纤维放入含有4 mmol/L BDK的油溶液中,在紫外灯光照下进行自由基反应,45 min后得到葡萄糖响应的凝胶纤维。 将制备好的凝胶纤维放在去离子水中48 h浸泡,每隔6 h更换1次去离子水,除去未反应的单体与引发剂等。
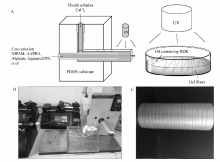 | Scheme 1 Schematic of the preparation process of PNA gel fibers(A), microfluidic device(B), continuous gel fibers(C) |
改变微流体纺丝壳层溶液和芯层溶液的流速,得到不同直径的初生凝胶纤维。 采用双目倒置生物显微镜测量直径,每个样品测量5次取平均值。
采用傅里叶变换红外光谱(FTIR)仪对干燥后的凝胶纤维样品进行结构表征,KBr压片法制样。 将在水中溶胀平衡的凝胶纤维放入液氮中淬冷后,真空干燥12 h,备用。 通过扫描电子显微镜(SEM)下观察其断面的形态,加速电压为10 kV。
将已知质量的干凝胶纤维浸泡在去离子水中,每隔一定的时间,取出凝胶纤维并用滤纸擦去表面水分,称重并记录不同时刻的凝胶纤维质量。 凝胶纤维的溶胀比( SR)定义为:
式中, mt为时间 t时刻凝胶纤维的质量(g), md为凝胶纤维的干重(g)。
将在溶胀平衡的凝胶纤维浸入4 g/L葡萄糖溶液中,每隔30 s用显微镜测量纤维的直径。 根据直径比( DR)公式间接反应纤维的葡萄糖敏感性。
式中, dt为时间 t时刻凝胶纤维的直径(μm), d0为凝胶纤维初始直径(μm),测量5次取平均值。
制备的Clay交联的凝胶纤维不经去离子水浸泡直接用于力学性能的测试,测试标距为2 cm,拉伸速率为20 mm/min。
基于微流控即时纺丝方法和光引发自由基聚合反应制备连续的BIS交联与Clay交联葡萄糖响应凝胶纤维。 传统化学交联剂BIS制备凝胶纤维存在力学性能差、特别是在溶胀状态下强度低等缺点,使其应用受到了限制。
通过无机粘土交联形成的凝胶纤维,力学性能显著提高,因此能拓展应用前景。 同时固定溶剂、引发剂、交联剂等物质用量,考察AAPBA质量分数的不同对凝胶纤维结构及性能的影响,如图1所示,壳层的CaCl2溶液和芯层的凝胶前驱体溶液由注射泵控制以一定速率在微通道内流动,当二者相互接触时形成同轴层流,Ca2+由于扩散作用进入芯层,取代芯层的海藻酸钠链上的Na+,形成海藻酸钙而快速凝固成型[13],经自制的小型卷绕装置收卷后得到连续均匀的初生凝胶纤维。
初生凝胶纤维的内部除海藻酸钙交联网络形成的骨架外,还包含了自由基反应的单体NIPAM和AAPBA、交联剂、促进剂TEMED、光引发剂Irgacure 2959和去离子水。 将初生凝胶纤维放入含引发剂BDK的油溶液中,在紫外光下凝胶纤维内部的光引发剂Irgacure 2959引发自由基聚合反应,与此同时,油溶液中的光引发剂BDK逐渐向凝胶纤维内扩散,并引发聚合反应。 在两种引发剂的共同作用下,凝胶纤维内的单体逐渐聚合、交联,形成葡萄糖响应的凝胶纤维。 仅使用Irgacure 2959引发剂时,自由基聚合反应速度比较慢,而BDK在油溶液中溶解度大,引发速率快,其与Irgacure 2959从初生凝胶纤维内外双向引发自由基聚合,可以提高聚合反应速度,获得连续的、结构均一的凝胶纤维。 此外,除了以常见的化学交联剂BIS可以制备P(NIPAM- co-AAPBA)凝胶纤维外,采用Clay为交联剂也可以制备物理交联的凝胶纤维,而且其力学性能更佳。
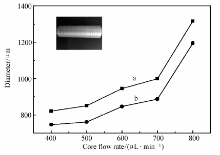
在微流控纺丝过程中,芯层与壳层溶液的流速是控制纤维直径的主要因素。 以PNA(B)-5凝胶纤维为例。 不同芯层与壳层流速下获得的初生水凝胶纤维的直径,结果如图1所示。 在壳层流速固定为900 μL/min时,随着芯层流速从400增大到800 μL/min,凝胶纤维的直径从810增大到1310 μm;当壳层流速固定为1600 μL/min时,凝胶纤维直径亦呈现增大趋势。 这是由于随着芯层流速增大,单位时间内通过芯片的凝胶前驱体溶液增加,导致纤维直径增大。 此外,当芯层流速相同时,壳层溶液流速的增加导致凝胶纤维直径略有下降,其原因是壳层流速的增大导致剪切力增加。 因此,通过调控芯层和壳层溶液的流速可以获得不同直径的凝胶纤维。
图2是海藻酸钠SA、无机粘土Clay及凝胶纤维的红外光谱图。 可以看到,3432 cm-1为SA羧基中的—OH伸缩振动,粘土Clay在波数为1009 cm-1处出现Si—O很强的伸缩振动峰。 PNIPAM的主要特征峰有:1645、1545 cm-1分别为酰胺Ⅰ、Ⅱ的特征峰,2972、2931及2877 cm-1为饱和C—H的伸缩振动峰。 在凝胶纤维的红外谱图中,可以清晰地看到Clay组分中Si—O、SA组分中—OH伸缩振动峰和PNIPAM的主要特征峰,说明Clay、SA和PNIPAM均存在于凝胶纤维中;在PNA(B)-10纤维样品中,还可以观察到1432与1351 cm-1处3-丙烯酰胺基苯硼酸中苯环与硼酸的伸缩振动峰,由此证明AAPBA存在于合成的水凝胶中。
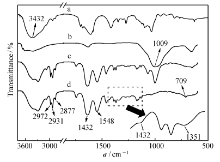 | 图2 SA(a)、Clay(b)、PNA(C)20(c)及PNA(B)-10(d)凝胶纤维的傅里叶变换红外光谱图Fig.2 FTIR spectra of SA(a), Clay(b), PNA(C)20(c) and PNA(B)-10(d) hydrogel fibers |
图3与图4分别是BIS交联与Clay交联的水凝胶纤维溶胀样品的扫描电子显微镜照片。 从图4中可以看出,以Clay为交联制备的水凝胶纤维与传统BIS交联制备的水凝胶纤维一样,可明显的孔洞结构,表明Clay交联并没有影响水凝胶纤维的结构形态。 分别对比图3A~3D与图4A~4D可以发现,随着AAPBA质量分数增加,凝胶纤维孔洞尺寸有所减小,且由于BIS交联的PNA(B)凝胶纤维中AAPBA质量分数增加,孔洞尺寸的变化更加明显。 凝胶纤维孔洞尺寸的减小可能是因为AAPBA上的硼酸基团之间存在氢键作用,导致吸水溶胀能力减小。 SEM照片右图是凝胶纤维中硼元素能量色散谱的映射图,图3A与图4A没有硼元素的能谱点,而图3B~3D与图4B~4D中均显示出硼元素的能谱点,且随着AAPBA质量分数的增加,硼元素的能谱点越多,进一步说明AAPBA成功引入到了水凝胶纤维体系中。
 | 图3 通过BIS交联获得的凝胶纤维的扫描电子显微镜照片Fig.3 SEM micrographs of the hydrogel fibers by BIS cross-linking A.PNA(B)-0; B.PNA(B)-2; C.PNA(B)-5; D.PNA(B)-10 |
图5为不同交联方式制备的凝胶纤维在25 ℃、pH=7.4中的溶胀动力学曲线。 可见,在溶胀初期,凝胶纤维的溶胀度迅速增加,10 min后,趋于平衡。 随着AAPBA质量分数的增加,两类凝胶纤维的溶胀速率和平衡溶胀度均呈现下降趋势。 这与SEM观察的结果一致,随着AAPBA质量分数增加,凝胶纤维孔径减小,说明吸水能力减弱。
图6为凝胶纤维在4 g/L葡萄糖溶液中的响应曲线。 从图6A与6B中均可以看出,两种凝胶纤维在葡萄糖溶液中直径达到平衡的时间均在10 min左右。 不含AAPBA的凝胶纤维在葡萄糖溶液中直径没有变化。 而随着AAPBA质量分数的增加,含AAPBA凝胶纤维在葡萄糖溶液中的直径增加,直至达到平衡。 造成这一现象的原因是在葡萄糖存在的条件下,解离的苯硼酸与葡萄糖分子结合,导致凝胶网络的离子化程度增大,凝胶纤维孔洞由于离子间斥力作用增大,水分子扩散进入凝胶纤维网络结构,导致凝胶纤维溶胀,直径变大。 另外,相比PNA(B)-10水凝胶纤维,PNA(C)20中AAPBA质量分数减少,在达到平衡时直径比相差不多。 这是因为通过Clay交联的水凝胶纤维孔径比较大,利于葡萄糖分子在水凝胶纤维结构中的扩散,与苯硼酸结合,导致水凝胶直径增大。
 | 图6 BIS(A)和Clay(B)交联制备的凝胶纤维在4 g/L葡萄糖溶液中的响应曲线Fig.6 Glucose sensitivity of hydrogel fibers by BIS(A) and Clay(B) cross-linking 4 g/L glucose solution |
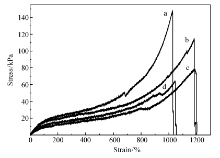
使用化学交联剂BIS制备的凝胶纤维具有受力易破碎的特点,无法进行力学性能测试。 而以粘土Clay为交联剂制备的水凝胶纤维具有较好的力学性能。图7为Clay交联水凝胶纤维的应力-应变曲线,可以看到,水凝胶纤维具有良好的韧性,其断裂伸长率超过了1000%。 相对于使用化学交联剂BIS有明显改善,其原因与Clay的交联机理有关[14]。 Clay主要通过强烈的离子作用和氢键形成交联体系,交联密度较低,交联点中分子链长,具有更大的柔性,又因为Clay片层本身也可以滑移,因而具有优良的强度与韧性。 随着AAPBA的质量分数的增加,凝胶纤维的断裂强度和模量明显下降,其原因是AAPBA的加入,硼酸根与Clay表面离子间作用影响Clay的剥离与分散,使Clay发生聚集,体系初始粘度增大,起不到交联作用。
基于微流控即时纺丝方法和光引发自由基聚合反应成功制备化学与物理交联剂的连续的葡萄糖响应P(NIPAM- co-AAPBA)凝胶纤维。 通过对凝胶纤维的结构分析得出,AAPBA已成功与NIPAM发生共聚,以Clay为交联制备的凝胶纤维与传统BIS交联制备的水凝胶纤维一样,也能形成明显的孔洞结构。 随着AAPBA质量分数的增加,凝胶纤维的溶胀速率和平衡溶胀度均有所降低,但在葡萄糖溶液中的直径增加。 与传统水凝胶相比,通过Clay为交联剂制备的水凝胶纤维具有较好的力学性能。 这种连续的水凝胶纤维易于通过注射植入到体内,并且在植入点易于固定,在体内长期血糖的监测领域具有潜在应用前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|