氨基酸是手性小分子,其选择和固定化的方法,有助于开发新的“刷型”手性固定相(CSP)。 分别以 L-缬氨酸和 L-丙氨酸为原料制备了10种新型氨基酸衍生物手性固定相(CSPs),包括8种氨基酸三嗪衍生物CSPs(CSP-1~CSP-8)和两种对甲基苯甲酰氨基酸CSPs(CSP-9~CSP-10),在正相色谱条件下,考察了所合成的CSPs对邻、间和对硝基苯酚位置异构体以及萘普生乙酯、丙环唑、苯醚甲环唑、戊唑醇、己唑醇和联萘酚6种外消旋样品的分离能力。 结果表明,硝基苯酚的3种位置异构体在CSP-1~CSP-3和CSP-6~CSP-8上获得较好分离。 相同条件下,由丙氨酸制得的CSPs对外消旋样品表现出更好的手性识别能力,萘普生乙酯在CSP-6上获得基线分离。 由化学软件Gaussian 09计算出的 L-丙氨酸三取代三嗪衍生物CSP-Ⅵ与萘普生乙酯的两个光学异构体之间相互作用的结合能分别为52.51和133.9 kJ/mol,也说明了手性选择子与 R、 S形成的非对映配合物的稳定性不同,Gaussian 09所给出的结合构型图显示手性选择子与样品之间有明显的氢键作用。 Gaussian 09的计算结果有助于认识CSPs的手性识别机理。
Ten novel amino acid derived chiral stationary phases(CSPs), including eight amino acid modified triazine derived CSPs(CSP-1~CSP-8) and two N-p-methylbenzoyl L-amino acid CSPs(CSP-9~CSP-10), were prepared from L-valine and L-alanine. The chiral recognition ability of these CSPs was evaluated for regioisomers of o-, m-, p-nitrophenol and six racemates of naproxen ethyl ester, propiconazole, difenoconazole, tebuconazole, hexaconazole, 1,1'-bi-2-naphthol, under normal phase mode. The results show that CSP-1~CSP-3 and CSP-6~CSP-8 exhibit good selectivity for three regioisomers of nitrophenol. The CSPs obtained from L-alanine show better enantioselective recognition toward the racemates, which leads to a baseline separation of naproxen ethyl ester on CSP-6. Meanwhile, the binding mode and association energy of L-alanine three-substituted triazine derivative CSP Ⅵ with R or S naproxen ethyl ester were investigated by computational simulation with Gaussian 09 software, and hydrogen bonding was found to be a significant factor on the enantioselective recognition.
高效液相色谱手性固定相法是分离和获取单一对映体最直接、最简便、最有效的方法之一,研制新的手性固定相(CSP)是其核心和热点[1,2,3,4]。 氨基酸是手性小分子,能与被分析化合物形成很好的 π-π作用、氢键作用和偶极-偶极作用,由其作为原料制备的手性固定相(CSP)具有原料便宜易得,柱容量高等优点,常用来拆分氨基酸及其衍生物,此类CSP属于“刷型”CSPs,这类CSPs的手性选择子的选择和固定化方法,对开发新的“刷型”CSPs具有实际应用价值[5,6,7,8]。 近年来,三聚氰氯逐渐使用在色谱填料的制备中,因其上3个氯原子非常活泼,可以与—OH和—NH2等发生反应,并且通过控制温度可以分步取代三聚氰氯上的氯原子,从而制得不同的衍生物,进而制得色谱填料,用于手性拆分或用于拆分碱性化合物[9,10,11]。
本文分别以 L-缬氨酸、 L-丙氨酸、三聚氰氯和对甲基苯甲酰氯为原料,制备了8种氨基酸三嗪衍生物手性固定相(CSP-1~CSP-8)和2种对甲基苯甲酰氨基酸手性固定相(CSP-9~CSP-10),在正相条件下对6种外消旋手性样品进行了手性拆分,同时还将所合成的CSPs用于对硝基苯酚的3种位置异构体的分离。
LC-10A型高效液相色谱仪(日本岛津公司)。 样品溶解在流动相中,色谱分离实验在室温下进行,检测波长254 nm,流速为0.5 mL/min,灵敏度0.02 A.U.F.S(absorbance unit full scale)。
L-缬氨酸(天津市远航化学品有限公司), L-丙氨酸(天津市光复精细化工研究所),对甲基苯甲酰氯、2-乙氧基-1-乙氧碳酰基-1,2-二氢喹啉(EEDQ)、三聚氰氯(阿拉丁化学有限公司),以上试剂均为分析纯;球形硅胶自制,平均粒径5 μm,比表面积140 m2/g,平均孔径12 nm;碳酸氢钠、盐酸、乙酸乙酯、三乙胺、吡啶等均为分析纯试剂(山东禹王实业有限公司化工分公司);所用流动相均经超声波脱气后使用。用于评价固定相手性识别能力的6种外消旋手性样品为:萘普生乙酯(1)、丙环唑(2)、苯醚甲环唑(3)、戊唑醇(4)、己唑醇(5)和联萘酚(6),结构如Scheme 1所示。
死时间( t0)用1,3,5-三叔丁基苯测定测定。 保留因子( k')、分离因子( α)、分离度( Rs)按照文献[12]方法计算。
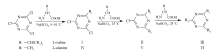
1.3.1 氨基酸三嗪衍生物及其手性固定相的制备 参照文献[10]制备氨基酸三嗪衍生物,略有修改。 称取三聚氰氯(CC)7.74 g,在0~5 ℃下溶于100 mL丙酮中,再称取 L-缬氨酸5.91 g在5~10 ℃下悬浮于约30 mL水中。 将 L-缬氨酸悬浮液加入CC溶液中,用缚酸剂NaHCO3缓慢调pH=8,并在5~10 ℃下反应2 h。 产物用HCl调pH=2,并用乙酸乙酯萃取,旋蒸得黄色固体Ⅰ8.35 g,产率75%。 在此基础上用类似的方法合成 L-缬氨酸二、三取代CC衍生物Ⅱ、Ⅲ。 同理制得 L-丙氨酸一、二、三取代CC衍生物Ⅳ、Ⅴ、Ⅵ,合成路线如Scheme 2所示。
称取产物Ⅰ3.18 g溶于35 mL丙酮中, L-丙氨酸1.25 g的悬浮液添加到丙酮溶液中,用缚酸剂NaHCO3缓慢地调pH=8,并在25 ℃下反应3 h。 产物用HCl调pH=2,并用乙酸乙酯萃取,旋蒸得黄色固体Ⅶ 2.85 g。 mp 182~185 ℃,产率75%,得到先 L-缬氨酸后 L-丙氨酸的氨基酸混合取代三嗪衍生物,同理制得先 L-丙氨酸后 L-缬氨酸的氨基酸混合取代三嗪衍生物Ⅷ。
分别称取衍生物Ⅰ~Ⅷ 2.2 g溶于约50 mL吡啶中,各加氨丙基硅胶2.5 g,三乙胺6 mL,在80 ℃下反应24 h,过滤,依次用吡啶,丙酮,乙醚洗涤,真空60 ℃干燥,得CSP-1~CSP-8,采用匀浆法装柱(150 mm×4.6 mm ID)。
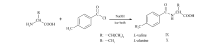
1.3.2 对甲基苯甲酰氨基酸CSPs的制备 参照文献[11]方法,制备对甲基苯甲酰氨基酸CSPs,略有修改。 称取 L-缬氨酸1.47 g,溶于30 mL冰NaOH溶液中,加入约3 mL对甲基苯甲酰氯,在冰浴中反应36 h。 然后加乙醚,除去醚层,用HCl调pH=2,用乙酸乙酯萃取,旋蒸有机相,得白色固体Ⅸ 2.65 g;称取 L-丙氨酸1.25 g,同样反应方式,得白色固体Ⅹ 2.64 g。 衍生物Ⅸ和Ⅹ的熔点分别为:98~101 ℃和151~154 ℃,产率90%和91%。 合成路线如Scheme 3所示。
分别称取产物Ⅸ和Ⅹ 2.2 g溶于约50 mL干燥的THF中,分别加氨丙基硅胶2.5 g, EEDQ 2.5 g,在25 ℃下反应24 h,过滤,依次用THF,丙酮,乙醚洗涤,在真空60 ℃下干燥,得CSP-9和CSP-10。 匀浆法装柱(150 mm×4.6 mm ID)。
1.3.3 结构表征 Ⅰ:IR, σ/cm-1:3236、3044(b)、1726、2972、640分别对应于NH、OH、CO、CH3、CCl;1H NMR, δ:1.08(CH3),2.24(CH),3.54(CH),4.50(NH,11.04(COOH)。
Ⅱ:IR, σ/cm-1:3236、3052(b)、1746、2981、649分别对应于NH、OH、CO、CH3、CCl;1H NMR, δ:1.10(CH3),2.20(CH),3.46(CH),4.50(NH,11.04(COOH)。
Ⅲ:IR, σ/cm-1:3216、3091(b)、1750、2966分别对应于NH、OH、CO、CH3;1H NMR, δ:1.07(CH3),2.18(CH),3.48(CH),4.27(NH),11.08(COOH)。
Ⅳ:IR, σ/cm-1:3212、3052(b)、1774、2986、692分别对应于NH、OH、CO、CH3、CCl;1H NMR, δ:1.24(CH3),3.50(CH),4.43(NH),11.11(COOH)。
Ⅴ:IR, σ/cm-1:3212、3081(b)、1774、2896、695分别对应于NH、OH、CO、CH3、CCl;1H NMR, δ:1.36(CH3),3.52(CH),4.50(NH),11.04(COOH)。
Ⅵ:IR, σ/cm-1:3210、3045(b)、1756、2880分别对应于NH、OH、CO、CH3;1H NMR, δ:1.38(CH3),3.80(CH),4.54(NH),11.14(COOH)。
Ⅶ:IR, σ/cm-1:3213、3083(b)、1714、2970分别对应于NH、OH、CO、CH3;1H NMR, δ:1.10(CH3),1.32(CH3),2.28(CH),3.66(CH),3.70(CH),4.51(NH),11.14(COOH)。
Ⅷ:IR, σ/cm-1:3201、3076(b)、1744、2973分别对应于NH、OH、CO、CH3;1H NMR, δ:1.13(CH3),1.33(CH3),2.31(CH),3.68(CH),3.73(CH),4.53(NH),11.12(COOH)。
Ⅸ:IR, σ/cm-1:3400、2950(b)、1710、1678分别对应于NH、OH、CO、CONH;1H NMR, δ:1.13(CH3),2.33 (phCH3),2.78(CH),4.58(CH),6.88~7.73(phH),6.53(NH),11.12(COOH)。
Ⅹ:IR, σ/cm-1:3401、2953(b)、1713、1679分别对应于NH、OH、CO、CONH;1H NMR, δ:1.41(CH3),2.35(phCH3),4.64(CH),6.88~7.73(phH),6.53(NH),11.12(COOH)。
硝基苯酚的3种同分异构体,均有很大的毒性,低浓度会引起慢性的中毒,高浓度会导致死亡[13,14],在CSP-1~CSP-10上对邻( o)、间( m)和对( p)硝基苯酚进行了分离,结果见表1。 CSP-5、CSP-9和CSP-10对硝基苯酚无分离能力,CSP-4上硝基苯酚未被洗脱下来,在CSP-2上只分离了邻和间硝基苯酚,在CSP-8上的分离结果最好,如图1所示。
| 表1 邻、间和对硝基苯酚在CSP-1~3、6~8上的分离结果 Table 1 Separations of the regioisomers of o-, m-, p-nitrophenol on CSP-1~3, 6~8 |
以体积比95:5的正己烷/异丙醇为流动相,在CSP-1~CSP-10上,对外消旋样品1~6进行了拆分,结果见表2。 随着固定相上取代基和取代基数目的不同,键合方式的不同,CSP-1~CSP-10对样品的分离能力表现出差异。 L-缬氨酸三嗪衍生物CSP的分离能力为CSP-2>CSP-1>CSP-3, L-丙氨酸三嗪衍生物CSP的分离能力为CSP-4>CSP-6>CSP-5, L-缬氨酸与 L-丙氨酸混合取代的三嗪衍生物CSP的分离能力为CSP-7>CSP-8,但从总的分离效果来看, L-丙氨酸三嗪衍生物CSP-4和CSP-6的分离效果更好一些;CSP-9和CSP-10的分离能力为CSP-10>CSP-9,由此可见,空间位阻稍小的丙氨酸制得的CSP表现出较好的识别能力。
| 表2 所制备CSP-1~CSP-10对手性化合物的拆分结果 Table 2 Separation of the racemates on CSP-1~CSP-10 |
为能更好地理解样品与固定相之间的相互作用,初步尝试利用化学软件Gaussian 09[15]分别计算了 L-丙氨酸三取代三嗪衍生物Ⅵ(衍生物Ⅵ)与外消旋样品1的 R或 S异构体的结合能( EL-R=52.51 kJ/mol; EL-S=133.9 kJ/mol)和构型(如图2所示)。 由图2可见,外消旋样品1的 R和 S异构体与衍生物Ⅵ的羧基之间有明显的氢键作用,且从结合位点可以看到, S构型与衍生物Ⅵ之间的相互作用强于 R构型与衍生物Ⅵ之间的相互作用,从计算出的 L-S的结合能大于 L-R的结合能也说明了形成的非对映配合物的稳定性不同, L-S稳定性大于 L-R,因而外消旋样品1在CSP-6上获得拆分。
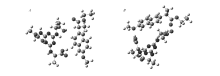 | 图2 衍生物Ⅵ与样品1的结合构型图Fig.2 The configuration diagrams based on derivative Ⅵ combining with R or S isomer of racemate 1 A.L-R association configuration; B.L-S association configuration |
因氢键作用是主要的手性识别作用力,所以当改变流动相中异丙醇的比例和结构时,样品在所合成CSPs上的的保留随醇含量的减小、随醇的碳链增长而增加,但分离因子和分离度均有不同程度的变化,图3给出了样品1在CSP-1、CSP-2、CSP-4~CSP-7、CSP-9和CSP-10上的色谱图。 但要获得更好的分离结果还需进一步探索CSP-1~CSP-10适用的流动相组成、正反相模式、温度等分离条件。
在制备的10种新型氨基酸衍生物“刷型”手性固定相(CSP-1~CSP-10)上,正相条件下,6种外消旋样品萘普生乙酯(1)、丙环唑(2)、苯醚甲环唑(3)、戊唑醇(4)、己唑醇(5)和联萘酚(6)分别获得了不同程度的拆分,(邻、间、对)硝基苯酚3种位置异构体也获得了较好的分离结果。 使用Gaussian 09软件计算出衍生物Ⅵ与外消旋样品1的 R或 S异构体的结合能和构型, L-S、 L-R结合能的差异,反映出样品的 R或 S异构体与CSP-6之间作用力的差异,若能结合大量的数据并配合样品出峰顺序的测试,将会有助于此类固定相的设计和手性识别机理的认识。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|