核酸适配体是指通过体外筛选技术从核酸文库中筛选出来,能够高特异性、高亲和力识别靶标物的寡核苷酸序列,具有靶标类型广泛、合成简单、相对分子质量小、化学稳定性高、易于进行生物化学修饰等优点。 核酸适配体能够通过折叠成特定的二维或三维构型与靶标物特异性结合,加上合适的信号转导机制,为重要靶标物的研究提供理想的分子识别与分子检测探针。 荧光检测技术具有高灵敏、高分辨率、易于实现多元分析等优点。 将核酸适配体的分子识别特性与荧光优异的光学检测性能相结合,在生命科学研究领域有着广泛的应用空间。 本文主要综述了核酸适配体荧光探针常见的分子设计和信号响应方式,及其在细胞成像、亚细胞成像中的应用研究,并对核酸适配体探针目前面临的一些挑战进行了讨论,最后对其未来的发展方向进行了展望。
Aptamers are oligonucleotides selected through an in vitro method known as systematic evolution of ligands by exponential enrichment(SELEX), which can recognize target with high specificity and high affinity. Aptamers have attracted wide attention because of their intrinsic advantages including simple synthesis, low molecular mass, high chemical stability, easy biochemical modification and so on. Aptamers can fold into specific two-dimensional or three-dimensional configurations and specifically bind with their targets. With appropriate signal transduction mechanism, aptamers can provide ideal molecular recognition and detection probes for biological research. Fluorescence is a type of detection technology that has several superiorities of high sensitivity, high resolution and easy multiplex detection. With the combination of the molecular recognition capability of aptamers and the outstanding detection performance of fluorescence technology, the aptamer-based fluorescence probes have been widely used in the study of life science. This review highlights the major progress of aptamer-based fluorescence probes in both bioanalysis and bioimaging area, and discusses the current limitations of aptamer probe for applications.
核酸是生命体最基本的组成物质之一,对遗传信息的编码、储存和传输起着关键作用[1]。 1953年,Watson 和Crick提出了DNA双螺旋结构,并预示了DNA依据碱基互补配对原则进行遗传复制[2]。 这一发现具有划时代的意义,使生命科学的研究进入了分子层面。 随后,核酸成为生命科学的核心研究对象[3,4],多种核酸分子工具被研发,并广泛应用于分子生物学、分子遗传学和临床医学等领域[5]。 其中,核酸荧光探针依据碱基互补配对原则,能特异性识别目标基因序列,并结合分子水平的信号传导机制,将相关的生物信息转变为荧光的功能核酸分子[6]。 与荧光蛋白探针[7,8]相比,核酸荧光探针无需对目标生物体系进行复杂的基因操纵,可以更直接、更真实地反映目标体系的生理状态。 然而,传统的核酸荧光探针仅适用于基因序列的特异性检测,在一定程度上限制了其应用空间。
核酸适配体(Aptamer,也译为核酸识体、核酸适体或适配子)是指从人工合成的DNA/RNA文库中筛选得到的、能够特异性识别靶标物的单链寡核苷酸分子[9]。 核酸适配体的靶标物类型广泛,包括离子、小分子、肽类、蛋白,甚至是整个活细胞、病毒、细菌或组织。 除了对目标物具有高特异性和高亲和力外,核酸适配体还具有合成简单、相对分子质量低、化学稳定性高、毒性低、免疫原性低、程序可控和便于修饰上多种功能基团或材料等优点[10]。 利用核酸适配体的分子识别特性,可设计多种针对不同类型靶标物的核酸适配体荧光探针,突破了传统的基于Watson-Crick碱基互补配对原则建立的核酸研究和应用的思路,极大地扩展了核酸探针在生命科学研究领域的应用范围。 本文主要讨论核酸适配体荧光探针近十几年来的发展及其在生化分析和生物成像领域的研究进展。
核酸适配体荧光探针由于具有设计灵活可控、合成简单、易于进行化学与生物功能化修饰等优点,在生化分析领域有着广阔的应用空间[11]。 本节就常见的核酸适配体荧光探针常见的信号响应机制做简单介绍。
分子信标是指两末端分别标记了荧光基团和猝灭基团的发夹型寡核苷酸探针,其茎部一般含5~8个互补核苷酸对,环部序列一般含15~30个核苷酸并与目标序列互补[12]。 当没有目标序列存在时,分子信标保持发夹结构,荧光基团和猝灭基团相互靠近 (约为7~10 nm)。 此时,荧光基团发出的荧光被猝灭基团吸收并以热的形式散发出去,导致荧光猝灭。 当与目标序列杂交后,环部序列变成刚性的双链结构,使得荧光基团和猝灭基团彼此分离,从而恢复了荧光基团正常的荧光发射(图1A)[13],而所检测到的荧光强度与溶液中目标序列的浓度在一定范围内成正比关系。 通过这种信号转导机制,使得在均相中即使不除去多余的信号探针也能保证较低的背景信号,这对生物体系的实时在线检测有着重要的意义。
基于经典的分子信标设计,Stanton等[14]设计了一种对凝血酶特异性响应的核酸适配体荧光探针。 他们通过延长凝血酶核酸适配体的一端,从而使其自杂交形成发夹结构。 当与凝血酶结合时,核酸适配体的分子构象发生改变,使得荧光基团与猝灭基团相互远离,从而产生荧光信号。 他们利用该探针实现了10 nmol/L的凝血酶检测下限(图1B)。
然而,并不是所有的核酸适配体都适用于经典分子信标的设计。 对于某些分子信标,如果采用发夹构型的设计,可能会产生结构上的限制,从而降低其对靶标物的亲和力。 为了解决这个问题,Take等[15]将可卡因核酸适配体探针设计成一个两侧分别带一个单链区域的短发夹结构,并在这个结构的两末端分别标记了一个荧光基团和一个猝灭基团(图2A)。 当可卡因不存在时,将观察到很强的荧光信号。 当与可卡因结合后,荧光基团与猝灭基团彼此靠近,导致荧光猝灭,从而实现了对可卡因的灵敏检测。 实验结果显示,1 nmol/L的可卡因可导致50%的荧光猝灭。 即使在人血清样品中,10 μmol/L低浓度的可卡因也可以被检测到。 同时, L-精氨酸的DNA适配体在溶液中构型比较随机,当与 L-精氨酸特异性结合时,核酸适配体将折叠成发夹结构,利用这一特性,可设计成非典型的分子信标,用于 L-精氨酸的荧光检测。
另外,Tan课题组[16]在血小板衍生生长因子(PDGF)核酸适配体的两末端分别标记了两个芘分子(图2B)。 在无目标分子PDGF的存在条件下,核酸适配体的两末端相隔比较远,芘分子在激发态下发射单体荧光( λ=400 nm);而当与目标分子结合后,核酸适配体两末端的芘分子彼此靠近,发射出了二聚体的绿色荧光( λ=480 nm)。 利用芘荧光发射波长的改变,可以实现目标分子的比率型检测,从而减少由于样品状况和体系波动对实验结果带来的干扰。 这种核酸适配体可以检测到浓度低于1 nmol/L的PDGF。 值得注意的是,相比于单体芘分子的荧光寿命(5 ns),芘二聚体的荧光寿命更长(40 ns)。 因此,利用荧光寿命分析可望进一步降低复杂体系中背景信号的干扰。
 | 图2 基于非经典的分子信标设计的核酸适配体荧光探针。 (A)通过在核酸适配体的两个末端分别标记上荧光基团和猝灭基团,构建用于可卡因检测的核酸适配体信标[15]。 (B)两个芘分子(Py)标记在PDGF核酸适配体的两末端。 在PDGF存在下,两个芘分子相互靠近,发出二聚体荧光[16]Fig.2 Aptamer beacons with nonclassical molecular beacon design. (A)An aptamer beacon for cocaine was constructed by labeling the two ends with a fluorophore and a quencher[15]. (B)Two pyrenes(Py) were labeled on the two ends of a PDGF aptamer[16] |
1.1节和1.2节中所提到的传感器均是基于完整的核酸适配体序列而设计的。 同时,设计核酸适配体分子信标还可以通过将核酸适配体拆分成两部分,Yamamoto等[17]将人类免疫缺陷病毒(HIV)的核酸适配体拆分成两部分(图3A),其中一部分设计成分子信标。 在靶标物(HIV)存在时,这两部分序列才能组装在一起,这就使得分子信标被打开,荧光基团与猝灭基团相互远离,从而使荧光信号得到增强。 他们利用这种设计,发展了基于“拆分型”的核酸适配体阵列检测技术。 实验结果表明,当目标蛋白反式转录激活因子(Tat)浓度为200 nmol/L 时,荧光强度增强了约14倍,从而实现了对Tat蛋白的灵敏、高通量检测。
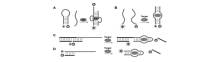 | 图3 “拆分”型的核酸适配体荧光探针。核酸适配体信标在检测HIV Tat蛋白(A),可卡因或ATP(B)中的“拆分”型设计。 基于核酸适配体C[19]和D[20]结构转换的性质设计不同的核酸适配体信标Fig.3 An aptamer beacon with the aptamer being split into two fragments for HIV Tat protein detection(A)[17] or for cocaine or ATP detection(B)[18]. Different designs of aptamer beacons based on the structure switching properties of aptamers(C)[19] and(D)[20] |
作为一种核酸分子,核酸适配体本身遵循着碱基互补配对原则,可以与其互补的核酸序列(简称cDNA)杂交。 因此,Li课题组[19,20,21,22,23,24,25]利用核酸适配体/cDNA与核酸适配体/靶标物之间结合竞争关系,提出了一种通用型的设计方案。 他们通过设计一种与核酸适配体部分序列互补的cDNA,并在核酸适配体与cDNA相互靠近的两末端分别标记上荧光基团和猝灭基团。 在目标分析物的存在情况下,核酸适配体将折叠成特定的构象与目标分子相结合,从而将cDNA从核酸适配体上竞争下来,由于荧光基团与猝灭基团的相互远离,实现了荧光的恢复(图3C和3D)。 利用此探针设计策略,他们实现了凝血酶和腺苷三磷酸(ATP)的检测,检测下限分别为10 nmol/L和10 μmol/L[19]。
除了使用有机猝灭基团之外,纳米材料如氧化石墨烯、纳米金等由于自身表面等离子效应对荧光有着优异的猝灭性能,被广泛用于核酸适配体纳米荧光探针的设计[26,27,28,29]。 Zhao等[12]利用金纳米颗粒作为荧光猝灭源,设计基于结构变化的核酸适配体荧光探针,实现了靶标蛋白的检测。 此外,Ellington等[30]在设计基于结构转变的核酸适配体时,将量子点(QDs)应用于构建传感器之中:他们通过将一个凝血酶的核酸适配体和QDs连在一起,并且将带有一个猝灭基团的cDNA和核酸适配体杂交,使得量子点的荧光被猝灭,当凝血酶与核酸适配体特异性结合后,带猝灭基团的cDNA被置换,从而使量子点的荧光信号得到增强,实现了凝血酶的灵敏检测。
对活细胞甚至是亚细胞结构进行荧光成像分析,为研究细胞的生理活动过程带来更全面、更深入的生物信息。 核酸适配体荧光探针由于其具有相对分子质量小、免疫原性低、生物相容性好、设计灵活可控等优点,在生物成像领域有着广泛的应用前景[31,32,33]。 随着以活细胞为筛选靶标的cell-SELEX技术的提出和快速发展,多种能够特异性识别靶细胞并具有特殊生物学功能的核酸适配体被筛选出来(图4)。 核酸适配体荧光探针为生物成像领域的发展提供了大量性能优异的分子研究工具[34,35]。
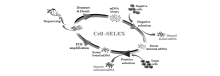 | 图4 基于cell-SELEX技术的核酸适配体筛选流程图[34]Fig.4 Cell-SELEX technology schematic diagram, aptamer enrichment of cell lines[34] |
将核酸适配体应用于细胞成像方面的研究也取得了一定的成果。 例如,Tan课题组[36]通过cell-SELEX技术筛选出了具备高亲和力,能够特异性识别胰腺导管癌的核酸适配体XQ-2d(见图5),该核酸适配体结合人类胰腺导管癌PL45细胞系的解离常数约为55 nmol/L,对于临床组织样本的检测识别比例达到82.5%,为胰腺导管癌的诊断与治疗提供了颇有潜力的分子识别成像探针。
 | 图5 核酸适配体XQ-2的优化与表征。 (A)通过与目标细胞PL45的结合能力来判断不同的序列裁剪情况对核酸适配体识别性能的影响。 (B)XQ-2d的二级结构。 (C)XQ-2d(250 nmol/L)与PL45细胞系的特异性结合。 (D)裁剪的XQ-2d与靶PL45细胞系的解离常数[36]Fig.5 Truncation of aptamer XQ-2 and characterization of XQ-2d. (A)Binding ability of different truncated versions by removing nucleotides at 5' and 3'-terminus on target PL45 cells. (B)Secondary structure of XQ-2d predicted by NUPACK. (C)Binding assay of XQ-2d to PL45 cells in the presence of XQ-2 or unselected library. (D)Dissociation constant of truncated XQ-2d for target PL45 cells[36] |
Yang课题组[37]筛选出能够特异性识别高表达上皮细胞粘附分子的肿瘤细胞的核酸适配体(图6),可用于肿瘤细胞成像和循环肿瘤细胞捕获,此外,他们还对筛选得到的核酸适配体进行序列优化,经过优化的核酸适配体SYL3C对乳腺癌细胞MDA-MB-231细胞系和胃癌细胞Kato III细胞系识别解离常数分别为(38±9) nmol/L和(67±8) nmol/L。其富集肿瘤细胞的效率达到63%,捕获后细胞的纯度为80%,可用于血液中肿瘤细胞的检测。
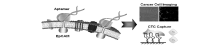 | 图6 DNA核酸适配体与EpCAM蛋白质的特异性结合[37]Fig.6 The schematic diagram of DNA aptamer and EpCAM protein selective recombination binding[37] |
Shangguan课题组[38]通过cell-SELEX技术筛选出能够识别F肌动蛋白组成的细胞隧道纳米管(图7)。 他们通过抗阿霉素的乳腺癌细胞系MCF-7R细胞作为正筛,其正常的MCF-7作为负筛,与以往报道筛选到识别细胞表面膜蛋白的核酸适配体不同,该小组成功筛选到能够特异性识别细胞间连接体的核酸适配体M17A2。 该核酸适配体不仅能够识别MCF-7R细胞间连接体,还能够识别MCF-7R与其它细胞系之间的连接体。 他们发现MCF-7R细胞的抗药性相关蛋白通过细胞间连接传递到非抗药性MCF-7细胞。 该核酸适配体荧光探针为更好地研究细胞间连接所介导的细胞通讯作用机制提供了优异的分子工具。
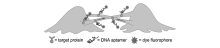 | 图7 由cell-SELEX技术产生的核酸适配体探针可以特异性识别细胞之间的连接体[38]Fig.7 Intercellular connections that are specifically recognized by aptameric probe generated by cell-SELEX[38] |
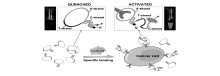
除此之外,Shi等[39]设计了一个可活化的核酸适配体探针-AAP,用于活体内肿瘤细胞的检测。 该探针处于静止状态时,所带荧光基团被猝灭,而当结合到靶标肿瘤细胞时,其DNA构象发生改变,荧光基团被释放了出来,从而恢复荧光发射,进而有效地提高了肿瘤细胞检测的灵敏度(图8),在200 μL的样品体积中实现了118个肿瘤细胞的检测下限。 该探针可成功用于活体成像,有效地减少了非靶标组织部位的背景信号,诊断时间缩短至15 min,提高了诊断效率。
随着生命科学的不断发展, 人们对生命运行规律的研究逐渐从细胞层面过渡到亚细胞层面。 传统的荧光探针缺乏亚细胞定位能力,导致探针有效利用率低及背景信号高,难以满足人们监测微观层次的动态分子过程的需要。 而核酸作为一种可编程化的分子识别工具,具有易于结合不同信号响应模式的优点,在亚细胞的原位动态成像分析中具有广阔的应用前景。 同时,通过cell-SELEX技术筛选出来能够特异性识别靶细胞并具有细胞内在化功能的核酸适配体可望用于亚细胞定位成像分析。 本文将分别从细胞膜、细胞质和细胞核等不同亚细胞层面讨论核酸适配体荧光探针的成像分析应用。
2.2.1 细胞膜成像 细胞外周微环境是指紧密围绕在细胞周围,通过各种物理、化学或生物信号对细胞行为有着直接或间接影响的局部动态环境,其在调控细胞生物学功能(包括细胞代谢、繁殖、分化、凋亡及细胞间通讯等)中起着至关重要的作用[40,41]。 实时监测细胞外微环境中的重要信息物质、获取相关的生化信息,对于细胞的生理活动机制有着重要的指导意义[42,43]。 虽然传统的分析检测技术(如质谱法、酶联免疫吸附法、荧光光谱法、原子吸收光谱法等)能够灵敏、准确地检测待分析物,但它们均是针对宏观介质体系的,并要求对样品进行繁琐的预处理(比如分离、纯化和浓缩等),使得它们无法用于微观环境中重要生物分子的动态监测[44,45]。
基于细胞膜表面的生物传感是指将检测探针构建在细胞膜表面,使得传感探针直接针对细胞外周微环境,可望用于实时监测该微观环境中重要生理活动[46]。 Zhao等[42]设计了一种对血小板源生长因子(PDGF)特异性响应的核酸适配体荧光探针,并通过共价交联反应将该探针固定在间充质干细胞的膜表面。 只有当结合到PDGF时,核酸适配体发生构象改变,引起荧光基团的相互靠近,进而由于荧光能量共振转移(FRET)产生荧光信号(图9)。 实验结果证明,该细胞膜表面的核酸适配体荧光探针实现了对外加的或相邻细胞分泌的PDGF高时空分辨的定量检测。 不仅如此,探针功能化的干细胞保留其迁移到骨髓的能力,他们通过体内显微镜技术,在单细胞水平上对细胞迁移行为进行了实时监测,为生物学家在活体上研究细胞生物学提供了新思路。
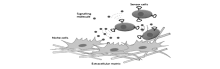 | 图9 基于细胞膜表面的核酸适配体传感探针用于探索细胞外微环境与细胞信号传递过程[42]Fig.9 Probing the cellular niche environment and signalling using cells engineered with an aptamer sensor[42]Aptamer sensors that bind to signalling molecules are covalently attached to the surface of cells. Signalling molecules secreted by niche cells are detected by the sensor cells, and the fluorescent signal generated is measured |
此外,Tokunaga等[47]通过共价键作用将ATP特异性响应的核酸适配体荧光探针固定在星形胶质细胞膜表面上,实现了对神经细胞分泌神经递质ATP的动力学过程进行实时检测。 虽然实验效果很好,但是这些检测探针在细胞膜表面的固定过程均涉及到共价化学反应,所用到的反应试剂可能会影响细胞本身的生理状态,在一定程度上限制了它们的有效性和实际应用范围。 为了解决这个问题,Qiu等[48]设计合成了脂质链-DNA共轭物,并证明了该共轭物可以通过脂质链与细胞磷脂双层之间的疏水作用,自发高效地组装到细胞膜表面上(图10)。 除了出色的组装效率外,该细胞膜定位组装方法还具有生物兼容性好、操作简便及适用于任何类型的细胞等优点,为修饰细胞膜提供了理想策略。 而且他们还通过此策略在细胞膜表面修饰了对镁离子特异性响应的脱氧核酶荧光探针,实现了对细胞分泌镁离子的生理过程进行实时检测。 此外,You等[48]利用疏水作用将DNA步行器锚定到细胞膜表面,并利用DNA链置换反应来捕获、记录步行器之间的高速碰撞。 每一次碰撞都能产生并累积一个荧光信号,最终将瞬时膜相遇事件转化为可读的累积荧光信号,为研究活细胞膜上的分子间相互作用提供了一种强有力的分子工具,这对推进重大疾病的早期检测极具意义。
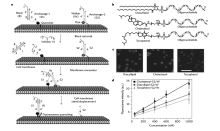 | 图10 DNA探针在活细胞膜上锚定和操作方案。 (a)活细胞膜上的DNA探针操作的示意图。(b)双脂酰脂、胆固醇、维生素E共轭的寡核苷酸的化学结构。(c)羧基四甲基罗丹明标记的双脂酰脂、胆固醇、维生素E共轭的S2/W共聚焦荧光显微镜图。(d)Ramos细胞膜上DNA探针锚定效率的细胞流式评估图[48]Fig.10 Anchoring and operation scheme of DNA probe on live cell membrane. (a)Schematic illustration of DNA probe operation on a live cell membrane. (b)Chemical structures of diacyllipid-, cholesterol- and tocopherol-conjugated oligonucleotides for membrane lipid domain studies. (c)Confocal fluorescence microscopy images of carboxytetramethylrhodamine-labelled diacyllipid-, cholesterol- and tocopherol-conjugated S2/W conjugates. (d)Flow cytometry evaluation of the anchoring efficiency of DNA probe on Ramos cell membranes[48] |
2.2.2 细胞质成像 细胞质是细胞进行生命活动的主要场所,为生命活动的正常进行提供能量原料。 研究细胞质中重要生物组分的动态分布将为细胞分子生物学的研究提供重要信息[49]。 虽然核酸荧光探针是一种性能优异的分子检测工具,但核酸作为一种带负电荷的亲水性生物大分子,难以跨越同样带负电荷的细胞膜,这很大程度上限制了其在细胞内成像中的应用[50,51]。 为了解决核酸探针活细胞穿透力差的难题,许多科研人员做出了大量的工作并取得了一定的进展。 例如,Qiu等[52]将癌细胞靶向、可细胞内在化的核酸适配体作为输送载体,并结合生物靶标特异性响应的分子信标及核酸杂交技术,开发了一种细胞靶向输送的荧光探针,成功地将分子信标高效地输送到指定细胞的细胞质中。 此外,他们在核酸载体探针修饰上光切割连接体,利用对分子信标检测行为的光调控,进而实现了对细胞质中靶标mRNA的荧光成像分析(图11)。
 | 图11 载体探针(CP)/分子信标(MB)探针检测活细胞体系中锰超氧化物歧化酶(MnSOD)mRNA的示意图[52]Fig.11 Schematic illustration of the CP/MB probe for spatiotemporal MnSOD mRNA detection in living cells[52] |
除此之外,Wang等[53]利用氧化石墨烯(GO)作为核酸适配体的输送载体及荧光猝灭剂,报道了一种细胞内ATP的成像方法。在起始状态下,6-羧基荧光素(FAM)标记的核酸适配体因吸附于氧化石墨烯(GO)表面,导致荧光信号被猝灭。而在GO的辅助下进入到细胞以后,核酸适配体与细胞内的ATP特异性结合,形成更为刚性的3D结构,进而从GO上脱离下来,使得荧光信号恢复(图12)。
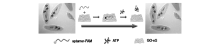 | 图12 利用核酸适配体/氧化石墨烯纳米片(GO-nS)原位分子探测活细胞的示意图[53]Fig.12 Schematic illustration of in situ molecular probing in living cells by using aptamer/GO-nS nanocomplex[53] |
为了进一步提高活细胞靶标物检测的灵敏度,Wu等[54]基于核酸级联置换反应报道了一种mRNA的信号放大成像方法。 在这种核酸级联反应中,一个靶标mRNA分子可以诱导多重的信号输出,实现了细胞内对低浓度靶标的灵敏检测,为提高肿瘤早期诊断的准确性提供了新方法(图13)。
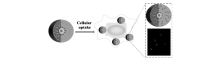 | 图13 核酸级联反应使mRNA信号放大的原理图[54]Fig.13 The principle diagram of signal amplification of mRNA by nucleic acid cascade reaction[54] |
2.2.3 细胞核成像 细胞核是最重要的亚细胞结构,在亚细胞成像中占据重要的地位。 Tan等[55]通过cell-SELEX 技术筛选得到针对过表达人表皮生长因子受体III型突变体的人脑胶质瘤细胞(U87-EGFRvIII细胞)的核酸适配体,其中一条序列(32)与靶细胞共孵育时能定位于细胞核,经“pull-down”实验表明,该核酸适配体能识别EGFRvIII蛋白。 实验者推测,可能是由于核酸适配体结合在EGFRvIII蛋白上,由于该蛋白介导的内吞作用而进入细胞, 为细胞核靶向输送提供了颇有前景的分子工具。 目前,该核酸适配体的入核机制尚在研究中。
另一方面,为了克服由 p-糖蛋白在细胞膜表面的高表达并主动将小分子药物泵出而引起的癌细胞多药耐药性问题[56],Qiu等[57]瞄准了细胞核在细胞命运中的关键地位,利用DNA杂交技术实现了小尺寸的载药纳米金颗粒在金-银纳米棒侧面的自组装,同时在纳米棒的两端面修饰上可细胞特异性内在化的核酸适配体。 利用纳米棒吸收近红外光后能迅速产热的特性,使得小颗粒纳米药物从纳米棒载体上解离下来。 研究表明,小颗粒的纳米药物能够有效地聚集在细胞核内,从而实现对耐药性癌细胞的有效治疗(图14)。
核酸适配体作为一种“化学家的抗体”,除了具有与蛋白抗体相当的特异性和亲和力外,还具有靶标范围广泛,相对分子质量低、化学稳定性高、毒性低及免疫原性低等优点;此外,作为核酸分子,核酸适配体具有合成简单、设计灵活可控、易于修饰上多种功能基团或纳米材料、便于引入核酸信号放大手段等特征。 核酸适配体荧光探针结合了核酸适配体的分子识别特性和荧光探针优异的光学检测性能,在生化分析和生物成像领域有着广阔的应用前景。
尽管核酸适配体荧光探针具有上述优点,但其应用研究仍处于初级阶段,还有许多问题亟待解决[9]。 主要有以下几点:1)核酸适配体的生物稳定性较差,容易被生物体系中大量存在的核酸酶降解;2)容易受到复杂生物体系的影响,产生假阳性信号;3)核酸适配体荧光探针与靶标物一对一的信号响应模式,在一定程度上限制了检测的灵敏度;4)核酸适配体的筛选方法比较繁琐耗时,目前被筛选出来的核酸适配体数量仍非常有限,一定程度上限制了核酸适配体的发展[16]。 目前,对核酸适配体荧光探针的分析应用大部分停留于方法学研究阶段,且分析对象主要集中于凝血酶等少数几个种靶标物,实际应用远不及抗体普及。 如何克服上述的这些局限性,进一步拓展核酸适配体荧光探针在生命科学领域中的应用,仍需要科研工作者的不断的努力。
未来核酸适配体荧光探针在生化分析和生物成像中的应用主要是针对于生物标志物的分析及肿瘤成像的分析,以便用于癌症早期诊断,提高肿瘤的治愈效率。 另外,还可将核酸适配体核酸荧光探针应用于药物分析、农药残留、环境化学、食品毒理学、考古分析和法医刑侦等方面,为国民经济的发展及民众的健康幸福创造好的条件。 但我们也应该看到,目前核酸适配体荧光探针在生物医药及生物分析的应用刚刚起步,是一门新兴学科和交叉领域,我国的科研人员应及时抓住机遇,突破关键技术,系统地开展利用核酸适配体荧光探针进行疾病诊断和治疗的研究,发展具有原始创新和临床应用价值的疾病诊疗新方法和新技术,大力推动核酸适配体荧光探针走向实际应用,真正造福人类社会。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|