综述了金属-有机框架应用于锂离子电池的研究进展。 金属-有机框架在锂离子电池中的应用主要有以下两个方面:1)用作锂电负极材料;2)用作锂电正极材料。 同时总结了金属-有机框架做锂电电极材料存在的问题,并提出解决的可能途径。 最后,展望了金属-有机框架在储能领域中的应用前景。
Metal-Organic frameworks(MOFs) have been applied in rechargeable lithium ion batteries due to their high surface areas and tunable structures. We reviewed the recent progresses on MOFs as negative and positive electrodes for Li-ion battery. The state-of-the-art results and problems to be faced are also summarized. The perspective of using metal-organic frameworks is prospected for the future material innovation in electrochemical energy storage.
当今社会,环境污染和能源短缺已成为威胁人类生存的两大挑战,因此开发清洁可再生能源替代传统能源迫在眉睫。 利用风能或太阳能发电,并将电能储存在二次电池或超级电容器中,是一种开发可再生能源的重要方式[1]。 然而当前的二次电池和超级电容器均存在电化学性能缺陷。 以二次电池中的锂离子电池为例,其存在能量密度低、倍率性能差、循环寿命短、低温下性能下降和安全性等问题,无法满足日益增长的应用需求[2]。 开发新的电极材料,用以提高锂离子电池的电化学性能,达到现代科技如电动汽车等对电池的能量和功率密度需求,是电能储存领域中面临的一项重要挑战[3]。
金属-有机框架(Metal-Organic Frameworks,MOFs)是由金属离子与有机配体通过配位键连接形成的具有孔结构和网络结构的配位化合物[4]。 金属-有机框架作为一类高比表面积、结构可控的微孔材料,已经在气体吸附与分离、催化、发光和电化学等方面得到了广泛的研究[5,6]。 金属-有机框架中的金属离子或金属簇的氧化还原行为,以及有机配体具备储存和转移电荷的能力,使得金属-有机框架在能量储存和转换领域具备重要的潜在应用价值[7,8]。 目前,金属-有机框架在锂离子电池领域应用主要体现在:1)用作锂电负极材料;2)用作锂电正极材料。 本文主要从这两个方面综述了金属-有机框架应用于锂离子电池的研究现状,并简要介绍金属-有机框架衍生材料在锂离子电池中的应用。
石墨作为锂离子电池的常用负极材料,其理论比容量为372 mA·h/g[9]。 近年来,新兴的负极材料如硅、金属氧化物等得到快速发展,其实验比容量已远超石墨。 理想的锂电负极材料要求:1)在锂离子的嵌入反应中自由能变化小、电位低;2)锂离子在负极的固态结构中有高扩散率;3)锂离子高度可逆的嵌入和脱出;4)良好的电导率;5)结构稳定,与电解液不发生反应[10]。 金属-有机框架的金属中心和有机配体都具有电荷负载能力,利于提高比容量;其固有的孔结构利于锂离子在充放电过程中快速脱嵌。 因此,MOFs用于锂电负极材料具有重要的研究价值。
陈军等[11]首次报道了用金属-有机框架MOF-177[Zn4O(1,3,5-benzenetribenzoate)2]作为锂电负极材料的研究。 MOF-177首周放电容量可达到400 mA·h/g。 由于MOF-177在充放电过程中结构坍塌,导致第二周容量急剧衰减至105 mA·h/g。 该工作对探索金属-有机框架用作锂电负极材料具有重要意义。 随后,金属-有机框架如Zn3(HCOO)6、Co3(HCOO)6、Zn1.5Co1.5(HCOO)6[12]、[Mn(tfbdc)(4,4'-bpy)(H2O)2](H2tfbdc=2,3,5,6-tetrafluoroterephthalatic acid, 4,4'-bpy=4,4'-bipyridine)[13]、Co3[Co(CN)6]2[14]、Co2(OH)2BDC(BDC=1,4-benzenedicarboxylate)[15]、Ni-Me4bpz(H2Me4bpz=3,3',5,5'-tetramethyl-4,4'-bipyrazole)[16]、Zn(IM)1.5(abIM)0.5(abIM=2-aminobenzimidazole)[17]、Co1.5L(H2O)4(H3L=4-hydroxypyridine-2,6-dicarboxylic acid)[18]和MIL-101(Cr3F(H2O)2O(bdc)3,MIL代表Material of Institute Lavoisier)[19]等也被用于锂电负极材料的研究中(表1)。
| 表1 金属-有机框架用作锂电负极材料 Table 1 MOFs for LIBs anodes |
2010年,Vittal等[12]报道了3例甲酸盐MOFs——Zn3(HCOO)6、Co3(HCOO)6和Zn1.5Co1.5(HCOO)6作为锂电负极材料的电化学性能。 Zn3(HCOO)6首次充放电循环后表现出很大的不可逆容量衰减,但具有很高的循环稳定性。 基于实验结果,他们提出了以下的脱嵌锂机理(式(1)和式(2)):
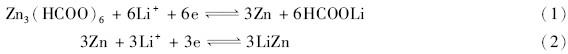
在首次充放电循环过程中,MOFs材料首先和Li+反应形成金属锌纳米颗粒和甲酸锂,放电过程形成LiZn合金。 在充电过程中,合金再转化为金属锌纳米粒子,随后变成甲酸MOFs,实现了可逆地充放电循环过程。 在60 mA/g的电流下循环60次后,可逆比容量仍然可达560 mA·h/g。 而Co3(HCOO)6与Zn3(HCOO)6相比,由于钴与锂不能形成合金,上述机理中的第二步不适用于Co3(HCOO)6,无法实现可逆充放电。 在60 mA/g的电流下循环60次后,其容量仅380 mA·h/g。
2013年,刘奇等[13]合成了Mn-LCP并研究了其电化学性质。 在充放电过程中Mn-LCP与Li+通过以下机制可逆反应:

在50 mA/g,0.01~2.5 V测试条件下充放电循环50周后,比容量仍保持390 mA·h/g。 2014年,王康等[15]通过水热法合成的Co2(OH)2BDC具有优异的电化学性能。 在50 mA/g电流下100周循环后比容量仍可达到650 mA·h/g。
2015年,陈亮等[17]合成了双功能化的BMOF(Zn(IM)1.5(abIM)0.5),具有高的热稳定性和化学稳定性。 在充放电过程中,MOFs的框架结构和配位环境均保持稳定,Li+在MOFs孔道中可逆地脱嵌,进而实现了稳定的电化学性质。 在100 mA/g电流200周充放电循环后,比容量保持190 mA·h/g;在400 mA/g电流测试条件下循环200次后可逆容量近80 mA·h/g(图1)。 该材料以嵌入的方式储锂,并通过密度泛函理论(DFT)计算和X射线衍射(XRD)表征佐证。
 | 图1 BMOF的结构图(a); BMOF在不同电流密度下的循环性能和库伦效率图(b)[17]Fig.1 The structure of the BMOF(a). The cycling performance and coulombic efficiency of the electrodes made with the BMOF(b). The discharge process was carried out at various current densities of 100, 200 and 400 mA/g[17] |
MOFs的充放电过程机理可通过多种表征技术来进行研究。 2016年,我们课题组[18]以4-羟基吡啶-2,6-二羧酸(H3L)为配体,合成了一维链结构的[Co1.5L(H2O)4] n,并研究了其作为锂电负极材料的性质。 通过对其进行系统的电化学测试表明,金属和配体的氧化还原活性位点对容量均有贡献。 在50 mA/g,0.01~2.0 V测试条件下循环50次后,可逆比容量431 mA·h/g,库伦效率保持98.3%。 通过X射线光电子能谱(XPS)、顺磁共振(EPR)和循环伏安法(CV)研究了[Co1.5L(H2O)4] n的充放电过程,钴离子和配体均参与了氧化还原反应,这与电化学性能测试结果相符(图2)。
 | 图2 [Co1.5L(H2O)4] n的一维链结构图(a);[Co1.5L(H2O)4] n的磁性表征(b);充放电过程中MOFs的氧化还原机理示意图(c)[18]Fig.2 The structure of [Co1.5L(H2O)4] n(a). The magnetic result of [Co1.5L(H2O)4] n(b). Electrochemical redox reaction mechanism(c)[18] |
金属-有机框架用作锂电负极材料的研究仍然面临很多挑战,如如何解决导电性差、大的不可逆容量损失和循环寿命短等问题。 导电性差是制约MOFs材料应用于锂电池的主要原因之一。 为了改善MOFs的导电性,对MOFs掺杂导电剂是有效的方法之一[28]。 由于石墨烯的大Π键会导致高度电子离域,是很好的导电材料[29]。 我们尝试了在MIL-101中引入GO(GO=氧化石墨烯)来改善其导电性 。MIL-101(Cr)/GO 的首周放电容量约是MIL-101(Cr)放电容量的两倍[19]。 在MIL-101/GO复合材料中, MIL-101(Cr) 粒径大小约为1 μm,均匀的分布在氧化石墨烯的表面。 通过掺入GO,MIL-101(Cr) 的电化学性能有了较大提升。
文献报道的金属-有机框架的储锂机理可主要分为两类: 1)转换机制:中心金属离子被锂离子替代,形成金属单质; 2)嵌入机制:金属-有机框架结构保持稳定,锂离子在孔道中脱嵌。 无论哪种机制,在MOFs材料中若能实现锂离子可逆地快速转移,具有较多的储锂活性位点,便可能表现出优异的电化学性能。 因此,在选择MOFs做负极材料时,应考虑以下几点: 1)选择易变价的金属中心和带有活性官能团(如羧基、氨基)的有机配体,实现锂离子可逆地嵌入和脱出; 2)选择相对分子质量较小的有机配体,提高理论储锂容量; 3)选择刚性稳定且具有孔道的MOFs,利于锂离子的快速传输。
锂离子电池常用的正极材料有具有层状结构的LiCoO2、具有尖晶石结构的LiFePO4等[30,31]。 其中,LiCoO2已成为商业化正极材料,放电电压为3.6 V,理论容量为270 mA·h/g,综合性能较为优异,但高成本和Co的毒性制约了其进一步的应用。 理想的锂电正极材料应具备以下特点: 1)锂离子的嵌入和脱嵌是可逆的,且主体结构在充放电过程中保持稳定或发生很小程度的改变; 2)具有较高的电导率,可以进行大电流的充放电测试; 3)具有良好的电化学动力学特性; 4)原料来源广泛、成本低、安全、环保[32]。
金属-有机框架在锂电正极材料中的研究已有报道,如MIL-53(Fe)[33]、MIL-68(Fe)[34]、MIL-136(Ni)[35]、K2.5(VO)2(HPO4)2(C2O4)[36]、Cu(2,7-AQDC) (2,7-H2AQDC=2,7-anthraquinonedicarboxylic acid)[37]、MOF-74(Ni)[38]、MIL-101(Fe)[39]和Cu-TCA(H3TCA=tricarboxytriphenyl amine)[40]等。
2007年,Férey[33]等研究了FeⅢ(OH)0.8F0.2(bdc)·H2O(MIL-53(Fe))作为锂电正极材料,电压窗口范围为1.5~3.5 V。 Li xFeⅢ(OH)0.8F0.2(bdc)·H2O在放电过程中(即锂离子嵌入到正极材料) x最大值为0.6;更大的 x值会使放电过程不可逆。 x=0.6时,在50 mA/g,1.5~3.5 V测试条件下循环50次后,质量比容量为75 mA·h/g,体积容量140 mA·h/L。
2014年,Awaga等[37]对Cu(2,7-AQDC)用作锂离子电池正极材料进行了研究,电压窗口范围为1.7~4.0 V。 值得注意的是,金属簇和配体同时发生了氧化还原反应。 在100 mA/g电流下首次放电容量达到了147 mA·h/g,50周充放电循环后比容量约为105 mA·h/g(图3)。
 | 图3 Cu(2,7-AQDC)的结构图(a);充放电曲线与循环容量曲线(b)[37]Fig.3 Thermal ellipsoid plot of a single layer of the framework(a). Charge-discharge profile of Cu(2,7-AQDC)(b)[37] |
2015年,Shin等[39]报道了MIL-101(Fe)作为正极材料的电化学性质。 其比容量达到了108 mA·h/g,电压窗口范围为2.0~3.5 V,由于电极反应的不可逆性,随着循环次数的增加容量快速衰减,MIL-101(Fe)的保留比容量很低。研究发现,在锂离子嵌入和脱出过程中,MIL-101(Fe)的框架结构中Fe3+离子发生氧化还原反应,通过X射线吸收光谱(XAS)得到证实(图4)。
 | 图4 MIL-101(Fe)的结构图(a);MIL-101(Fe)的原位和非原位X射线吸收光谱(XAS)(b)[39]Fig.4 The structure of MIL-101(Fe)(a). In operando and ex situ XANES of MIL-101(Fe)(b)[39] |
相对于负极材料,金属-有机框架用做正极材料的难度更大,电压、储锂容量和循环稳定性是需要解决的难题[32]。 基于研究现状,适合做锂电正极材料的MOFs通常具备以下特征:1)有机配体的分子量较小;2)氧化还原中心可转移多个电子或离子;3)孔结构密度较大,储锂活性位点多;4)具有刚性结构,在充放电过程中保持结构稳定。
近年来,除了以MOFs直接作为锂离子电池电极材料的研究之外,以MOFs为模板或前驱体制备纳米金属氧化物,多孔纳米碳材料,纳米硫化物以及其他复合材料如复合石墨烯等并用于储能的研究也受到了广泛的关注[7,41]。 通过MOF途径制备纳米储能材料具有反应条件相对温和、反应体系化学可调性高、反应产物组成和形貌均一等特点[8],已有大量MOF衍生纳米材料应用至锂离子电池电极材料[42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57]。
2016年,我们课题组[53]基于MOFs的吸附性质将SnCl2吸附到HKUST-1孔道中,再经过煅烧等处理得到纳米SnO2@C复合材料,并将其用于锂离子电池负极材料的研究。 SnO2@C在0.01~3 V电压范围,100 mA/g的电流密度下循环50周后可逆比容量为900 mA·h/g,循环200周后可逆比容量为880 mA·h/g,且具有优异的倍率性能(图5)。
 | 图5 SnO2@C合成示意图(a);恒电流充放电曲线(b);不同的SnO2@C的循环性质图(c);SnO2@C倍率性能图(d)[53]Fig.5 The illustration of the preparation of SnO2@C(a). Discharge/charge curves of SnO2@C at 100 mA/g(b). Cycling performance of SnO2@C at 100 mA/g(c). Rate performance of SnO2@C electrode at different current densities from 100 mA/g to 1000 mA/g(d)[53] |
同年,我们课题组[9]以MOF-74-Ni为前驱体制备了NiP2@C纳米材料。 基于该材料的多孔结构,单分散的NiP2纳米粒子,具有导电活性的多孔碳以及强的磷碳界面偶合作用,该材料显示了优异的储锂性能和稳定性。 NiP2@C作为锂电负极材料,在0.01~2.5 V电压范围,倍率性能优异。 在1 A/g电流密度下可逆比容量仍可达到420 mA·h/g,循环700周后容量为360 mA·h/g(图6)。
 | 图6 NiP2@C纳米材料合成示意图(a);NiP2@C负极的电化学性能图(b)[9]Fig.6 Schematic illustration of the synthesis procedure of nanostructured NiP2@C(a). Electrochemical performance of the NiP2@C electrode(b)[9] |
最近,王博等[32]已在Coordination Chemistry Reviews发表了题为“Metal-Organic Frameworks for Energy Storage:Batteries and supercapacitors”的综述,庞欢等[58]在Advanced Energy Materials发表了关于“Transition-Metal(Fe,Co,Ni) Based Metal-Organic Frameworks for Electrochemical Energy Storage”的综述,可供对MOF衍生物在锂离子电池方面的应用感兴趣的读者参考。
金属-有机框架及其衍生物具有组成和结构多样的特性,在锂离子电池的应用中表现出优异的电化学性质。 但现阶段的性能仍无法满足商业需求(循环寿命达到10000次以上,库伦效率接近100%),其中,稳定性和导电性的问题是阻碍其性能提高的主要因素。 因此,在开发MOFs型电极材料的研究中要考虑以下几点:
1)通过复合导电材料解决MOFs导电性差问题,导电材料可为碳纳米管,氧化石墨烯,还原氧化石墨烯等。
2)有效利用MOFs的孔性质和高比表面积。 通过MOFs的构筑单元改变MOFs的孔结构,提高其孔结构利用率。
开发利用风能或太阳能等可再生资源,有助于缓解人类面临的温室效应和资源匮乏危机。 锂离子电池作为一种重要的储能方式,其当前的电化学性能已无法满足未来应用的需求,因此开发新材料用作电极材料以提高其性能势在必行。 金属-有机框架作为一类分子微孔材料,具备合成条件温和,结构多样化,比表面积高,和电化学性能可调控等优势,已在锂电电极材料的研究中展现了巨大的潜力。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|



