以4-哌啶酮为原料,经过胺基保护、缩合、环合、脱保护等步骤,设计合成了一系列新型的5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶类化合物。 通过核磁共振波谱仪(1H NMR、13C NMR)、质谱(MS)和元素分析确证了其结构。 对其体外活性研究发现,该类化合物对乳腺癌细胞MCF-7具有一定的抑制活性,其中化合物5a的抑制活性最为显著,半数抑制浓度(IC50)值达到了8.6 μmol/L。 为此类化合物的抗肿瘤活性研究提供了参考。
A series of novel 5,6,7,8-tetrahydroimidazo[2',1':2,3]thiazolo [5,4-c]piperidines was synthesized through sequential amino protection, condensation, cyclization, and deprotection reactions using piperidone as the raw material. The structures of these compounds were confirmed by proton or carbon nuclear magnetic resonance(1H NMR,13C NMR), mass spectrometry(MS) and elemental analysis. The antitumor activities of these compounds were evaluated in vitro, and the results indicated that these compounds had certain inhibitory activities against MCF-7 human breast cancer cells, and the inhibitory activity of compound 5a reached the level of strong potency with the half maximal inhibitory concentration(IC50) value of 8.6 μmol/L. It provides a reference for the antitumor activity of such compounds.
含氮杂环化合物由于具有广泛的生物活性而倍受重视,现已开发出许多含氮杂环类的杀菌剂、除草剂、杀虫剂及医用药物,此类化合物已成为农药和医药的研究热点,具有广阔的应用前景。 许多含哌啶和咪唑结构单元的杂环化合物具有不同的生物活性,其中由于哌啶是碱性基团,同时具有很好的水溶性,因此哌啶环常被引入许多药物分子,用于调节药物pH值和脂水分配系数,进而改善药物分子生物利用度并提高药效[1,2];具有五元杂环体系的咪唑同样在农药、医药、功能材料等领域受到广泛应用,其广泛存在天然产物中,多种衍生物已开发成为重要药物,用于抗菌、抗炎、抗肿瘤、治疗低血糖和生理紊乱等疾病[3]。 四氢噻吩并哌啶衍生物是很好的Hh信号通路抑制剂,对前列腺癌、胰腺癌、乳腺癌和一些血液癌症具有较强的抑制效果[4,5]。 新型咪唑并噻吩化合物具有抑制肿瘤细胞中Met受体酪氨酸激酶生长的作用[6,7,8,9],具有开发成为新型抗肿瘤靶向药物的潜质。
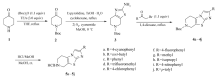
本文以4-哌啶酮为原料,先用叔丁氧羰基(Boc)酸酐进行胺基保护,再与单质硫和氰胺在对甲苯磺酸作用下成环得到化合物 N-Boc-2-氨基-噻唑并[5,4-c]哌啶(3),化合物3与不同的溴乙酰基化合物成环生成化合物4a~4j,最后脱保护得到化合物5a~5j。 合成路线见Scheme 1。 所得到的10个化合物结构经过1H NMR、13C NMR、MS、HRMS和元素分析进行确证,并对进一步进行了抗肿瘤活性测试。
Bruker AV400型核磁共振仪(瑞士Bruker公司);Waters Acquity型液相质谱联用仪(美国Waters公司);PE2400-Ⅱ型元素分析仪(美国Perkin-Elmer公司);WK-1B型数字熔点仪(上海精密科学仪器厂);BrukermicroToF II型高分辨质谱仪(德国Bruker公司)。
4-哌啶酮(分析纯,上海麦克林生化科技有限公司),三乙醇胺(分析纯,上海麦克林生化科技有限公司),二碳酸二叔丁酯(分析纯,上海麦克林生化科技有限公司),四氢呋喃(分析纯,山东富宇化工有限公司),其它试剂均为市售分析纯。
1.2.1 N-Boc-4-哌啶酮(2)的合成 参考文献[10,11],在1000 mL多口反应瓶中加入50 g(0.5 mol)4-哌啶酮和200 mL四氢呋喃(THF),在N2气保护条件下,缓慢加入150 g(1.0 mol)三乙醇胺和120 g(0.55 mol)二碳酸二叔丁酯,加完后于70 ℃回流反应12 h,薄层色谱(TLC)监控原料反应完全后,旋蒸除去溶剂THF,加入500 mL二氯甲烷,用稀盐酸调节体系的pH值7~8,再用饱和氯化钠溶液洗涤,有机相经干燥旋蒸得到 N-Boc-4-哌啶酮82 g,收率为82%。
1.2.2 N-Boc-2-氨基-噻唑并[5,4-c]哌啶(3)的合成 在装有分水器的反应瓶中,把50 g(0.25 mol) N-Boc-4-哌啶酮加入300 mL环己烷中,再加入20 g(0.275 mol)吡咯烷和0.5 g(2.63 mmol)一水合对甲基苯磺酸,升温回流并除水,反应5 h后冷却至室温,过滤反应液,蒸出滤液中的环己烷和吡咯烷,将所得到的蒸馏后的产物加入500 mL无水吡啶中,再加入16 g(0.5 mol)单质硫,反应温度设定为0 ℃,缓慢滴加50 mL溶有21 g(0.5 mol)氰胺的吡啶溶液,滴加完后缓慢升温至90 ℃,反应60 min后 TLC监控原料反应完全,冷却至室温,有大量固体析出,抽滤反应液,滤饼用200 mL×3的乙醚洗涤后烘干,得到淡黄色的产品 N-Boc-2-氨基-噻唑并[5,4-c]哌啶38 g,收率为59%。1H NMR(400 MHz,DMSO-d6), δ:6.83(s,2H),4.26(s,2H),3.56(t, J=5.2 Hz,2H),2.44~2.40(m,2H),1.40(s,9H);MS(ESI) m/z:256.3(M+H)+;HRMS(ESI)计算值C14H11O3[M-H]+:227.0702,实测值:227.07041。
1.2.3 化合物4a~4j的合成(以化合物4a为例) 在1000 mL多口反应瓶中,加入50 g(0.2 mol) N-Boc-2-氨基-噻唑并[5,4-c]哌啶、48 g(0.22 mol)对溴乙酰基苯乙腈和500 mL 1,4-二氧六环,N2气保护下,加热至回流,TLC监控原料反应完全,降至室温,缓慢加入一定量的碳酸氢钠溶液,调节反应液pH值7~8,再用800 mL乙酸乙酯萃取反应液3次,合并有机相,蒸除有机相溶剂后经硅胶柱层析分离提纯(洗脱剂: V(石油醚): V(乙酸乙酯)=5:1)得到60 g化合物4a。
N-Boc-2-(4-苯腈)-5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶(4a):浅黄色固体,收率80%,mp 120.1~122.5 ℃;1H NMR(400 MHz,CDCl3), δ:7.89(d, J=8.8 Hz,2H),7.66~7.64(m,2H),7.37(s,1H),4.54(s,2H),3.86(t, J=5.6 Hz,2H),2.79~2.76(m,2H),1.49(s,9H);MS(ESI) m/z:380.9(M+H)+。
N-Boc-2-叔丁基-5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶(4b):黄色固体,收率75%,mp 99.7~101.6 ℃;1H NMR(400 MHz,CDCl3), δ:7.02(s,1H),4.49(s,2H),3.81(t, J=5.2 Hz,2H),2.71(t, J=5.2 Hz,2H),1.48(s,9H), 1.33(s,9H);MS(ESI) m/z:335.8(M+H)+。
N-Boc-2-苯基-5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶(4c):浅黄色固体,收率72%,mp 123.1~124.3 ℃;1H NMR(400 MHz,CD3OD), δ:7.94(s,1H),7.79(d, J=7.6 Hz,2H),7.40(t, J=7.2 Hz,2H),7.30(t, J=7.2 Hz,1H),4.58(s,2H),3.87(t, J=6.0 Hz,2H),2.85~2.82(m,2H),1.54(s,9H);MS(ESI) m/z:356.2(M+H)+。
N-Boc-2-三氟甲基-5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶(4d):白色固体,收率20%,mp 119.2~121.6 ℃;1H NMR(400 MHz,CDCl3), δ:7.63(s,1H),4.56(s,2H),3.86(t, J=5.6 Hz,2H),2.79~2.78(m,2H),1.48(s,9H);MS(ESI) m/z:347.8(M+H)+。
N-Boc-2-(4-氯代苯)-5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶(4e):黄色固体,收率31%,mp 118.7~119.5 ℃;1H NMR(400 MHz,CDCl3), δ:7.74(d, J=8.4 Hz,2H),7.56(s,1H),7.35(d, J=8.4 Hz,2H),4.54~4.51(m,2H),3.87~3.85(m,2H),2.78~2.75(m,2H),1.49(s,9 H);MS(ESI) m/z:390.1(M+H)+。
N-Boc-2-(4-氟苯基)-5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶(4f):黄色固体,收率64%,mp 105.7~106.5 ℃;1H NMR(400 MHz,CDCl3), δ:7.68(d, J=8.4 Hz,2H),7.55(s,1H),7.39(d, J=8.4 Hz,2H),4.53~4.29(m,2H),3.89~3.85(m,2H),2.77~2.71(m,2H),1.47(s,9H);MS(ESI) m/z:386.2(M+H)+。
N-Boc-2-甲基-5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶(4g):白色固体,收率76%,mp 154.1~155.5 ℃;1H NMR(400 MHz,CDCl3), δ:7.79(s,1H),4.71(s,2H),3.69(t, J=5.6 Hz,2H),2.88~2.85(m,2H),2.36(s,3H),1.45(s,9 H);MS(ESI) m/z:294.4(M+H)+。
N-Boc-2-异丙基-5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶(4h):白色固体,收率73%,mp 146.3~147.5 ℃;1H NMR(400 MHz,CDCl3), δ:7.56(s,1H),4.93(s,2H),3.66(t, J=5.6 Hz,2H),3.17(d, J=8.0 Hz,1H),2.64~2.57(m,2H),1.65(s,9H), 1.38(s,6H);MS(ESI) m/z:322.5(M+H)+。
N-Boc-2-(4-硝基苯基)-5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶(4i):黄色固体,收率59%,mp 102.4~103.6 ℃;1H NMR(400 MHz,CDCl3), δ:7.97(d, J=8.4 Hz,2H),7.65(s,1H),7.48(d, J=8.4 Hz,2H),4.94~4.92(m,2H),3.76(d, J=8.4 Hz,2H),2.85~2.81(m,2H),1.43(s,9 H);MS(ESI) m/z:401.4(M+H)+。
N-Boc-2-(4-甲基苯基)-5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶(4j):白色固体,收率54%,mp 99.5~100.2 ℃;1H NMR(400 MHz,CDCl3), δ:7.76(d, J=8.4 Hz,2H),7.67(s,1H),7.39(d, J=8.4 Hz,2H),4.82~4.79(m,2H),3.65(d, J=8.4 Hz,2H),2.76~2.73(m,2H),2.17(s,3H), 1.43(s,9H);MS(ESI) m/z:370.5(M+H)+。
1.2.4 化合物5a~5j的合成(以化合物5a为例) 在反应瓶中,将化合物4a(32 g,0.085 mol)加入甲醇500 mL中,在0 ℃条件下,缓慢滴加含有4 mol/L盐酸的甲醇溶液100 mL,滴加完后升至室温反应2 h,TLC监控原料反应完全,蒸出一部分甲醇,冷却析晶,抽滤反应液得到晶体,滤饼烘干后得到27 g化合物5a。
4-(5,6,7,8-四氢咪唑并[2',1':2,3]噻唑并[5,4-c]吡啶-2-基)苄腈盐酸盐(5a):浅黄色固体,收率98%,mp 167.3~169.5 ℃;1H NMR(400 MHz,CD3OD), δ:10.26(s,1H),8.52(s,1H),8.00(d, J=8.4 Hz,2H),7.86(d, J=8.4 Hz,2H),4.52(s,2H),3.78(t, J=6.0 Hz,2H),3.29~3.26(m,2H);13C NMR(100 MHz,CD3OD), δ:165.2,153.1,139.4,138.6,131.8,127.9,122.2,107.1,101.5,59.8,56.3,47.3,42.1;MS(ESI) m/z:281.2(M+H)+;元素分析C15H13ClN4S实测值(计算值)/%:C 56.89(56.87),H 4.09(4.14),N 17.65(17.68);HRMS(ESI)计算值C15H12N4S [M+H]+:281.0783,实测值:281.0763。
2-(叔丁基)-5,6,7,8-四氢咪唑并[2',1':2,3]噻唑并[5,4-c]吡啶盐酸盐(5b):白色固体,收率98%,mp 201.3~202.6 ℃;1H NMR(400 MHz,CD3OD), δ:10.14(s,1H),8.12(s,1H),4.67(s,2H),3.88(t, J=6.0 Hz,2H),3.41(t, J=6.0 Hz,2H),1.58(s,9H);13C NMR(100 MHz,CD3OD), δ:159.2,131.4,126.5,122.3,101.8,59.1,51.5,42.3,28.1,23.6;MS(ESI) m/z:236.1(M+H)+;元素分析C12H18ClN3S实测值(计算值)/%:C 53.09(53.03),H 6.74(6.77),N 15.49 (15.46);HRMS(ESI)计算值C12H17N3S [M+H]+:236.1143,实测值:236.1121。
2-苯基-5,6,7,8-四氢咪唑并[2',1':2,3]噻唑并[5,4-c]吡啶盐酸盐(5c):白色固体,收率95%,mp 173.4~174.1 ℃;1H NMR(400 MHz,D2O), δ:10.23(s,1H),8.19(s,1H),7.72~7.66(m,2H),7.60~7.48(m,3H),4.56(s,2H),3.76(t, J=5.6 Hz,2H),3.25(t, J=6.0 Hz,2H);13C NMR(100 MHz,D2O), δ:165.2,153.3,139.3,138.6,131.8,127.9,122.1,101.5,59.8,56.3,47.3,41.9;MS(ESI) m/z:256.3(M+H)+;元素分析C14H14ClN3S实测值(计算值)/%:C 57.57(57.63),H 4.89(4.84),N 14.45(14.40);HRMS(ESI)计算值C14H13N3S [M+H]+:256.0830,实测值:256.0817。
2-(三氟甲基)-5,6,7,8-四氢咪唑并[2',1':2,3]噻唑并[5,4-c]吡啶盐酸盐(5d):白色固体,收率91%,mp 159.7~160.6 ℃;1H NMR(400 MHz,CD3OD), δ:10.12(s,1H),8.16(s,1H),3.95(s,2H),3.25(t, J=6.0 Hz,2H),2.82~2.79(m,2H);13C NMR(100 MHz,CD3OD), δ:161.4,129.5,122.5,119.7,101.4,59.7,52.1,42.3,27.3;MS(ESI) m/z:248.2(M+H)+;元素分析C9H9ClF3N3S实测值(计算值)/%:C 38.16(38.10),H 3.14(3.20),N,14.85(14.81);HRMS(ESI)计算值C9H8F3N3S [M+H]+:248.0391,实测值:248.0381。
2-(4-氯苯基)-5,6,7,8-四氢咪唑并[2',1':2,3]噻唑并[5,4-c]吡啶盐酸盐(5e):黄色固体,收率94%,mp 161.8~162.2 ℃;1H NMR(400 MHz,DMSO-d6), δ:10.16(s,1H),8.51(s,1H),7.87(d, J=8.8 Hz,2H),7.52(d, J=8.8 Hz,2H),4.32(m,2H),3.54(m,2H),3.11(m,2H);13C NMR(100 MHz,DMSO-d6), δ:165.2,153.3,139.3,138.6,131.8,129.3,124.7,104.1,59.8,56.3,47.3,41.9;MS(ESI) m/z:289.7(M+H)+;元素分析C14H13Cl2N3S实测值(计算值)/%:C 51.49(51.54),H 4.04(4.02),N 12.85(12.88);HRMS(ESI)计算值C14H12ClN3S [M+H]+:290.0440,实测值:290.0432。
2-(4-氟苯基)-5,6,7,8-四氢咪唑并[2',1':2,3]噻唑并[5,4-c]吡啶盐酸盐(5f):黄色固体,收率89%,mp 155.7~156.4 ℃;1H NMR(400 MHz,DMSO-d6), δ:10.21(s,1H),8.57(s,1H),7.69(d, J=8.8 Hz,2H),7.46(d, J=8.8 Hz,2H),4.29~4.25(m,2H),3.55~3.52(m,2H),3.10~3.06(m,2H);13C NMR(100 MHz,DMSO-d6 ), δ:164.7,154.1,139.3,138.7,132.2,129.6,124.5,104.3,59.8,56.3,47.5,42.3;MS(ESI) m/z:274.4(M+H)+;元素分析C14H13ClFN3S实测值(计算值)/%:C 54.19(54.28),H 4.34(4.23),N 13.55(13.56);HRMS(ESI)计算值C14H12FN3S [M+H]+:274.0736,实测值:274.0718。
2-甲基-5,6,7,8-四氢咪唑并[2',1':2,3]噻唑并[5,4-c]吡啶盐酸盐(5g):白色固体,收率97%,mp 158.1~159.6 ℃;1H NMR(400 MHz,DMSO-d6), δ:10.17(s,1H),7.97(s,1H),4.11(s,2H),3.62(t, J=6.0 Hz,2H),2.83(d, J=6.0 Hz,2H),2.21(s,3H);13C NMR(100 MHz,DMSO-d6 ), δ:159.6,131.4,130.1,117.6,98.9,59.3,53.2,44.6,21.7;MS(ESI) m/z:193.2(M+H)+;元素分析C9H12ClN3S实测值(计算值)/%:C 46.97(47.05),H 5.34(5.27),N 18.17(18.29),HRMS(ESI)计算值C9H11N3S [M+H]+:194.0674,实测值:194.0663。
2-异丙基-5,6,7,8-四氢咪唑并[2',1':2,3]噻唑并[5,4-c]吡啶盐酸盐(5h):白色固体,收率94%,mp 184.6~185.1 ℃;1H NMR(400 MHz,DMSO-d6), δ:10.11(s,1H),8.37(s,1H),4.33(s,2H),3.59(t, J=5.6 Hz,2H),3.21(d, J=8.0 Hz,1H),2.47~2.44(m,2H),1.25(s,6 H);13C NMR(100 MHz,DMSO-d6 ), δ:160.4,132.7,128.9,116.3,100.6,61.1,54.8,45.6,32.6,22.9;MS(ESI) m/z:222.3(M+H)+元素分析C11H16ClN3S实测值(计算值)/%:C 51.31(51.25),H 6.23(6.25),N 16.37(16.30);HRMS(ESI)计算值C11H15N3S [M+H]+:222.0987,实测值:222.0967。
2-(4-硝基苯基)-5,6,7,8-四氢咪唑并[2',1':2,3]噻唑并[5,4-c]吡啶盐酸盐(5i):白色固体,收率87%,mp 192.6~193.4 ℃;1H NMR(400 MHz,DMSO-d6), δ:10.37(s,1H),8.49(s,1H),8.17(d, J=8.8 Hz,2H),7.97(d, J=8.8 Hz,2H),4.33~4.30(m,2H),3.38~3.34(m,2H),2.95~2.91(m,2H);13C NMR(100 MHz,DMSO-d6), δ:165.9,156.4,136.7,131.5,129.6,127.7,121.5,102.6,62.3,55.4,42.8,41.3;MS(ESI) m/z:301.4(M+H)+;元素分析C14H13ClN4O2S实测值(计算值)/%:C 49.99(49.93),H 3.84(3.89),N 16.65(16.64);HRMS(ESI)计算值C14H12N4O2S [M+H]+:301.0681,实测值:301.0669。
2-(对甲苯基)-5,6,7,8-四氢咪唑并[2',1':2,3]噻唑并[5,4-c]吡啶盐酸盐(5j):白色固体,收率92%,mp 177.5~178.3 ℃;1H NMR(400 MHz,DMSO-d6), δ:10.25(s,1H),8.81(s,1H),7.84(d, J=8.8 Hz,2H),7.47(d, J=8.8 Hz,2H),4.61~4.59(m,2H),3.32(d, J=8.0 Hz,2H),2.76~2.73(m,2H),2.21(s,3H);13C NMR(100 MHz,DMSO-d6), δ:160.3,155.8,136.7,129.4,127.6,124.9,118.1,101.7,65.3,54.5,42.2,42.5,27.6;MS(ESI) m/z:270.4(M+H)+;元素分析C15H16ClN3S实测值(计算值)/%:C 58.97(58.91),H 5.24(5.27),N 13.69(13.74);HRMS(ESI)计算值C15H15N3S [M+H]+:270.0987,实测值:270.0966。
参考文献[12,13],收集处于生长期乳腺癌细胞MCF-7,采用四唑盐(MTT)法对所得的目标化合物进行初步的抗肿瘤细胞活性测试。 在培养瓶中加入0.25%胰蛋白酶消化液,使其贴壁细胞脱落,制成细胞悬液(约4×104个/mL)。 将细胞悬浮液注入96孔板上(180 μL/孔),置37 ℃恒温CO2培养箱培养24 h。 加入目标化合物的二甲基甲酰胺(DMF)溶液(20 μL/孔),再加入80 μL含10%(体积分数)血清培养液,培养48 h。 将MTT加入96孔板中(20 μL/孔),置于培养箱中4 h。 吸去上清液,加入二甲基亚砜(DMSO)(150 μL/孔),在平板摇床振摇6 min。 用酶联免疫检测仪在波长在470 nm处测定每孔的吸光值(OD值)。 以未加受试药物,而只加相应溶媒的受试组作为阴性对照,以顺铂为阳性对照计算细胞抑制率[10,11],测试3次求其平均值。 计算公式如下:细胞抑制率/%=100×(阴性对照组OD值-受试药物组OD值)/阴性对照组OD值。
由于水的存在会影响生成化合物3的反应往正向进行,而所使用的对甲基苯磺酸含有一分子水,且反应过程中有水产生,因此在反应过程中通过分水器除去水来促进反应的进行。 在实验过程中我们发现,反应温度对反应收率很大影响,为了进一步优化反应条件,以化合物2反应生成化合物3为模型反应,进一步研究了温度对反应收率的影响(如表1)。
表1 反应温度对化合物3产率的影响 Table 1 Effect of the reaction temperature on the yield of compound 3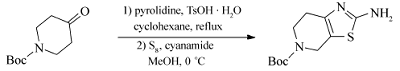 |
由表1可见,化合物3的收率随温度的升高而增加,当温度达到90 ℃时收率最高,达到了59%,继续升高温度会导致副产物的增加,收率逐渐降低,最终得出90 ℃为最佳反应温度。
在化合物4a的合成过程中,涉及到氨基和羰基的缩合以及卤素与胺基氢的取代成环反应。 为了使这两步反应充分进行,并且减少副产物的生成,提高产物收率,我们对反应溶剂进行了筛选(见表2)。
由表2可知,对于反应溶剂,反应在1,4-二氧六环、苯和甲苯中比甲醇、乙醇和乙腈中效果好,收率分别达到80%、82%和76%,说明极性较小的溶剂有利于反应;但是当二氯甲烷为溶剂时,收率只有23%,这是由于反应回流温度过低所致;鉴于苯的毒性较大和甲苯沸点太高不易回收,我们选择1,4-二氧六环为最佳反应溶剂。
表2 反应溶剂对化合物4a产率的影响 Table 2 Effect of the reaction solvent on the yield of compound 4a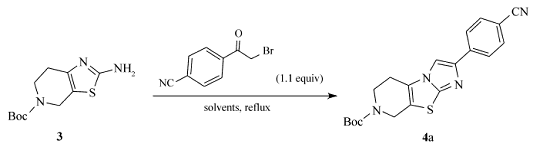 |
以4-哌啶酮为原料,经过胺基保护、缩合、环合、脱保护等步骤,合成了10种5,6,7,8-四氢咪唑并[2',1':2-3]噻吩并[5,4-c]哌啶类化合物。 目标化合物5a~5j对乳腺癌细胞MCF-7均有一定的抑制效果,其中化合物5a、5d和5e抑制活性优于阳性参照物顺铂。 当取代基为吸电子基抗肿瘤活性要高于给电子基,作用机理还在进一步的探索当中。 总之,该类化合物表现出较好的抗肿瘤活性,具有潜在的研究价值,对其它肿瘤细胞的抑制作用值得更深一步的研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|