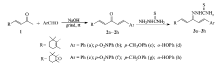
根据活性亚结构拼接原理,通过紫罗兰酮与(取代)苯甲醛反应合成了紫罗兰酮基双查尔酮,然后经与氨基硫脲缩合得到一系列未见报道的新型含紫罗兰酮、查尔酮及氨基硫脲3种优势结构单元的杂化体,它们的化学结构经傅里叶变换红外光谱(FT-IR)、核磁共振波谱(1H NMR、13C NMR)、元素分析及质谱(MS)等测试技术所证实。 采用溴化噻唑蓝四氮唑(MTT)法初步测定其体外抗肿瘤活性(乳腺癌细胞(MCF-7),肝癌细胞(HepG2),肺癌细胞(A549)),结果表明,对于不同类型的肿瘤细胞,化合物展现较好的增殖抑制活性。 尤其是化合物3a与3b对MCF-7细胞展现较强的抗增殖活性,半数致死量(IC50)值分别为10.83和7.62 μmol/L,化合物3e对A549细胞显示一定的增殖抑制活性效果(IC50值为13.36 μmol/L),化合物3f对HepG2细胞表现了高效的抗增殖活性(IC50值为8.55 μmol/L)。 目标物的抗增殖活性与紫罗兰酮结构及查尔酮环上不同电子效应的取代基有关。
In this work, a variety of new thiosemicarbazone derivatives were prepared by combining ionoe with chalcone and thiosemicarbazide according to the structure-activity combination principle. The ionone-based dichalcones were firstly synthesized through the condensation of ionone and substituted benzaldehydes, followed by thiosemicarbazide to obtain the target products. Their structures were confirmed by fourier transform infrared spectroscopy(FT-IR), nuclear magnetic resonance spectroscopy(1H NMR and13C NMR), elemental analysis, and mass spectrometry(MS). The in vitro antitumor activities against MCF-7(human breast cancer), HepG2(human liver cancer) and A549(human lung cancer) cells were tested using a 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2- H-tetrazolium bromide(MTT) method. The bioassay results demonstrate that compounds 3a and 3b display highly effective antiproliferative effects against MCF-7 cells with half maximal inhibitory concentration(IC50) values of 10.83 and 7.62 μmol/L, respectively. Compound 3e exhibits preferable antiproliferative activities against A549 cells with an IC50 value of 13.36 μmol/L, while compound 3f shows the best inhibitory effect against HepG2 cells with an IC50 value of 8.55 μmol/L. Antitumor experiments show that the activities of these compounds are mainly affected by ionone and substituted groups in aromatic rings of chalcone.
缩氨基硫脲衍生物具有较高的抗菌、抗病毒、抗肿瘤、抗疟疾、抗结核等生物活性, 在医药和临床领域备受关注[1,2,3,4,5,6,7,8]。 其中, =NNHHC(S)N—结构为缩氨基硫脲化合物的基本活性单元,N上的不同结构会影响其抗菌和抗肿瘤等生物活性[8,9,10]。 此外,查尔酮也是一类重要的具有生物活性的化合物,其分子结构具有较大柔性且含多个反应中心,能与不同受体结合,从而具有抗炎、抗肿瘤、抗菌、抗病毒、抗溃疡和解痉等药理活性,已用于防治心血管疾病、免疫系统疾病及癌症治疗等[11,12,13,14,15,16]。 近来发现一些含紫罗兰酮结构片段的天然和非天然产物具有多种优异的生物活性,且对多种肿瘤细胞有很好的抗增殖作用,并对肿瘤细胞的转移有潜在的影响[17,18]。 本文根据活性亚结构拼接和活性叠加原理,合成了8种未见文献报道的紫罗兰酮基双查尔酮缩氨基硫脲衍生物,并初步测试了它们对乳腺癌细胞株MCF-7、肝癌细胞株HepG2和肺癌细胞株A549的抑制活性。其合成路线如Scheme 1所示。
INOVA-400MHz型核磁共振仪(NMR,美国Varian公司);AVATAR-360-FT型傅里叶变换红外光谱仪(FT-IR,美国Nicolet公司);XRC-1型显微熔点仪(温度计未校正,四川大学科仪厂);Xevo G2 QTof型质谱仪(MS,美国Waters公司);BioTek Epoch型酶标仪(美国BioTek公司)。
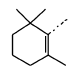
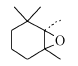
肝癌细胞株(HepG2)、乳腺癌细胞株(MCF-7)和肺癌细胞株(A549)来源于湖南大学生物工程研究中心。 β-紫罗兰酮(气相色谱分析纯度为96%, 工业级),其余试剂均为国产市售分析纯,液体醛在使用前经蒸馏纯化;5,6-环氧- β-紫罗兰酮的合成参照文献[19]。
参考文献[19]方法:将20 mmol紫罗兰酮或环氧紫罗兰酮(1)和20 mmol(取代)苯甲醛在研钵中混合均匀,再加入15 mmol Na2CO3和5 mmol NaOH固体,研磨5~15 min至产生糊状混合物。 加入50 mL乙醇/水溶液(体积比1:1),用5%盐酸调节pH值为7左右,产生大量固体。 抽滤,水洗,干燥,用95%乙醇重结晶,得晶体2。
将20 mmol化合物2和20 mmol氨基硫脲置于100 mL三口瓶中,加入50 mL乙醇,混合均匀后,用冰醋酸调节pH值为5左右,搅拌回流4 h,薄层色谱(TLC)监控反应进程。 反应完毕,用旋转蒸发仪除乙醇,冰水浴冷却,析出固体,抽滤,95%乙醇重结晶,得晶体3a~3h。
1-苯基-5-(2,6,6-三甲基环己烯-1-基)-1,4-戊二烯-3-酮缩氨基硫脲(3a):乳白色固体,产率65%, mp 139.4~141.6 ℃;1H NMR(CDCl3,400 MHz), δ:1.16(s,3H),1.23(s,3H),1.54(m,2H),1.72(m,2H),1.82(s,3H),1.90(m,2H),2.54(s,1H),3.39(s,2H),5.32(d, J=16 Hz,1H),5.71(d, J=16 Hz,1H),6.58(d, J=16 Hz,1H),7.19(m,1H),7.30(d, J=6 Hz,1H),7.38(m,2H),7.55(d, J=6 Hz,2H);13C NMR(CDCl3,100 MHz), δ:18.9(t),23.7(q),24.6(q),29.0(q),32.7(t),34.7,39.9(t),123.1(d),124.4(d),126.9(d),
2×127.9(d),2×128.9(d),136.1(s),140.0(d),146.3(d),138.3 (s),160.1,180.4;IR (KBr), σ/cm-1:3371,3265,3178,1640,1605,1533,1508,1489,1235,760,696;C21H27N3S元素分析(计算值)/%:C 71.32(71.35),H 7.74 (7.70),N 11.80 (11.89);C21H28N3S [M+H]+ MS(ESI)(计算值):353.5(354.2 )。
1-(4-硝基苯基)-5-(2,6,6-三甲基环己烯-1-基)-1,4-戊二烯-3-酮缩氨基硫脲(3b):浅黄色固体,产率73%,mp 165.3~166.7 ℃;1H NMR(CDCl3,400 MHz), δ:1.18(s,3H),1.26(s,3H),1.57(m,2H),1.70(m,2H),1.85(s,3H),1.92(m,2H),2.48(s,1H),3.45(s,2H),5.40(d, J=16 Hz,1H),5.90(d, J=16 Hz,1H),6.62(d, J=16 Hz,1H),7.35(m,1H),7.98(d, J=6 Hz,2H),8.23(d,J=6 Hz,2H);13C NMR(CDCl3,100 MHz), δ:19.2(t),21.7(q),23.4(q),28.3(q),35.6 (s),41.1(t),34.2(t),120.8(d),
123.0(d),2×124.0(d),2×129.1 (d),132.6,138.2,139.1(d),141.0,143.0(d),150.3,158.3,183.0;IR (KBr), σ/cm-1:3396,3205,
3169,1617,1601,1542,1528,1490,1224,1079,839;C21H26N4O2S元素分析(计算值)/%:C 63.25(63.29),H 6.62(6.58),N 14.11(14.06);C21H27N4O2S [M+H]+MS(ESI)(计算值):398.5(399.2)。
1-(4-甲氧基苯基)-5-(2,6,6-三甲基环己烯-1-基)-1,4-戊二烯-3-酮缩氨基硫脲(3c):深黄色固体, 产率49%,mp 150.1~152.0 ℃;1H NMR(CDCl3,400 MHz), δ:1.20(s,3H),1.25(s,3H),1.54(m,2H),1.76(m,2H),1.80(s,3H),1.96(m,2H),2.53(s,1H),3.44(s,2H),3.92(s,3H),
5.35(d, J=16 Hz,1H),5.72(d, J=16 Hz,1H),6.55(d, J=16 Hz,1H),6.94(d, J=6 Hz,2H),7.67(m,1H),
7.82(d, J=6 Hz,2H);13C NMR(CDCl3,100 MHz), δ:18.9(t),23.7(q),25.2(q),28.1(q),33.3(t),34.2,39.0(t),58.3(q),2×116.8(d),
122.4(d),124.2(d),126.6,130.1,2×131.1(d),138.6(d),138.8,144.3(d),153.4,160.1,185.6;IR(KBr), σ/cm-1:3412,3263,3185,1632,1609,1550,1523,1483,1225,1104,821;C22H29N3OS元素分析(计算值)/%:C 68.95(68.89),H 7.58(7.62),N 10.89(10.96);C22H30N3OS [M+H]+MS(ESI)计算值:383.5(384.2)。
1-(2-羟基苯基)-5-(2,6,6-三甲基环己烯-1-基)-1,4-戊二烯-3-酮缩氨基硫脲(3d):浅黄色固体,产率73%,mp 143.9~146.2 ℃;1H NMR(CDCl3,400 MHz), δ:1.18(s,3H),1.27(s,3H),1.51(m,2H),1.71(m,2H),1.85(s,3H),
1.98(m,2H),2.51(s,1H),3.40(s,2H),5.38(m,1H),5.42(d, J=16 Hz,1H),5.50(m,1H),5.69(s,1H),6.52(d, J=16 Hz,1H),6.80(d, J=16 Hz,1H),
7.11(m,1H),7.16(m,1H),7.70(d, J=16 Hz,1H);13C NMR(CDCl3,100 MHz), δ:18.8(t),20.3(q),26.6(q),27.9(q),30.8(t),
32.0 (s),40.1(t),118.9(d),120.2(d),121.3,123.0(d),123.8(d),128.4(d),128.8(d),130.0(d),133.2,137.9,
143.2(d),158.2,160.1,183.2;IR(KBr), σ/cm-1:3430,3250,3240~2900,1628,1610,1558,1540,1507,1231,1085,756;C21H27N3OS元素分析(计算值)/%:C 68.31(68.26),H 7.41(7.36),N 11.30(11.37);C21H27N3OS [M+H]+MS(ESI)(计算值):369.5 (369.2)。
1-苯基-5-(2,2,6-三甲基-7-氧杂-双环[4.1.0]庚烷-1-基)-1,4-戊二烯-3-酮缩氨基硫脲(3e):黄色固体,产率59%,mp 165.3~167.5 ℃;1H NMR(CDCl3,400 MHz), δ:0.90(s,3H),0.98(s,3H),1.25(s,3H),1.31(m,1H),1.44(m,2H),1.54(m,2H),1.65(m,1H),2.46(s,1H),3.31(s,2H),5.00(d, J=16 Hz,1H),5.70(d, J=16 Hz,1H),5.82(d, J=16 Hz,1H),6.80(m,1H),7.29(m,1H),7.42(m,2H),7.68(d, J=8 Hz,2H);13C NMR(CDCl3,100 MHz), δ:17.9(t),21.6(q),26.5(q),26.9(q),31.0(t),33.48,35.3(t),69.5,75.7,121.0(d),
124.5(d),127.8(d),2×128.6(d),2×129.9(d),134.1,140.1(d),145.4 (d),156.3,182.2;IR(KBr), σ/cm-1:3412,3301,3265,1633,1600,
1579,1556,1501,1325,1220,1095,755,691;按C21H27N3OS元素分析(计算值)/%:C 68.20(68.26),H 7.40(7.36),N 11.41(11.37);MS(ESI)C21H28N3OS [M+H]+(计算值):369.5(370.2)。
1-(4-硝基苯基)-5-(2,2,6-三甲基-7-氧杂-双环[4.1.0]庚烷-1-基)-1,4-戊二烯-3-酮缩氨基硫脲(3f):红棕色固体,产率70%,mp 143.4~146.0 ℃;1H NMR(CDCl3,400 MHz), δ:0.93(s,3H),1.02(s,3H),1.27(m,1H),1.37(s,3H),1.42(m,2H),1.56(m,2H),1.68(m,1H),2.49(s,1H),3.38(s,2H),5.12(d, J=16 Hz,1H),5.85(d, J=16 Hz,1H),6.03(d, J=16 Hz,1H),8.05(m,1H),8.11(d, J=8 Hz,2H),8.21(d, J=8 Hz,2H);13C NMR(CDCl3,100 MHz), δ:17.1(t),20.9(q),25.2(q),26.5(q),30.4(t),34.0,35.6(t),
68.7,74.1,120.8(d),123.1(d),2×123.4(d),2×123.6(d),138.8,141.3(d),146.6(d),148.0,155.7,181.1;IR(KBr), σ/cm-1:3362,3201,3180,1637,1598,1562,1523,1486,1309,1219,1059,826;C21H26N4O3S元素分析(计算值)/%:C 60.79(60.85),H 6.37(6.32),N 13.47(13.52);MS(ESI)C21H27N4O3S [M+H]+(计算值):414.5 (415.2)。
1-(4-甲氧基苯基)-5-(2,2,6-三甲基-7-氧杂-双环[4.1.0]庚烷-1-基)-1,4-戊二烯-3-酮缩氨基硫脲(3g):墨绿色固体,产率60%,mp 172.8~174.7 ℃;1H NMR(CDCl3,400 MHz), δ:0.90(s,3H),0.99(s,3H),1.26(s,3H),1.31(m,1H),1.45(m,2H),1.52(m,2H),1.65(m,1H),2.50(s,1H),
3.40(s,2H),3.94(s,3H),5.09(d, J=16 Hz,1H),5.72(d, J=16 Hz,1H),5.93(d, J=16 Hz,1H),7.13(d, J=8 Hz,2H),7.79(d, J=8 Hz,2H),8.01(m,1H);13C NMR(CDCl3,100 MHz), δ:18.0(t),21.1(q),24.7(q),25.1(q),30.2(t),33.4,36.0(t),60.6(q),68.8,73.9,2×113.4(d),
120.9(d),123.9(d),129.4,2×132.1(d),140.4(d),146.0(d),157.8(s),162.6,183.1;IR(KBr), σ/cm-1:3379,3180,3174,1628,1600,1577,1508,1483,1317,1216,1061,804;C22H29N3O2S元素分析(计算值)/%:C 66.06(66.13),H 7.38(7.32),N 10.48(10.52);MS(ESI)C22H30N3O2S [M+H]+(计算值):399.6(400.2)。
1-(2-羟基苯基)-5-(2,2,6-三甲基-7-氧杂-双环[4.1.0]庚烷-1-基)-1,4-戊二烯-3-酮缩氨基硫脲(3h):浅黄色固体,产率82%,mp 132.0~135.5 ℃;1H NMR(CDCl3,400 MHz), δ:0.92(s,3H),1.02(s,3H),1.21(s,3H),1.35(m,1H),1.43(m,2H),1.55(m,2H),1.68(m,1H),2.48(s,1H),3.39(s,2H),5.13(d, J=16 Hz,1H),5.31(m,1H),5.56(m,1H),5.85(d, J=16 Hz,1H),6.97(m,1H),7.15(m,1H),7.24(m,1H),7.66(d, J=8 Hz,1H),7.75(m,1H);13C NMR(CDCl3,100 MHz), δ:17.9(t),23.8(q),25.0(q),26.9(q),31.0(t),34.1,35.9(t),68.5,73.4,118.9(d),120.4(d),
121.3(d),123.4,124.1(d),128.1(d),129.3(d),130.3(d),145.7(d),158.1,160.0,185.1;IR(KBr), σ/cm-1:3417,3330,3250~2900,1618,1603,1541,1491,1464,1233,1023,829;C21H27N3O2S元素分析(计算值)/%:C 65.45(65.42),H 7.11 (7.06),N 10.88(10.90);MS(ESI)计算值C21H28N3O2S [M+H]+:385.5(386.2)。
以顺铂为阳性对照,采用MTT法[20]测试了化合物3a~3h对体外培养肿瘤细胞的增殖抑制活性。 实验所用肿瘤细胞株分别为乳腺癌细胞株(MCF-7),肝癌细胞株(HepG2)及肺癌细胞株(A549)。 取对数生长期的细胞,以5×104/mL的细胞悬液接种于96孔板内,培养过夜后加入化合物,每种化合物设置6个浓度,每个浓度3个复孔,然后置于入培养箱中孵育48 h。 弃上清,每孔加入MTT溶液(5 g/L,20 μL),继续孵育4 h。 弃上清,每孔加入150 μL二甲基亚砜(DMSO),低速震荡10 min,用酶标仪检测490 nm波长的吸光度,计算半抑制浓度IC50值。
本研究以(取代)苯甲醛与不同结构的紫罗兰酮为起始原料,经缩合反应得到紫罗兰酮基双查尔酮(2a~2h),再与氨基硫脲缩合得到目标化合物(3a~3h),但反应的产率较低,可能氨基硫脲与查尔酮之间还存在Michael加成等副反应。 通过IR、1H NMR、13C NMR、元素分析及质谱等手段对目标化合物进行了结构表征。 IR谱图中,3420~3200 cm-1的吸收峰为N—H伸缩振动;3150~3000 cm-1处强吸收峰为苯环的C—H伸缩振动;在1640~1610 cm-1处有强吸收峰,为C=C伸缩振动;1610~1590 cm-1的强吸收峰为C=N伸缩振动;1580~1460 cm-1处的强吸收峰属于苯环C=C骨架振动;1235~1216 cm-1处吸收峰为C=S的伸缩振动,在2700~2500 cm-1处没有S—H的吸收峰,说明C=S以酮式存在。1H NMR谱图中, δ 7.19~8.05处出现的宽峰为硫脲的活泼氢(NH—C=S),仲胺上的活泼氢(NH)在 δ 2.45~2.55处呈现单峰,伯胺上的活泼氢(NH2)在 δ 3.30~3.45处出现单峰。 由于伯胺上的H原子与C=S上的S形成了分子间氢键,其化学位移相对于仲胺大幅度向低场移动,C=S键的红外光谱向低波数移也证实了这一点。13C NMR谱图中,在 δ 181~185范围内出现C=S的碳吸收峰,在 δ 120~150范围内出现苯环的碳吸收峰。 元素分析及质谱分析结果与其实验式相吻合。
随后,以顺铂(DDP)为阳性对照药,MCF-7、HepG2及A549为待测细胞株,采用MTT比色法,测试了所合成的目标化合物(3a~3h)及氨基硫脲(HL)、 β-紫罗兰酮( β-ionone)和5,6-环氧- β-紫罗兰酮(5,6-oxo- β-ionone)的体外抗肿瘤活性,结果如表1所示。 活性结果表明,对于不同的肿瘤细胞,目标化合物表现出不一样的抑制活性。 其中,化合物3a、3b和3e均显示较强的抗肿瘤活性。 化合物3a与3b对乳腺癌细胞株MCF-7有选择性的抑制作用,IC50值分别为10.83和7.62 μmol/L,表现出优于顺铂或与顺铂相当的细胞毒活性。 尤其是,4-nitrophenyl>H>4-methoxyphenyl/2-hydroxyl,表明查尔酮环上的取代基对其活性影响显著且吸电子基团的活性强于给电子基团。 与化合物3a和3b相比,化合物3e和3f对MCF-7细胞的抑制活性相对较差,但化合物3e对A549细胞株的IC50值为13.36 μmol/L,其细胞毒活性与顺铂相当,化合物3f对HepG2细胞株表现出优异的抑制活性,其IC50值为8.55 μmol/L,说明紫罗兰酮的不同结构也会影响其抑制活性。 因此,化合物的生物活性与紫罗兰酮结构及查尔酮环上的取代基电子效应有关。 其它进一步的结构优化和构效关系的深入研究正在进行。
| 表1 化合物3a~3h的体外抗肿瘤活性 a Table 1 Antitumor activities of compounds 3a~3h in vitro |
采用活性亚结构拼接和活性叠加原理,将紫罗兰酮、(取代)苯甲醛及氨基硫脲连接起来,设计合成了一系列紫罗兰酮基双查尔酮缩氨基硫脲类化合物,其结构经IR、1H NMR、13C NMR、元素分析及质谱确证。 采用MTT比色法测试了目标化合物对MCF-7、HepG2及A549细胞株的抑制增殖活性。 结果表明,部分化合物对肿瘤细胞有较好的抑制活性,下一步工作将集中于通过类似物的设计、合成及构效关系研究,以发现更强的抗肿瘤活性化合物。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|